某院ICU醫(yī)院獲得性肺炎患者痰分離MRSA耐藥基因和pvl基因攜帶情況
夏 雯,吳 亮,陰 晴,戴曉玥,鄒治情,吳 瑤,周亞玲,何 蕾
(1. 江蘇大學(xué)醫(yī)學(xué)院,江蘇 鎮(zhèn)江 212013; 2. 江蘇大學(xué)附屬醫(yī)院檢驗科,江蘇 鎮(zhèn)江 212000)
金黃色葡萄球菌(Staphylococcusaureus,SA)是造成醫(yī)院感染的主要病原菌之一,可以導(dǎo)致呼吸系統(tǒng)、皮膚軟組織、泌尿系統(tǒng)感染,以及心內(nèi)膜炎等[1-2]。近年來,耐甲氧西林金黃色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)已成為臨床常見的耐藥菌株[3-4]。在全球范圍內(nèi),從醫(yī)院感染患者分離的SA菌株中MRSA菌株已占45%以上[5-6]。
SA主要耐藥基因為mecA,同時也存在其他的耐藥基因,主要包括aacA-D、tetK、tetM、msrA、msrB、ermA、ermC 、vatA、vatB、vatC、femB 和linA等。其中aac類、erm類、tet類基因分別可誘導(dǎo)SA對氨基糖苷類、大環(huán)內(nèi)酯類和四環(huán)素類抗生素耐藥[7]。SA的重要毒力因子包括殺白細胞素(panton-valentine leukocidin,PVL)、溶血毒素(hemolysin)、腸毒素(enterotoxin)、中毒休克綜合征毒素I(toxic shock syndrome toxin)和表皮剝落毒素(exfoliative toxin)等。PVL是近年來被關(guān)注的毒力因子,攜帶pvl基因的MRSA菌株具有高侵襲性,可破壞人體的免疫系統(tǒng),導(dǎo)致皮膚和軟組織感染以及難治性壞死性肺炎等。研究[8]表明,MRSA社區(qū)感染菌株中pvl基因攜帶率高達50%~93%,感染該菌株的患者在無法獲得及時治療的情況下病死率極高,而MRSA醫(yī)院感染菌株中pvl基因攜帶率較低。目前,對于醫(yī)院感染SA基因攜帶情況研究較少。本研究對江蘇大學(xué)附屬醫(yī)院重癥監(jiān)護病房(ICU)醫(yī)院獲得性肺炎患者痰標本中的MRSA菌株耐藥基因和pvl基因攜帶情況進行調(diào)查,探討該院SA的耐藥機制,評估其致病力。
1 材料與方法
1.1 菌株來源 2018年6—12月江蘇大學(xué)附屬醫(yī)院ICU中醫(yī)院獲得性肺炎MRSA感染患者的痰標本,納入標準:醫(yī)院獲得性肺炎患者,且無其他部位感染,診斷符合《醫(yī)院感染診斷標準》中下呼吸道感染的診斷標準。所有菌株均經(jīng)VITEK 2 Compact全自動細菌鑒定系統(tǒng)鑒定為MRSA。
1.2 方法
1.2.1 儀器和試劑 VITEK 2 Compact為法國生物梅里埃公司產(chǎn)品,2×PCR 預(yù)混液購自南京 Vazyme 公司, 蛋白酶K溶液(20 mg/mL)為美國 Merck公司產(chǎn)品,電泳級瓊脂糖為西班牙進口分裝,PCR擴增儀為杭州博日公司所生產(chǎn),溶菌酶溶液(20 mg/mL)為美國Amersco公司產(chǎn)品,DNA Marker購自大連寶生物公司。
1.2.2 DNA的提取 參考文獻[9]報道的改良堿裂解法提取SA DNA,具體方法如下:取過夜培養(yǎng)新鮮SA菌液1 mL以12 000 rpm離心2 min,棄上清,于沉淀中加入200 μL溶液Ⅰ和20 μL溶菌酶溶液充分吹打,使沉淀完全重懸,置37℃溫箱中過夜裂解。次日加入20 μL 蛋白酶K溶液,于55℃水浴30 min后加入現(xiàn)配的300 μL溶液Ⅱ,上下顛倒10次并靜置5 min。加入冰上預(yù)冷的溶液Ⅲ,上下顛倒5次后冰上放置5 min,以12 000 rpm離心5 min后取上清600 μL,加入等體積的酚∶氯仿∶異丙醇(25∶24∶1),劇烈震蕩后置4℃高速離心機以12 000 rpm離心10 min,取上清500 μL并加入400 μL異丙醇,于-20℃中放置4 h沉淀DNA,沉淀使用70%乙醇洗滌2次放置空氣中干燥后,重新溶解于50 μL滅菌蒸餾水中,備用。
1.2.3 耐藥基因的檢測 應(yīng)用聚合酶鏈反應(yīng)(PCR)法檢測SA攜帶的耐藥基因。PCR反應(yīng)體積共25 μL,包括2×PCR預(yù)混液12.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,最終以滅菌蒸餾水補足體積至25 μL。循環(huán)條件:94℃變性5 min,94℃ 30 s、55℃ 30 s、72℃ 60 s,35個循環(huán),72℃ 延伸10 min。引物序列和退火溫度見表1[10]。取5 μL擴增產(chǎn)物以1.2%瓊脂糖凝膠電泳檢測結(jié)果,并照相記錄[11]。
1.2.4 SCCmec類型的檢測 參考文獻[12]中SA SCCmec基因分型的方法,引物序列見表2。PCR反應(yīng)體積共25 μL,包括2×PCR預(yù)混液12.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,以滅菌蒸餾水補足體積至25 μL。循環(huán)條件:94℃變性5 min,94℃ 45 s、65℃ 45 s、72℃ 90 s,10個循環(huán),再94℃ 45 s、55℃ 45 s、72℃ 90 s,20個循環(huán),72℃ 延伸10 min。PCR反應(yīng)結(jié)束后,采用1.2%瓊脂糖電泳檢測結(jié)果,并照相記錄。
表1SA耐藥基因寡核苷酸引物序列及PCR擴增條件
Table1Oligonucleotide primer sequences and PCR amplification conditions ofStaphylococcusaureusresis-tance gene

基因 引物序列(5’-3’)退火溫度(℃)產(chǎn)物大小(bp)mecAF:AAAATCGATGGTAAAGGTTGGC 55532R:AGTTCTGCAGTACCGGATTTGCaacA-DF:TAATCCAAGAGCAATAAGGGC55227R:GCCACACTATCATAACCACTAermAF:AAGCGGTAAACCCCTCTGA55190R:TTCGCAAATCCCTTCTCAACermCF:AATCGTCAATTCCTGCATGT55299R:TAATCGTGGAATACGGGTTTGtetKF:GTAGCGACAATAGGTAATAGT55360R:GTAGTGACAATAAACCTCCTAtetMF:AGTGGAGCGATTACAGAA55158R:CATATGTCCTGGCGTGTCTAvatAF:TGGTCCCGGAACAACATTTAT55268R:TCCACCGACAATAGAATAGGGvatBF:GCTGCGAATTCAGTTGTTACA55136R:CTGACCAATCCCACCATTTTAvatCF:AAGGCCCCAATCCAGAAGAA55467R:TCAACGTTCTTTGTCACAACCmsrAF:GGCACAATAAGAGTGTTTAAAGG55940R:AAGTTATATCATGAATAGATTGTC CTGTTlinAF:GGTGGCTGGGGGGTAGATGTATTA ACT-GG55323R:GCTTCTTTTGAAATACATGGTATTT TTC-GA
1.2.5pvl基因的檢測 采用PCR檢測方法。根據(jù)文獻[13]合成SApvl基因檢測引物,引物序列為F:5’-ATGGTCAAAAAAAGACTATT-3’ R: 5’-TCAATTATGTCCTTTCACTTTAATTTC-3’,PCR擴增產(chǎn)物大小為939 bp。PCR反應(yīng)總體積為25 μL,其中2×PCR預(yù)混液12.5 μL,上、下游引物0.5 μL,DNA模板2 μL,以滅菌蒸餾水補足體積至25 μL。94℃變性5 min,94℃ 60 s、51℃ 60 s、72℃ 60 s,36個循環(huán),72℃ 延伸10 min。PCR反應(yīng)結(jié)束后,取5 μL擴增產(chǎn)物以1.2%瓊脂糖凝膠電泳檢測結(jié)果,并照相記錄。
表2SA SCCmec基因分型檢測引物序列及擴增產(chǎn)物大小
Table2Primer sequences and amplification product size of SCCmec genotyping ofStaphylococcusaureus

基因引物序列(5’-3’)產(chǎn)物大小(bp)SCCmecIF:GCTTTAAAGAGTGTCGTTACAGG613R:GTTCTCTCATAGTATGACGTCCSCCmecⅡF:CGTTGAAGATGATGAAGCG398R:CGAAATCAATGGTTAATGGACCSCCmecⅢF:CCATATTGTGTACGATGCG280R:CCTTAGTTGTCGTAACAGATCGSCCmecIVaF:GCCTTATTCGAAGAAACCG776R:CTACTCTTCTGAAAAGCGTCGSCCmecIVbF:TCTGGAATTACTTCAGCTGC493R:AAACAATATTGCTCTCCCTCSCCmecIVcF:ACAATATTTGTATTATCGGAGAGC200R:TTGGTATGAGGTATTGCTGGSCCmecIVdF:CTCAAAATACGGACCCCAATACA881R:TGCTCCAGTAATTGCTAAAGSCCmecVF:GAACATTGTTACTTAAATGAGCG325R:TGAAAGTTGTACCCTTGACACC
2 結(jié)果
2.1 一般資料 2018年6—12月江蘇大學(xué)附屬醫(yī)院ICU中,共有46例醫(yī)院獲得性肺炎MRSA感染的患者,其中男性36例(78.26%),女性10例(21.74%);年齡13~87歲。從痰標本中分離出MRSA 46株。46例患者的主要疾病為重癥肺炎,且均為呼吸機相關(guān)肺炎(VAP)。

表346株MRSA對7種抗菌藥物的耐藥情況
Table3Resistance of MRSA strains to 7 kinds of antimicrobial agents

抗菌藥物耐藥菌株耐藥率(%)紅霉素1941.30四環(huán)素1736.96環(huán)丙沙星1634.78克林霉素1634.78莫西沙星1226.09慶大霉素1123.91復(fù)方磺胺甲口惡唑1226.09
2.3 耐藥基因攜帶情況 46株MRSA中,攜帶多種耐藥基因。耐藥基因檢出率為10.87%~100%,以mecA基因檢出率最高,達100%,其次為femB、aacA-D、ermC基因,檢出率分別為71.74%、54.35%、52.17%。見表4、圖1。
2.4 毒力因子pvl基因檢測結(jié)果 46株MRSA中,30株檢出pvl基因,檢出率為65.22%。SApvl基因擴增產(chǎn)物大小為939 bp,其大小與預(yù)期結(jié)果一致。見圖2。
表446株MRSA耐藥基因攜帶情況
Table4Carrying status of resistance genes of 46 strains of MRSA
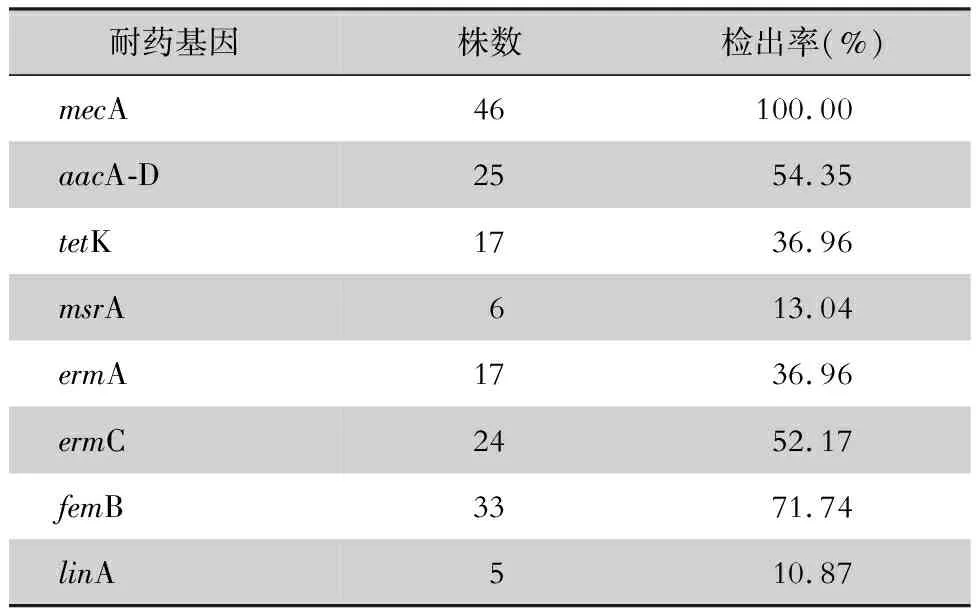
耐藥基因株數(shù)檢出率(%)mecA46100.00aacA-D2554.35tetK1736.96msrA613.04ermA1736.96ermC2452.17femB3371.74linA510.87

M:2 000 bp DNA分子質(zhì)量標準;1~9為陽性標本;N:陰性對照

M:2 000 bp DNA分子質(zhì)量標準;1~9:陽性標本;N:陰性對照
Figure2Electrophoresis map of PCR amplification pro-ducts of MRSApvlgene
2.5 SCCmec基因分型結(jié)果 46株MRSA中共檢出4種SCCmec基因類型,其中SCCmecⅡ型12株(26.09%),SCCmec Ⅲ型24株(52.17%),SCCmec Ⅳc型1株(2.17%),SCCmec Ⅴ型1株(2.17%)。見圖3。
3 討論
MRSA是臨床常見的多重耐藥菌,能引起中毒性休克、膿毒血癥和重癥肺炎等疾病,是醫(yī)院感染監(jiān)控的重點。由于抗菌藥物的長期大量使用,近年來臨床感染中MRSA的檢出率已高達50%~70%[14]。通常認為MRSA在社區(qū)和醫(yī)院感染菌株中的高分離率歸結(jié)于青霉素等抗菌藥物的長期大量使用,在抗菌藥物的正向選擇壓力下,對甲氧西林敏感的SA獲得mecA基因后轉(zhuǎn)變?yōu)镸RSA。本研究中,ICU醫(yī)院獲得性肺炎患者痰標本分離的MRSAmecA基因攜帶率達到100%。mecA基因是外源性基因,該基因可通過質(zhì)粒方式水平傳播并整合入SA SCCmec基因中,造成SA耐藥[12]。此外,SCCmec基因區(qū)域還存在各種其他耐藥基因,均可能誘導(dǎo)SA對其他抗菌藥物產(chǎn)生耐藥性[15]。SCCmec基因可以用于判斷SA的來源,共分為Ⅰ~Ⅴ5種類型,攜帶Ⅱ型和Ⅲ型SCCmec基因的菌株主要來源于醫(yī)院感染,其他類型主要來源于社區(qū)感染[4]。本研究中的MRSA主要為SCCmecⅡ、SCCmecⅢ型,為醫(yī)院感染菌株。傳統(tǒng)的SCCmec基因分型方法需以PCR法擴增整個SCCmec基因片段再進行測序分析,整個過程耗時費力,無法滿足臨床快速簡便的需要。本研究中使用的PCR法可以直接檢測出SCCmec基因型別,省去了傳統(tǒng)SCCmec基因分型檢測的繁瑣,并且該方法操作簡便、快速,適合于在臨床實驗室中廣泛推廣。SCCmec基因與MRSA的耐藥基因傳遞以及多重耐藥性密切相關(guān),MRSA SCCmec基因型別在不同地區(qū)比例分布差異較大,且各區(qū)域攜帶的耐藥基因也不相同,定期開展MRSA SCCmec基因分型及耐藥基因檢測對于判斷傳染源,控制醫(yī)院感染的發(fā)生和蔓延具有重要意義。

M:2 000 bp DNA分子質(zhì)量標準;1~6:陽性標本;N:陰性對照
圖3MRSA SCCmec基因分型PCR擴增產(chǎn)物電泳圖譜
Figure3Electrophoresis map of PCR amplification products of MRSA SCCmec genotyping
由ermA/ermC基因編碼的甲基化酶是MRSA對大環(huán)內(nèi)酯類抗生素耐藥的主要機制[15]。本研究菌株中對大環(huán)內(nèi)酯類藥物耐藥率為41.30%。ermA和ermC耐藥基因攜帶率共計為36.96%,耐藥基因的攜帶率低于細菌耐藥率。推測該現(xiàn)象可能與ermA/ermC基因存在上游調(diào)控基因有關(guān),但其確切機制有待進一步研究。
tetK編碼產(chǎn)四環(huán)素外排泵蛋白基因,該外排泵蛋白可以將藥物泵出細胞膜外,降低藥物濃度,導(dǎo)致SA對四環(huán)素類抗生素耐藥性。本研究中,MRSA對四環(huán)素耐藥率為36.96%,與tetK耐藥基因攜帶率完全相同,表明tetK是誘導(dǎo)該院MRSA獲得四環(huán)素耐藥性的重要原因,并且tetK也可以成為耐四環(huán)素SA的重要分子標記,可以用于此類細菌的快速篩查。
PVL是SA重要的外毒素,屬于膜孔形成毒素家族,最早由Van deVelde發(fā)現(xiàn),1932年由Panton和Valentine將其從溶血素中分離出來[16]。PVL可造成細胞或組織的壞死,致病性極強。研究[17]表明,社區(qū)獲得性MRSA中pvl基因攜帶率高達77%~100%,而醫(yī)院獲得性MRSApvl基因攜帶率不超過5% 。但本研究中ICU醫(yī)院獲得性肺炎患者痰中MRSApvl基因攜帶率高達65.22%,導(dǎo)致如此高的確切原因有待進一步研究,醫(yī)務(wù)人員對此結(jié)果也應(yīng)高度重視。
綜上所述,該院ICU分離的MRSA菌株攜帶多種耐藥基因,且pvl基因攜帶率也較高。在臨床治療過程需高度重視高毒力SA的出現(xiàn),合理使用抗菌藥物,降低細菌耐藥性的產(chǎn)生。

