建筑給水用銅管的電化學腐蝕問題與對策
羅振寧, 李亞濤, 張 健, 唐玉霖, 趙蘇含, 黃 韜
(1.同濟大學 環境科學與工程學院,上海200092;2.德房家(中國)管道系統有限公司,江蘇 無錫214101)
給水用銅管被認為是性質穩定[1-2]、性能安全[3]的金屬管材,具有悠久的歷史。在我國,給水用銅管的使用率非常低,《建筑給水排水設計規范》(GB 50015—2019)修訂中將不銹鋼管、銅管作為優先選擇的管材[4],但仍有關于銅管在特殊情況使用過程中出現銅濃度超限的介紹[5],甚至“藍水”等特殊現象的報道,導致了建筑給水銅管使用者的擔憂。
銅管的腐蝕是由于銅管在充滿有壓水流的正常工況下,水中含有溶解氧、Cl-離子、離子、等物質,單質銅可能在銅管的內表面上與Fe3+、O2等氧化劑構成各種原電池使銅管腐蝕,或與Fe、Ni 等金屬相接時構成原電池,加劇其他金屬管件的腐蝕。關于金屬銅的腐蝕研究,主要集中于銅片或銅管在各類極端情況下的電化學腐蝕。例如火電廠凝汽器銅管腐蝕的電化學機理、空調中鋼襯銅管腐蝕的電化學機理等[6-8]。目前,已有關于燃氣熱水器中無氧銅管在生活用水中銅管的腐蝕情況的研究[9],但國內聚焦于建筑給水領域的銅管的電化學腐蝕的研究相對較少。自來水性質相對溫和,水中存在低濃度的電解質,銅管產生的電化學腐蝕相對微弱[10],但因為關系到人們的身體健康,仍受到廣泛關注。
探究銅管的腐蝕原理與特性,尤其是電化學腐蝕特性,有利于了解銅管使用的邊界,促進建筑給水銅管的使用與推廣。因此,筆者對目前已有的金屬銅管的腐蝕,尤其是電化學腐蝕的特性進行了總結和歸納,分析了建筑給水用銅管腐蝕的原理與可能性,并對建筑給水領域的給水用銅管的電化學腐蝕防護提出建議。
1 電化學腐蝕的機理與分類
給水銅管所輸送的是自來水,其物理化學狀態相對穩定[11],但水中存在氫離子、溶解氧、自由氯、少量銨離子及其它電解質,銅管的使用也會與其它金屬管材連接,不可避免地形成電化學腐蝕。銅管的電化學腐蝕主要包括兩大類:陰極電化學腐蝕和陽極電化學腐蝕。在銅參與的電化學腐蝕當中,銅本身可作為陰極,也可作為陽極。
銅與其他用作管材的金屬相比不活潑,其作為陰極所發生的電化學腐蝕主要是安裝、焊接時造成了銅管與活潑金屬管件相接,致使陽極的其他活潑金屬加速腐蝕,這種腐蝕是可避免的。當銅作為陽極時,水中的氫離子、溶解氧、自由氯在銅表面被還原,銅管內表面的銅被氧化,這種腐蝕往往不可避免。因此在銅管使用中存在吸氧腐蝕、自由氯腐蝕、氯蝕、氨蝕等多種電化學腐蝕的可能,實際應用中銅管的陽極電化學腐蝕情況可能更多。
但銅管內表面一般有性質較為穩定氧化保護膜[5,12],成分主要是CuO 或Cu2O,可以防止內部銅受腐蝕[6]。
2 陰極電化學腐蝕
當銅管與其它金屬管道相接時,銅與鐵、鋅等相對活潑的金屬構成氧化還原電對,鐵、鎳等金屬將作為陽極失電子被氧化,發生腐蝕,而銅將作為陰極得電子被保護[2]。因此,在建筑給水領域,當銅管和其他活動性較強的金屬管件共同構成某一完整的單元時,銅作為陰極不會被腐蝕,但是作為陽極的其他金屬組分可能受到影響[1]。例如碳鋼管,作為陽極失電子時發生電化學腐蝕[2]。銅管與其他金屬連接,電化學腐蝕所帶來的管道破壞將導致水質變差,甚至泄漏問題,因此建筑給水中要避免此類情況的出現。
當銅管與碳鋼管直接連接,或者銅質、鋼質法蘭直接相接,在電解質存在的條件下,就會發生電化學腐蝕[2,13],導致鋼質管件出現腐蝕。當鐵-銅電對形成時,由于水中存在溶解氧,陰極的銅承擔惰性電極的角色,在陽極和陰極發生如式(1)和(2)所示的反應,鐵-銅電對形成后,鐵被腐蝕的總反應見式(3)。

可見當銅質與鐵質管件之間發生電化學腐蝕時,鐵將溶出使水質變差、管件受損。當鐵溶出嚴重時,在溶解氧、自由氯存在的條件下,Fe2+將被氧化為Fe3+,色度升高,影響水質。
當銅與其他金屬管件構成原電池時,作為陰極的銅不會直接被腐蝕,但會直接造成連接管件的腐蝕,需要引起重視。要避免銅管作為陰極的電化學腐蝕,主要有兩種方式。首先,在建筑的給水管道系統中,盡量全部采用銅質管道,以及銅質的閥、表、支撐配件等[13]。其次,當無法避免銅與其他較活潑金屬管件相接時,盡量消除銅和其他金屬的直接接觸,例如在碳鋼管與銅管接合處采取絕緣措施,或者用非金屬管件替代較活潑的金屬管件。
3 陽極電化學腐蝕
銅管發生陽極電化學腐蝕情況也存在,比較突出的主要有以下3 種情況:①Fe3+作為氧化劑時的腐蝕;②溶解氧作為氧化劑時吸氧腐蝕;③氯作為氧化劑時的腐蝕。
3.1 銅管Fe3+ -Cu 電化學腐蝕
原水中含鐵量高,水廠使用鐵鹽作為混凝劑等情況,都會使飲用水中含有一定量鐵離子,出廠水中鐵的限值為0.3 mg/L[11]。當水中有Fe3+時,銅將會在局部失電子被氧化,鐵將會被還原,如式(4)所示。
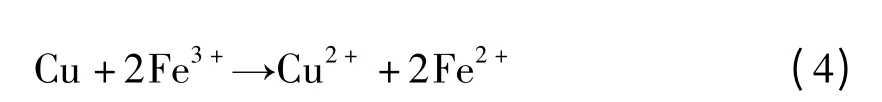
這種腐蝕多發于銅作為陰極的電化學腐蝕之后,只有當水中積累高濃度的Fe3+,才會導致后續銅氧化并溶出。但紫銅管往往在內制氧化膜進行保護,例如氧化膜完整則銅的防腐性能較為優良,如果較高濃度的氯離子同時存在,亞銅膜才會有入侵的風險[14]。因此當有高濃度鐵元素進入水中后,銅管使用中的腐蝕問題需要引起關注。
3.2 銅管吸氧腐蝕
當水中存在溶解氧時,若氧化膜受到破壞變得不完整,裸露的銅與氧接觸將會在局部形成陽極,在銅表面局部形成陰極,發生溶解氧的電子還原[15],反應如式(5)至式(7)所示。

實際上銅所經歷的氧化過程并非是一步從零價到二價,而是經歷式(8)和式(9)所示的兩步反應。

在pH <5.0 的酸性條件下,亞銅離子能夠較穩定地存在[16-17];當pH >5.0 時,充足的溶解氧會使亞銅離子進一步被氧化為銅離子[18-19]。由于自來水的pH 值很少出現小于6.5 的情況,因此銅管的陽極反應可簡化成為一步反應,即式(5)。
因此,裸露銅的吸氧腐蝕將會在其表面形成新氧化膜,使內部免于進一步腐蝕。當水中溶解了二氧化碳,或者其他原因使水呈酸性時,將會完善氧化膜的形成[20]。在pH 為6.0 時,吸氧腐蝕所形成的氧化膜已足夠致密,甚至使內部部分未被完全氧化的Cu2O 被保護,而無法被進一步氧化為CuO[18]。自來水中溶解氧的存在,使銅管的氧化膜得到了補充,因此銅不斷得到保護。
3.3 銅管自由氯腐蝕
水廠出廠水余氯中的自由氯,主要以次氯酸根(ClO-)的形式存在,次氯酸根作為氧化劑在陰極得電子被還原,如式(11)所示。同時銅作為陽極被氧化[21],陽極半反應如式(5)和式(10)所示。由于次氯酸根的氧化性強于氧氣,因此自由氯腐蝕應該受到重視,總反應式即式(12)。自由氯腐蝕和吸氧腐蝕均導致銅被氧化,反而阻止銅管的進一步腐蝕。

3.4 銅管氯蝕(Cl-)
氯離子是自來水中最常見的陰離子之一,在pH、溶解氧等條件相同的條件下,氯離子濃度升高時,會導致銅管的電化學腐蝕加劇[22-23]。一方面,氯離子作為電解質存在會增加總離子強度;另一方面,高濃度的氯離子將破壞銅的氧化膜[9],使氧化膜的保護作用部分喪失,加劇了腐蝕的進行[9,24],見式(13)。氯離子破壞氧化膜時發生反應,氯化亞銅與溶解氧在銅管表面進一步發生電化學反應[25],其中CuCl 作為陽極發生失電子的氧化反應見式(14),陰極半反應見式(15),完整的電化學過程見式(16)。

將式(16)與式(13)加合,得到氯蝕總過程,也就是在氯離子存在時,氧化亞銅膜吸氧腐蝕的總過程:

由式(17)可見,銅氯蝕也是一種吸氧腐蝕,但氯離子的存在使銅的氧化膜被破壞,喪失了對內部銅的保護。在氯離子存在時,pH 值的降低是出現氯蝕的關鍵,當pH 小于5.0 時會出現氯蝕現象,pH值大于7.6 時基本沒有氯的腐蝕問題發生[19]。《生活飲用水衛生標準》規定pH 值為6.5 ~8.5,氯離子最大濃度為250 mg/L。要盡量避免酸性條件和高濃度氯同時出現的特殊狀況[26],防止氯蝕的發生。
4 結論
① 當銅管與其他金屬管道直接相接時,會構成原電池,造成陽極其他活潑金屬被腐蝕,應避免銅管與其他金屬管件直接相接。
② 自來水中的溶解氧會導致銅陽極發生吸氧腐蝕,單純的吸氧腐蝕形成氧化膜,能避免內部銅進一步被氧化,保護水質。
③ 余氯中的自由氯氧化性比溶解氧強,導致氧化銅生成,能阻止銅管的進一步腐蝕。當氯離子濃度偏高時,應避免自來水的pH 值過低,對保護銅管至關重要。

