電針風池穴對腦缺血再灌注大鼠突觸素、生長相關蛋白-43的影響
韓清,徐鳴曙,張英杰,徐佳,葛林寶
?
電針風池穴對腦缺血再灌注大鼠突觸素、生長相關蛋白-43的影響
韓清1,徐鳴曙2,張英杰2,徐佳3,葛林寶4,5
(1.復旦大學附屬金山醫院,上海 201508;2.上海市針灸經絡研究所,上海 200030;3.上海中醫藥大學附屬岳陽中西醫結合醫院,上海 200437;4.上海市氣功研究所,上海 200030;5.上海市針灸經絡研究中心,上海 201203)
觀察電針風池穴對腦缺血再灌注大鼠突觸素(synaptophysin, SYN)、生長相關蛋白-43(growth associated protein-43, GAP-43)表達變化的影響。將32只SD雄性大鼠隨機分為正常組、假手術組、模型組、電針組,每組8只。模型組和電針組采用線栓法制作腦缺血再灌注模型。采用電針雙側風池穴對電針組大鼠進行治療,每日1次,每次30 min,至動物處死。應用免疫組織化學法檢測SYN和GAP-43的表達。模型組和電針組造模后2 h和造模后6 d Bederson評分與正常組和假手術組比較,差異均有統計學意義(<0.05)。模型組和電針組造模后6 d海馬和皮層SYN IOD值和GAP-43 IOD值與正常組和假手術組比較,差異均具有統計學意義(<0.05)。電針組造模后6 d海馬和皮層SYN IOD值和GAP-43 IOD值與模型組比較,差異均具有統計學意義(<0.05)。電針風池穴可促進腦缺血再灌注模型大鼠的GAP-43和SYN的表達,表明電針可以促進軸突再生,對突觸的可塑性具有正向改善作用。
針刺療法;電針;穴,風池;腦缺血;再灌注損傷;突觸素;生長相關蛋白-43
卒中是近年來嚴重威脅人類健康的三大疾病之一,呈現出高發病率、高死亡率、高致殘率的三高特征。缺血性卒中占卒中70%以上[1-2]。隨著老年人在社會人群中的比例不斷上升,其發病率仍會進一步上升。醫學技術的進步雖然在一定程度上減少了死亡率,但也一定程度上增加了中風病的致殘率水平,給社會和家庭造成巨大負擔。相關研究表明,神經系統對機體內、外環境變化進行適應或應變而發生結構與功能變化稱為神經可塑性[3],而突觸是神經可塑性變化的關鍵結構部位。突觸素(synaptophysin, SYN)是一種與突觸結構和功能均有密切聯系的磷酸蛋白,其主要存在于神經元突觸前囊泡,在突觸囊泡的轉運、導入及遞質的釋放中發揮重要作用,是突觸小泡特異性蛋白。SYN既可以影響突觸結構,又參與了突觸囊泡轉運和排放過程,由此實現了調控突觸傳遞的效能,從而在突觸可塑性中起一定作用[4]。故SYN是公認的神經可塑性的主要標記物。而神經生長相關蛋白-43(growth associated protein-43, GAP-43)是一種廣泛存在于神經元軸突內的特異性磷酸蛋白,在神經生長發育和再生過程中大量合成[5],通過參與調節生長錐形態而促進軸突生長。國際上將GAP-43作為神經元軸突再生的分子標志,是神經可塑性研究的首選分子探針[6]。本研究觀察電針風池穴對腦缺血再灌注大鼠SYN和GAP-43表達變化的影響,探索電針治療缺血性卒中的作用機制,現報道如下。
1 材料與方法
1.1 實驗動物與分組
選用8周齡健康雄性清潔級Spraguer-dawley(SD)大鼠32只,體重240~280 g,由上海中醫藥大學附屬岳陽中西醫結合醫院實驗動物中心提供。所有大鼠均按照清潔級標準飼養,每籠飼養4只,室溫控制在22℃~25℃,濕度40%~70%,明暗光照比為12 h:12 h。大鼠可進行自由飲水,每日每只飲食20 g。按照隨機、對照原則,采用完全隨機實驗設計方法,運用SPSS 19.0軟件將大鼠隨機分為正常組、假手術組、模型組和電針組,每組8只。實驗周期為7 d。
1.2 主要儀器與試劑
ECLIPSE TI-SR倒置熒光顯微鏡(日本尼康株式會社);華佗牌針灸針(0.25 mm×13 mm,蘇州醫療用品廠有限公司);G6805-1A電針治療儀(上海華誼醫用儀器廠);RM2016病理切片(上海徠卡儀器有限公司);KD-P組織攤片機(浙江省金華市科迪儀器設備有限公司)。
75%乙醇(杭州歐拓普生物技術有限公司);無水乙醇(國藥集團化學試劑有限公司);EDTA抗原修復液(武漢谷歌生物科技有限公司);BSA(A7030,美國Sigma公司);蘇木素染液(武漢谷歌生物科技有限公司);一抗(SYN,ab32127,稀釋比為1:500,英國Abcam);二抗(HRP-山羊抗兔/鼠二抗,K5007,丹麥DAKO公司);組化試劑盒DAB顯色劑(K5007,丹麥DAKO公司)。
1.3 模型制備
實驗大鼠飼養7 d以適應環境。術前大鼠禁食12 h,室溫保持在25℃,用水合氯醛(0.3 mL/100 g)腹腔注射麻醉。參考Longa EZ等[7]報道的線栓法大腦中動脈閉塞模型(middle cerebral artery occlusion, MCAO)進行造模。手術完成后,將大鼠置于室內溫度保持在25℃環境中蘇醒。
正常組不做任何處理;假手術組大鼠用水合氯醛(0.3 mL/100 g)腹腔注射麻醉后分離出右側頸總動脈、頸外動脈和頸內動脈,然后縫合。
1.4 神經功能缺損評分
采用Bederson評分法,時間點選擇造模前、造模后2 h及造模后6 d。具體方法為,提鼠尾離開地面約50 cm,觀察前肢屈曲情況,如雙前肢對稱伸向地面,記為0分;如手術對側前肢出現肩或(和)肘內收屈曲,肩關節內旋,或者肩肘關節屈曲同時伴有內旋者,記為1分。將大鼠放在光滑平面上,手推雙肩分別向另一側移動,檢測兩側側推阻力并對比,如兩側側推阻力對等且有力記為0分;若向腦損傷對側推動時阻力下降者,記為1分。將大鼠兩前肢放于金屬網上,觀察對比兩前肢的肌張力大小,兩前肢肌張力近似相等且力量充足者為0分;如腦損傷對側前肢肌張力下降,記為1分。將大鼠提尾距離平面約50 cm高度,若大鼠有不停地向腦損傷對側一個方向旋轉者,記為1分。滿分為4分,分數越高表示大鼠行為障礙越嚴重[8-9]。
1.4.1 納入標準
動物蘇醒后,運用Bederson改進評分法對所有大鼠進行評分,2~4分為有效模型。
1.4.2 排除標準
①動物死亡;②神經缺損評分<2分;③術后1 d大鼠體重快速下降到200 g以下。
1.5 干預方法
在術后1 d即對電針組實驗大鼠進行電針治療[10]。取雙側風池穴。常規消毒后,采用0.25 mm×13 mm毫針直刺3 mm,然后將針柄分別連接至電針儀,采用疏密波,頻率為2~10 Hz,電流強度為1~3 mA,電壓為3~5 V,強度以大鼠雙耳稍稍顫動為度,治療時間30 min。每日1次,均在上午10時左右進行,連續治療5 d。治療完畢將大鼠放入籠內。
假手術組和模型組不治療;模型組和電針組大鼠每只單獨飼養,并予以高能量飲食。
1.6 標本采集
分別于動物造模腦缺血6 d后,采用10%用水合氯醛(0.3 mL/100 g)麻醉大鼠,打開胸腔迅速暴露心臟,經左心室生理鹽水灌洗后,再行4%多聚甲醛磷酸鹽緩沖液灌注固定,后于冰上迅速小心斷頭取腦,在視交叉后切開,冠狀切取2 mm厚包含皮質梗死灶區域;距離大腦皮質后緣向前約5 mm位置,鈍性剝離皮質,暴露并取缺血側海馬,冠狀切取2 mm厚組織;將所取組織置于4%多聚甲醛液體中固定,后進行脫水、透明、浸蠟、包埋,將石蠟包埋塊切成5mm厚防脫切片,用于免疫組織化學染色。
1.7 免疫組織化學染色
免疫組化染色步驟如下,石蠟切片常規脫蠟脫水;檸檬酸抗原修復15 min,后PBS液(pH值為7.4)洗滌3×5 min;放入3%過氧化氫溶液室溫避光孵育25 min, PBS液(pH值7.4)洗滌3×5 min;滴加3%BSA封閉 30 min;滴加一抗覆蓋組織(用3%BSA按一定比例稀釋),濕盒內4℃孵育過夜,PBS液(pH值7.4)洗滌3×5 min;滴加二抗(HRP標記)覆蓋組織(與一抗相應種屬),室溫孵育50 min,PBS液(pH值7.4)洗滌3×5 min;滴加新鮮配制的DAB顯色液,顯微鏡下控制顯色時間(陽性為棕黃色),自來水沖洗切片終止顯色;Harris蘇木素復染約3 min,自來水沖洗;1%鹽酸乙醇分化數秒,自來水沖洗;氨水返藍,流水沖洗;常規脫水,晾干,中性樹膠封片;在通風廚中放置1~2 h晾干,顯微鏡下觀察、分析。
1.8 圖像分析和統計學方法
確定SYN、GAP-43免疫反應產物的分布。標記強度用光密度值(OD值)表示。采用Eclipse Ti-SR光學顯微鏡觀察SYN及GAP-43切片,采用Image pro-plus 6.0圖像分析軟件分析大鼠大腦右側皮質病灶區及海馬區組化圖片,對每張照片進行分析得出每張照片陽性的累積光密度值(IOD)。所有數據采用SPSS18.0軟件進行統計分析。符合正態分布的計量資料以均數±標準差表示,采用檢驗。以<0.05表示差異具有統計學意義。
2 結果
2.1 各組造模后6 d不同部位SYN IOD值比較
免疫組化染色顯示,SYN陽性物質主要見于梗死區域周圍大腦皮質和海馬神經元胞漿、突起及纖維束中,呈棕褐色顆粒狀或點狀(見圖1、圖2)。
由表1可見,模型組和電針組造模后6 d海馬和皮層SYN IOD值與正常組和假手術組比較,差異均具有統計學意義(<0.05)。電針組造模后6 d海馬和皮層SYN IOD值與模型組比較,差異均具有統計學意義(<0.05)。
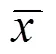
表1 各組造模后6 d不同部位SYN IOD值比較 (±s)
注:與正常組比較1)<0.05;與假手術組比較2)<0.05; 與模型組比較3)<0.05
2.2 各組造模后6 d不同部位GAP-43 IOD值比較
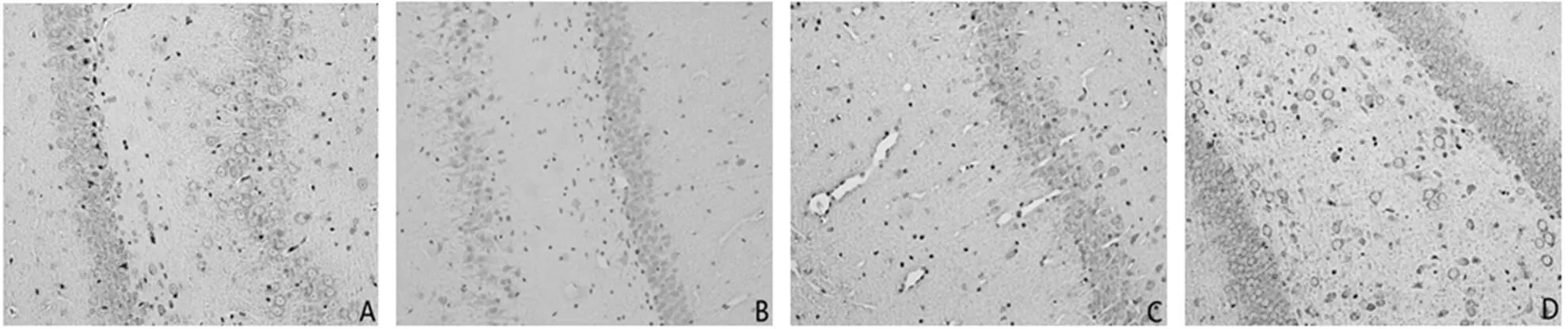
梗死周圍皮質區域和海馬均有GAP-43的表達(見圖3、圖4)。
由表2可見,模型組和電針組造模后6 d海馬和皮層GAP-43 IOD值與正常組和假手術組比較,差異均具有統計學意義(<0.05)。電針組造模后6 d海馬和皮層GAP-43 IOD值與模型組比較,差異均具有統計學意義(<0.05)。
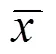
表2 各組造模后6 d不同部位GAP-43 IOD值比較(±s)
注:與正常組比較1)<0.05;與假手術組比較2)<0.05; 與模型組比較3)<0.05
注:A為正常組,B為假手術組,C為模型組,D為電針組
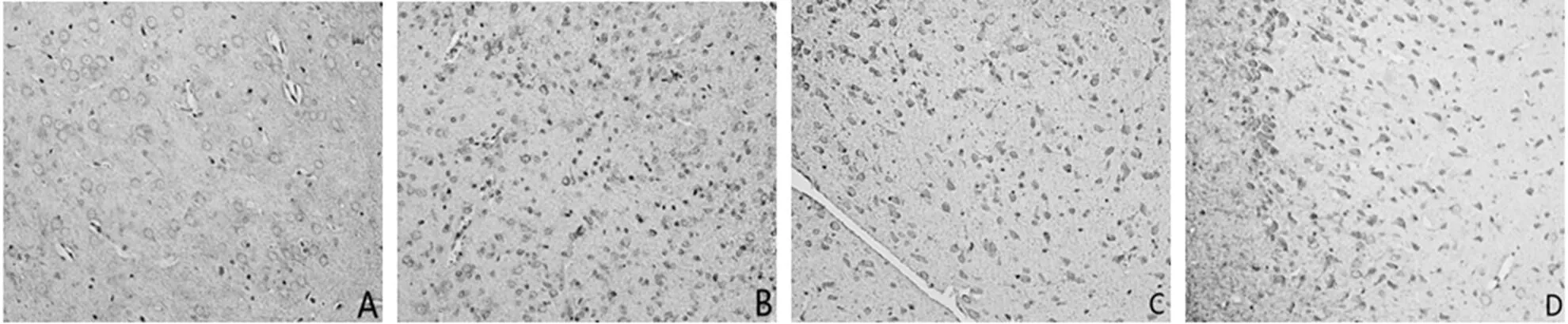
注:A為正常組,B為假手術組,C為模型組,D為電針組

注:A為正常組,B為假手術組,C為模型組,D為電針組

注:A為正常組,B為假手術組,C為模型組,D為電針組
2.3 各組不同時間點Bederson評分比較
由表3可見,模型組和電針組造模后2 h Bederson評分較正常組和假手術組明顯上升,差異均有統計學意義(<0.05);模型組和電針組造模后6 d Bederson評分均有下降,與正常組和假手術組比較,差異均具有統計學意義(<0.05)。電針組造模后2 h和造模后6 d Bederson評分與模型組比較,差異均無統計學意義 (>0.05)。
表3 各組不同時間點Bederson評分比較 (±s,分)
注:與正常組比較1)<0.05;與假手術組比較2)<0.05
3 討論
突觸可塑性是指突觸在形態和功能上的改變,是神經系統生長發育損傷修復及學習記憶等活動的神經生物學基礎,在卒中后神經功能改善中具有重要作用[11]。本研究所采用的Bederson評分是評估動物腦缺血損傷側肢體的感覺、運動、反射功能的一種神經功能評估方法,主要評估前肢屈曲情況、前肢肌張力、術側與手術對側肌力及轉圈行為。線栓法是制作MCAO/R動物模型的常用方法,通過閉塞實驗動物大腦中動脈,并于90 min后抽離線栓實現腦組織再灌注,造成大腦中動脈所支配區域腦組織的永久性損傷,故MCAO模型大鼠造模后表現為永久性肢體運動功能障礙。實驗中觀察到造模后6 d模型組、電針組大鼠神經功能缺損評分均有所降低,但仍高于正常組和假手術組,大鼠肢體仍存在上肢屈曲、轉圈行為等神經功能缺損表現,提示實驗動物肢體功能難以恢復至損傷前水平。電針組和模型組的評分較造模術后2 h有明顯減輕的趨勢,提示造模大鼠存在自我修復能力,而模型組和電針組組間比較無顯著差異,但電針組Bederson評分仍較造模術后2 h有降低的趨勢。這可能與神經功能缺損評分能夠宏觀評估神經功能,但難以實現相對精細定量評估神經功能相關。
SYN是一種與突觸結構和功能均有密切聯系的磷酸蛋白,其主要存在于神經元突觸前囊泡,在突觸囊泡的轉運、導入及遞質的釋放中發揮重要作用,是突觸小泡特異性蛋白[12-15]。因此,通過檢測SYN的密度和分布可間接評估突觸數量的多寡和分布特點,是公認的神經可塑性的主要標記物[16-19]。Stroemer RP等[20]發現腦缺血損傷后,隨著時間的推移,模型動物術側相應皮質區域SYN的表達增加,且神經行為功能的改善與SYN的表達水平呈正相關。本研究結果顯示,腦缺血再灌注后6 d,缺血組、電針組SYN表達相較對照組和假手術組顯著變小。這可能是腦缺血后損傷了突觸結構,導致突觸前囊泡內的SYN低水平,這與既往研究結果相一致[21]。電針組梗死周圍皮質區域和海馬SYN的表達明顯高于模型組,提示電針風池穴可促進SYN的表達,說明電針可以促進腦缺血性損傷區神經末梢突觸的形成和重構。電針改善神經功能的作用可能經由此機制發揮,此結果也與既往的研究相一致[22-25]。
GAP-43是一種廣泛存在于神經元軸突內的特異性磷酸蛋白,成年后,GAP-43的表達在大部分腦區處于較低水平或不表達,在神經系統發育過程中或神經損傷后,往往出現GAP-43在基因和蛋白水平的表達或上調,與神經可塑性密切相關[26-29]。國際上將GAP-43作為神經元軸突再生的分子標志,是神經可塑性研究的首選分子探針[30]。既往研究證實,神經組織受到損傷、缺血等情況下,機體自身可誘導生長相關蛋白表達。當腦組織損傷時,誘發損傷區域GAP-43水平升高,激活神經纖維發芽、突觸重建等一系列神經再生過程,隨著損傷修復時間的延長,GAP-43表達逐步回落,直至再生完成[31]。石旺清等[32]發現大鼠腦缺血再灌注后3 d缺血區周邊組織神經元凋亡達到高峰,GAP-43表達增強,7 d達到高峰,以后逐漸減弱。有研究發現,電針可增加GAP-43的表達[33]。卿鵬等[34]發現電針結合康復訓練能促進大鼠神經功能的恢復及海馬CA3區GAP-43的表達,而在針刺方法上,雙側電針法較患側電針法能更好地促進局灶性腦缺血再灌注損傷大鼠的中樞神經系統功能重塑。劉斐雯等[35]進一步證實,MCAO/R大鼠在電針干預后海馬區GAP-43的表達顯著增加。本研究結果顯示,電針組與模型組比較,GAP-43表達明顯增強,提示電針風池穴可促進腦缺血損傷后的神經元軸突再生。
本研究選用的風池穴屬足少陽膽經穴,為手少陽經、足少陽經、陽維脈之會,該穴位于頭部兩側,依據“腧穴所在,主治所在”,故可以治療腦血管疾病。干預方法選用電針刺激,相對于單純針刺,刺激參數易于設定,刺激量可實現定量控制,維持刺激的一致性,且方便操作[36]。近年來,關于風池穴對中風的治療作用已經得到證實。張晨茜等[37]研究發現以風池、風府為主配合常規針刺治療缺血性中風有較好的治療作用。徐佳等[38]發現電針雙側風池穴可逆轉大鼠大腦缺血側誘發電位中Nl波的振幅降低。秦彥強等[39]發現電針風池穴預處理可提高MCAO模型大鼠缺血性耐受,提高大鼠運動、平衡、學習及記憶能力。
綜上所述,單純電針刺激雙側風池穴可顯著上調GAP-43和SYN的表達水平,表明電針雙側風池穴對神經元功能有一定的調節作用,在一定程度上可誘導局灶性缺血再灌注大鼠模型的神經軸突再生和突觸功能與結構的重構,有利于神經元的再生,從而促進肢體功能的改善。然其是否與多穴刺激具有等同效應,還需要以后的進一步研究。
[1] 孫海欣,王文志.中國60萬人群腦血管病流行病學抽樣調查報告[J].中國現代神經疾病雜志,2018,18(2): 83-88.
[2] 宋宛珊,郭威,張玉蓮,等.突觸可塑性相關物質基礎研究進展[J].中國老年學雜志,2015,35(17):5039- 5042.
[3] Gispen WH. Neuronal plasticity and function[J]., 1993,16(Suppl 1):S5-S11.
[4] 郭敏,李剛.突觸可塑性相關蛋白的研究進展[J].神經藥理學報,2013,3(6):57-64.
[5] Coggins PJ, Zwiers H. B-50 (GAP-43): biochemistry and functional neurochemistry of a neuron-specific phosphoprotein[J]., 1991,56(4):1095- 1106.
[6] Udvadia AJ, K?ster RW, Skene JH. GAP-43 promoter elements in transgenic zebrafish reveal a difference in signals for axon growth during CNS development and regeneration[J].,2001,128(7):1175-1182.
[7] Longa EZ, Weinstein PR, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats[J]., 1989,20(1):84-91.
[8] Bederson JB, Pitts LH, Tsuji M,. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J]., 1986,17(3):472-476.
[9] 詹劍,李小瓊,郝仁方.金釵石斛多糖對局灶性腦缺血-再灌注大鼠的作用[J].中國腦血管病雜志,2017,14 (1):25-31.
[10] 徐鳴曙,葛林寶,徐佳,等.電針對腦缺血再灌注大鼠紋狀體內單胺類遞質更新率的影響[J].上海針灸雜志, 2009,28(4):239-242.
[11] Hasan A, Nitsche MA, Rein B,. Dysfunctional long-term potentiation-like plasticity in schizophrenia revealed by transcranial direct current stimulation[J]., 2011,224(1):15-22.
[12] Maeda I, Tajima S, Ariizumi Y,.Can synaptophysin be used as a marker of breast cancer diagnosed by core-needle biopsy in epithelial proliferative diseases of the breast?[J]., 2016,66(7):369-375.
[13] Yadav L, Babu MK, Das K,.Role of synaptophysin in the intraoperative assessment of quadrantic innervation of the proximal doughnut in Hirschsprung disease[J]., 2017,30(4):187-192.
[14] Griva M, Lagoudaki R, Touloumi O,.Long-term effects of enriched environment following neonatal hypoxia-ischemia on behavior, BDNF and synaptophysin levels in rat hippocampus: Effect of combined treatment with G-CSF[J]., 2017,1667:55-67.
[15] Xiao Z, Peng J, Wu L,.The effect of IL-1β on synaptophysin expression and electrophysiology of hippo campal neurons through the PI3K/Akt/mTOR signaling pathway in a rat model of mesial temporal lobe epilepsy[J]., 2017,39(7):640-648.
[16] Chen YY, Zhang L, Shi DL,.Resveratrol Attenuates Subacute Systemic Inflammation-Induced Spatial Memory Impairment via Inhibition of Astrocyte Activation and Enhancement of Synaptophysin Expression in the Hippocampus[J]., 2017,47(1):17-24.
[17] Matsukuma K, Olson KA, Gui D,.Synaptophysin- Ki67 double stain: a novel technique that improves interobserver agreement in the grading of well- differentiated gastrointestinal neuroendocrine tumors[J]., 2017,30(4):620-629.
[18] Tudora?cu DR, Pirici D, Tartea EA,.Synaptophysin expression as prognostic factor for survival in colorectal carcinomas[J]., 2017,58(4): 1409-1415.
[19] 朱旭紅,張萍淑,程贊贊,等.突觸可塑性相關蛋白及其與臨床疾病的關系[J].華北理工大學學報(醫學版), 2017,19(3):237-241.
[20] Stroemer RP, Kent TA, Hulsebosch CE. Neocortical neural sprouting, synaptogenesis, and behavioral recovery after neocortical infarction in rats[J]., 1995,26(11):2135-2144.
[21] Madinier A, Bertrand N, Mossiat C,. Microglial involvement in neuroplastic changes following focal brain ischemia in rats[J]., 2013,4(12): e8101.
[22] Yi W, Xu NG, Wang GB. Experimental study on effects of electro-acupuncture in improving synaptic plasticity in focal cerebral ischemia rats[J]., 2006,26(8):710-714.
[23] Xia WG, Zheng CJ, Zhang X,. Effects of "nourishing liver and kidney" acupuncture therapy on expression of brain derived neurotrophic factor and synaptophysin after cerebral ischemia reperfusion in rats[J]., 2017,37(2):271-278.
[24] 陳鵬,張大雁,吳思葦,等.電針結合天麻素增加局灶性腦缺血大鼠額葉皮質生長相關蛋白-43以及突觸素的免疫組化表達[J].醫學理論與實踐,2017,30(1):1-3.
[25] 趙嘉培,黃丹霞,黃賽娥,等.電針“曲池”和“足三里”對腦缺血大鼠皮質突觸素、腦源性神經營養因子表達的影響[J].中國動脈硬化雜志,2017,25(11):1099- 1106.
[26] Coggins PJ, Zwiers H. B-50 (GAP-43): biochemistry and functional neurochemistry of a neuron-specific phosphor- protein[J]., 1991,56(4):1095-1106.
[27] Zhu X, Wang P, Liu H,.Changes and Significance of SYP and GAP-43 Expression in the Hippocampus of CIH Rats[J]., 2019,16(3):394-402.
[28] Martins CW, de Melo Rodrigues LC, Nitsche MA,. AMPA receptors are involved in prefrontal direct current stimulation effects on long-term working memory and GAP-43 expression[J]., 2019,362: 208-212.
[29] Nemes AD, Ayasoufi K, Ying Z,.Growth Associated Protein 43 (GAP-43) as a Novel Target for the Diagnosis, Treatment and Prevention of Epileptogenesis[J]., 2017,7(1):17702.
[30] Han XF, Zhang Y, Xiong LL,. Erratum to: Lentiviral-Mediated Netrin-1 Overexpression Improves Motor and Sensory Functions in SCT Rats Associated with SYP and GAP-43 Expressions[J]., 2017,54(3):1698.
[31] Gorup D, Boha?ek I, Mili?evi? T,. Increased expression and colocalization of GAP43 and CASP3 after brain ischemic lesion in mouse[J]., 2015,597:176-182.
[32] 石旺清,鄭關毅,陳曉東,等.大鼠腦缺血/再灌注后bFGF和GAP-43的表達與神經再生[J].中國應用生理學雜志,2013,29(1):63-67.
[33] 張鵬飛,徐成成,李文磊,等.電針對局灶性腦缺血大鼠10號染色體同源丟失性磷酸酶張力蛋白和神經生長相關蛋白-43表達的影響[J].中國康復理論與實踐, 2015,21(1):35-38.
[34] 卿鵬,柴鐵劬,丁紅梅,等.雙側電針結合康復訓練對局灶性腦缺血/再灌注損傷大鼠海馬CA3區神經生長相關蛋白43及突觸素表達的影響[J].針刺研究,2016, 41(4):314-320.
[35] 劉斐雯,俞坤強,彭洪衛,等.電針百會、神庭穴對局灶性腦缺血再灌注大鼠學習記憶能力及海馬區GAP-43蛋白表達的影響[J].中國中醫急癥,2016,25(2):189- 192,207.
[36] 周元成,吳新貴,肖貽財.電針刺激“足三里”和“內關”對腦梗死大鼠GAP-43表達的影響[J].中國針灸,2011, 31(1):55-59.
[37] 張晨茜,儲浩然,程紅亮,等.針刺風池、風府穴對缺血性腦卒中患者血漿內皮素的影響[J].上海針灸雜志, 2012,31(1):15-17.
[38] 徐佳,徐鳴曙.電針對大鼠腦缺血-再灌注過程中體感誘發電位P1-N1、N1-P2峰峰值變化的影響[J].上海針灸雜志,2010,29(8):542-545.
[39] 秦彥強,孫忠人,魏慶雙,等.針刺風池穴預處理對腦梗死大鼠的缺血耐受現象研究[J].針灸臨床雜志,2015, 31(9):65-68.
Effect of Electroacupuncture at Fengchi (GB20) on Synaptophysin and Growth Associated Protein-43 in Rats with Ischemia/Reperfusion Injury
1,-2,-2,3,-4,5.
1.,201508,; 2.,200030,; 3.,200030,; 4.,200437,; 5.,201203,
To study the effect of electroacupuncture at Fengchi (GB20) on the expressions of synaptophysin (SYN) and growth associated protein-43 (GAP-43)in rats with ischemia/reperfusion (I/R) injuryThirty-two male Sprague-Dawley (SD) rats were randomized into normal, sham operation, model and electroacupuncture groups, with 8 rats in each group. The middle cerebral artery occlusion (MCAO) rat model was generated by thread embolization in the model and electroacupuncture groups. The electroacupuncture group received electroacupuncture at bilateral Fengchi (GB20), once a day, 30 min each time, until the rats were executed. The expressions of SYN and GAP-43 were examined by immunohistochemistry method.The Bederson scores 2 hours and 6 days after modeling in the model and electroacupuncture groups were significantly different from those in the normal and sham operation groups (<0.05). The integrated optical density (IOD) values of SYN and GAP-43 in hippocampus and cortex 6 days after modeling in the model and electroacupuncture groups were significantly different from those in the normal and sham operation groups (<0.05). The IOD values of SYN and GAP-43 in hippocampus and cortex 6 days after modeling in the electroacupuncture group were significantly different from those in the model group (<0.05).Electroacupuncture at Fengchi (GB20) can promote the expressions of SYN and GAP-43 in rats with I/R injury, which suggests that electroacupuncture can promote axon regeneration and improve synaptic plasticity.
Acupuncture therapy; Electroacupuncture; Acupoint, Fengchi (GB20); Cerebral ischemia; Ischemia and reperfusion injury; Synaptophysin; Growth associated protein-43; Rats
R2-03
A
10.13460/j.issn.1005-0957.2019.13.0071
1005-0957(2019)13-0071-07
2018-12-03
上海市衛生和計劃生育委員會科研課題(201640128);上海市自然科學基金項目(17ZR1427500)
韓清(1981—),男,住院醫師,碩士,Email:dada1981xiaoxiao@163.com
徐鳴曙(1978—),男,副研究員,博士,Email:mingshuxu@163.com

