蕨菜多糖超聲波輔助提取及其藥理活性初步研究
郝經文, 陳林霖,司華陽,陳乃富,陳乃東,李 彬,劉孝全
1 皖西學院,六安 237012;2安徽中醫藥大學,合肥 230031; 3湖北中醫藥大學,武漢 430065
蕨菜是采自蕨科蕨屬植物蕨Pteridiumaquilinum(L.)Kuhn var.latusculum(Desv)Underw的幼嫩葉,別名拳頭菜、如意菜、龍爪菜等,因其生長于天然林地,少受污染,是我國優質的綠色天然食品[1-3]。
近年來,隨著蕨菜野生資源的開發利用,對蕨菜中化學成分的研究主要集中于黃酮、氨基酸、礦物質、維生素等物質[4-6],而對蕨菜多糖的研究相對較少。現代藥理學研究表明,多糖作為一類重要的大分子化合物,具有免疫調節、抗腫瘤、抗氧化、降血糖及降血脂等藥理作用,且毒性小,從而成為藥效物質基礎研究的熱點[7-10]。開展蕨菜多糖的研究對蕨菜資源的深度開發具有重要意義。
本實驗以大別山區野生蕨菜為原料,利用超聲輔助提取方法,在單因素試驗基礎上采用響應面設計優化超聲輔助提取蕨菜多糖的工藝參數,以促進小鼠脾細胞增殖和抑制結腸癌細胞(HCT-8)增殖能力的研究為例,對獲得的蕨菜多糖免疫增強活性和抗腫瘤活性進行初步評價,旨在為蕨菜多糖的深入研究和蕨菜資源開發提供參考依據。
1 材料與方法
1.1 材料
蕨菜材料采自于安徽省霍山縣,品種經皖西學院陳乃東教授鑒定。幼嫩葉鮮品洗凈,在低溫凍干機中凍干至恒重,粉碎、過40目篩,密封備用。
1.2 試劑與儀器
主要試劑:葡萄糖(標準品)、刀豆蛋白A(ConA)、DMEM培養基,購于Sigma-aldrich試劑公司;無水乙醇(分析純),購于上海振興化工試劑公司;乙醚(分析純),購于上海中試化工試劑公司;丙酮、氯仿、硫酸(分析純),購于西隴化工試劑公司;正丁醇(分析純),購于天津博迪試劑公司;紫杉醇(標準品)、蒽酮、二甲基亞砜,均購于阿拉丁試劑公司; RPMI1640培養基,購于海克隆試劑公司;PBS溶液,購于上海立菲生物技術有限公司;紅細胞裂解液,購自于Thermo試劑公司。
主要儀器與設備: TU-1901雙光束紫外-可見分光光度計,北京普析通用儀器有限責任公司;KQ-5200B型超聲波清洗器,昆山市超聲儀器有限公司;HH-S6 型數顯恒溫水浴鍋,江蘇金壇市金城國勝實驗儀器廠;GL-200-Ⅱ 型離心機,上海安亭科學儀器廠;GL-20G-Ⅱ 電子分析天平,上海安亭科學儀器廠;202A-3型數顯電熱干燥箱,上海錦屏儀器儀表有限公司;BB15型二氧化碳培養箱,ThermoFisher儀器有限公司; Thermo Scientific Microplate Reader 酶標儀,ThermoFisher儀器有限公司。
1.3 試驗方法
1.3.1 標準曲線的制備
葡萄糖標準曲線的繪制參照文獻[11],用蒽酮-硫酸法,于 621 nm下測樣品吸光度值,得回歸方程A= 9.561 4C+ 0.021 8,R2= 0.998 ,A為吸光度,C為濃度,計算出各供試樣品的多糖含量[14-16]。
1.3.2 蕨菜樣品粗多糖的提取及測定
準確稱取0.5 g的蕨菜凍干粉,加入一定體積蒸餾水,超聲波輔助提取、 5 000 rpm離心,收集上清液,定容,得蕨菜總多糖提取液,備用。
精密吸取 1.0 mL制備的多糖提取液,同“1.3.1操作”于 621 nm 下測吸光度值(A),計算出各供試樣品的多糖含量[14]。
1.3.3 蕨菜精制多糖的制備
蕨菜精制多糖的制備參照相關文獻[12],使用Sevag法除去粗多糖溶液中的蛋白質,冷凍干燥,得精制多糖。
1.3.4 單因素試驗
采用單因素試驗分別考察超聲波輔助下液料比、浸提次數、超聲浸提時間、超聲功率4 個因素對蕨菜多糖提取得率的影響。
1.3.5 響應面法試驗因素水平設計
根據Box-Behnken的中心組合試驗設計原理[13-16],結合單因素試驗結果,選擇以液料比(X1)、浸提次數(X2)、超聲浸提時間(X3)、超聲功率(X4)作為相應變量,編碼水平為-1,0和1,且以蕨菜多糖提取得率(Y)作為響應值,采用響應面法對蕨菜多糖提取條件進行優化。
1.3.6 蕨菜精制多糖對小鼠脾細胞增值的影響
小鼠脾淋巴細胞的制備參考文獻[17],小鼠短頸處死后,置于70%乙醇溶液中浸泡3 min,于無菌條件下取出脾臟,置于病理級載玻片,壓碎,PBS緩沖溶液沖洗,過200目篩網,制得脾細胞懸浮液。將制得的細胞懸浮液置于離心管中,1 200 rpm 離心5 min,除去上清,向離心管中加入1 mL紅細胞裂解液,吹打均勻,靜置4 min,1 200 rpm離心,除去上清液,加入適量的RPMI1640培養基,吹打均勻,使用臺盼藍染色,檢測細胞活性在95%以上即可。
用RPMI1640培養基將蕨菜精制多糖配制0、1、5、10、50、100、500、1 000 μg/mL7個給藥濃度。將小鼠淋巴細胞懸浮液加入96孔細胞培養板中,每孔100 μL,5×105個/孔,每孔加入10 μL不同濃度藥液,以等體積的RPMI1640培養基作為空白對照組,以最終濃度為5 μg/mL的ConA給藥為陽性對照組,每組設置5個復孔。在37 ℃、5%CO2條件下培養24 h,采用CCK-8法檢測[18],每孔加入10 μL的CCK-8溶液,繼續孵育4 h,終止培養,在490 nm下測定其吸光度值,用多功能酶標儀測定吸光度值(OD),實驗設3次重復。
1.3.7 蕨菜精制多糖對結腸癌細胞(HCT-8)增殖的影響
蕨菜精制多糖對結腸癌細胞(HCT-8)增殖抑制及細胞培養參考文獻[19],分別將結腸癌細胞HCT-8以1×104的數目接種于96孔細胞培養板中,每孔100 μL,空白組加入等體積的DMEM培養基,37 ℃、5%CO2培養12 h,待細胞貼壁后,加入不同濃度的蕨菜精制多糖藥液10 μL,以最終濃度為100 nmol/L的紫杉醇為陽性對照[19], 在37 ℃、5%CO2條件下培養24 h,采用CCK-8法檢測,每孔加入10 μL的CCK-8溶液,繼續孵育4 h,終止培養,在490 nm下測定其吸光度值,用多功能酶標儀測定吸光度值(OD),實驗設3次重復。
1.3.8 數據分析
使用統計分析軟件SPSS 23.0和Design Expert.10.0對響應面法設計實驗的結果進行分析,擬合二次多項式方程并繪制響應面圖,確定蕨菜多糖的較佳提取工藝。
2 結果與分析
2.1 單因素試驗
2.1.1 液料比對多糖提取得率的影響
在超聲功率240 W、浸提次數3次、超聲浸提時間30 min的條件下,比較不同液料比對蕨菜多糖提取得率的影響如圖1所示。
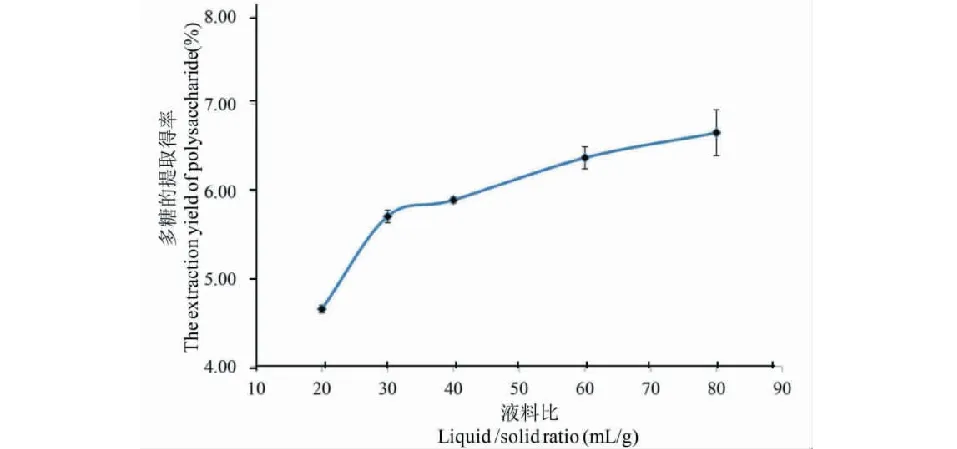
圖1 液料比對多糖提取得率的影響Fig.1 Effect of liquid /solid ratio on the extraction yield of polysaccharide
由圖1可得,隨著液料比的增大,多糖提取得率逐漸增大,當液料比(mL/g)在20~40∶1 時,多糖提取得率上升較快;當液料比大于40∶1 時,增長緩慢。液料比為60∶1和80∶1時獲得的蕨菜多糖提取得率差異無統計學意義,過多使用提取溶液會造成后續處理的難度,且提高成本,當液料比為40∶1時獲得較好的多糖提取得率,因此液料比控制在 40∶1為宜。
2.1.2 浸提次數對多糖提取得率的影響
在超聲功率240 W、超聲浸提時間30 min、液料比30∶1(mL/g)的條件下,比較不同浸提次數對蕨菜多糖提取得率的影響如圖2所示。
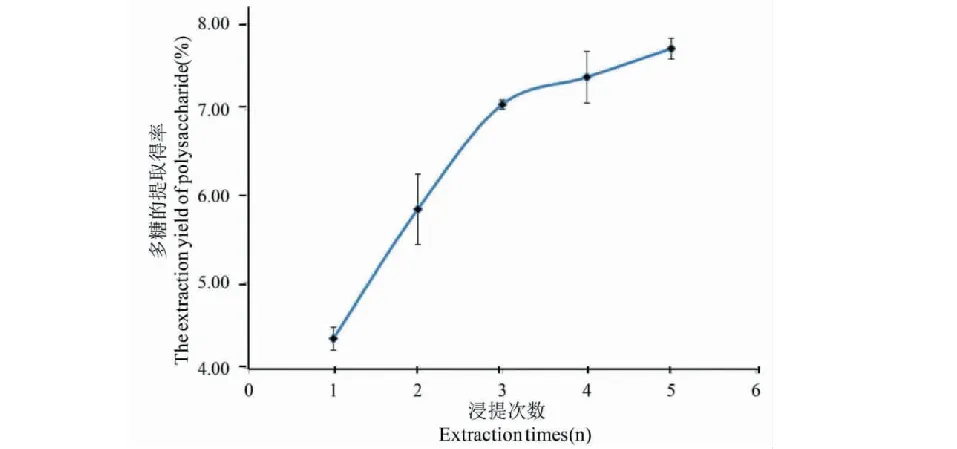
圖2 浸提次數對多糖提取得率的影響Fig.2 Effect of extraction times on the extraction yield of polysaccharide
由圖2可得,浸提次數在1~3之間時,蕨菜多糖提取得率隨浸提次數的增加而上升,浸提次數超過3次后,多糖提取得率的增加幅度趨于平緩,且浸提3次與浸提4次,浸提5次的蕨菜多糖提取得率差異不具有統計學意義,故浸提次數選擇3次為宜。
2.1.3 超聲浸提時間對多糖提取得率的影響
在超聲功率240 W、浸提次數3次、液料比30∶1 (mL/g)的條件下,比較不同超聲浸提時間對蕨菜多糖提取得率的影響如圖3所示。
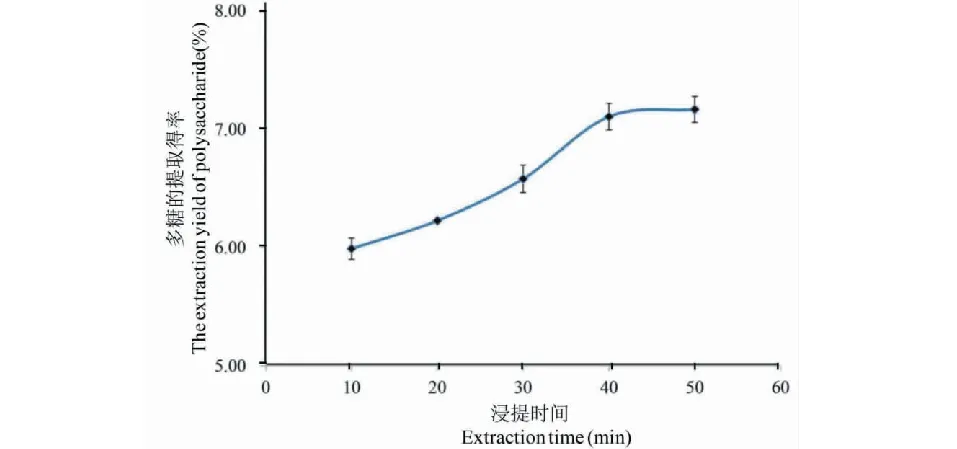
圖3 浸提時間對多糖提取得率的影響Fig.3 Effect of time on the extraction yield of polysaccharide
由圖3可得,隨著超聲浸提時間的增加,多糖提取得率顯著提高,但當超聲浸提時間超過40 min后,多糖提取得率增長緩慢,且超聲浸提時間為40 min和50 min時提取得率差異不具有統計學意義,考慮到節約成本等因素,選40 min作為超聲浸提時間為宜。
2.1.4 提取功率對多糖提取得率的影響
在超聲浸提時間30 min、浸提次數3次、液料比30∶1(mL/g)的條件下,考察比較不同超聲功率對蕨菜多糖提取得率的影響如圖4所示。
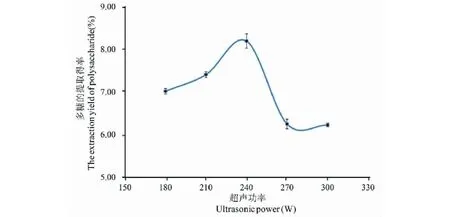
圖4 提取功率對多糖提取得率的影響Fig.4 Effect of ultrasonic power on the extraction yield of polysaccharide
由圖4可得,超聲功率在180~240 W時,多糖提取得率逐漸增大,當超聲功率大于240 W時,多糖提取得率下降,說明超聲功率對多糖提取得率的影響,既有正效應又有負效應,實際生產中應避免超聲功率過大而引起得率下降,故選取超聲功率240 W為宜。
2.2 四因素響應面試驗分析結果
2.2.1 工藝參數優化
結合“2.1單因素試驗”結果,以液料比(X1):30∶1(mL/g)、浸提次數(X2):3次、超聲浸提時間(X3):40 min(X3)、超聲功率(X4):240 W為中心點,用響應面分析方法進行四因素優化。中心試驗設計及試驗結果見表1。
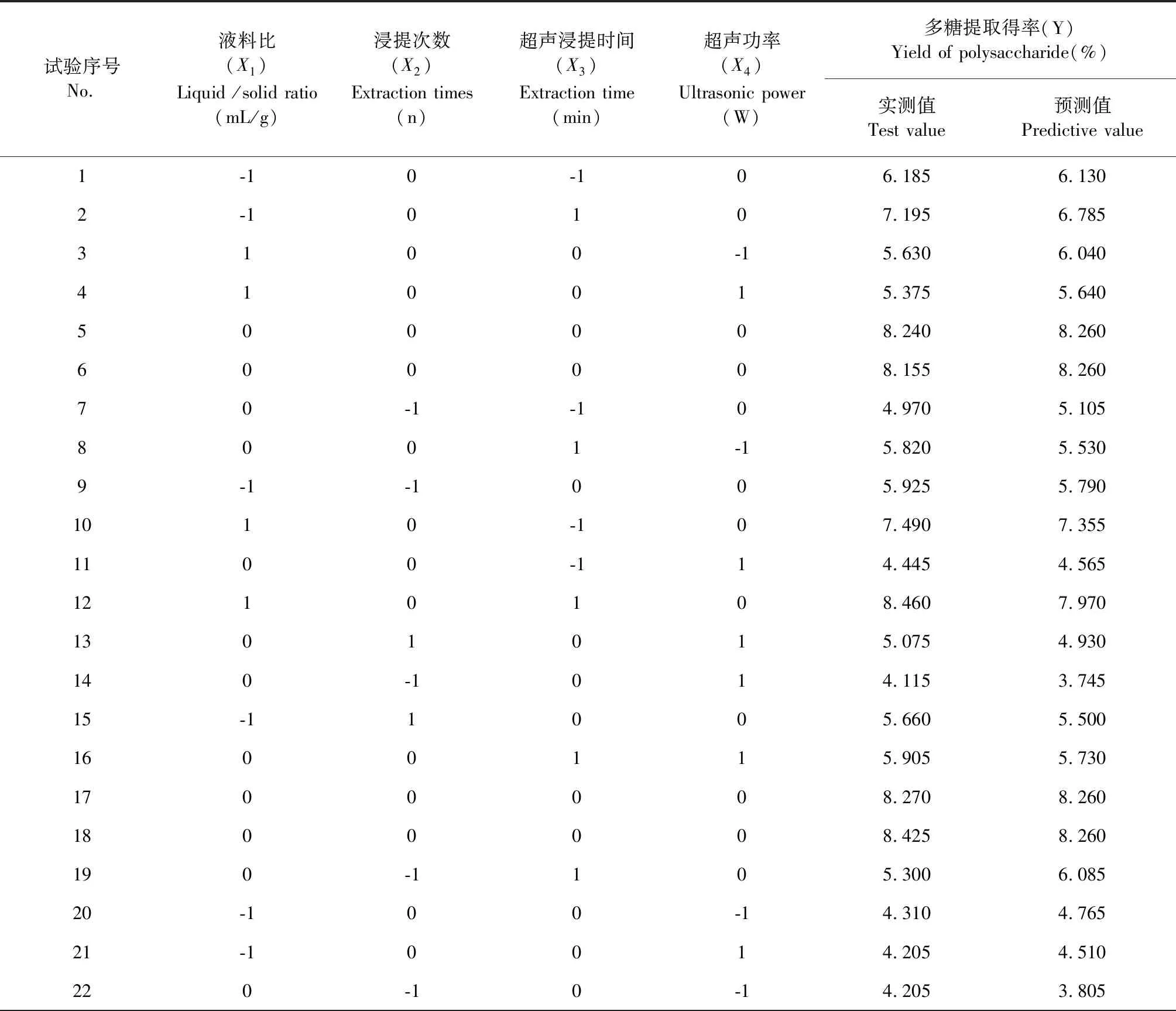
表1 中心試驗設計及試驗結果Table 1 Design and results of central composite experiment
續表1(Continued Tab.1)
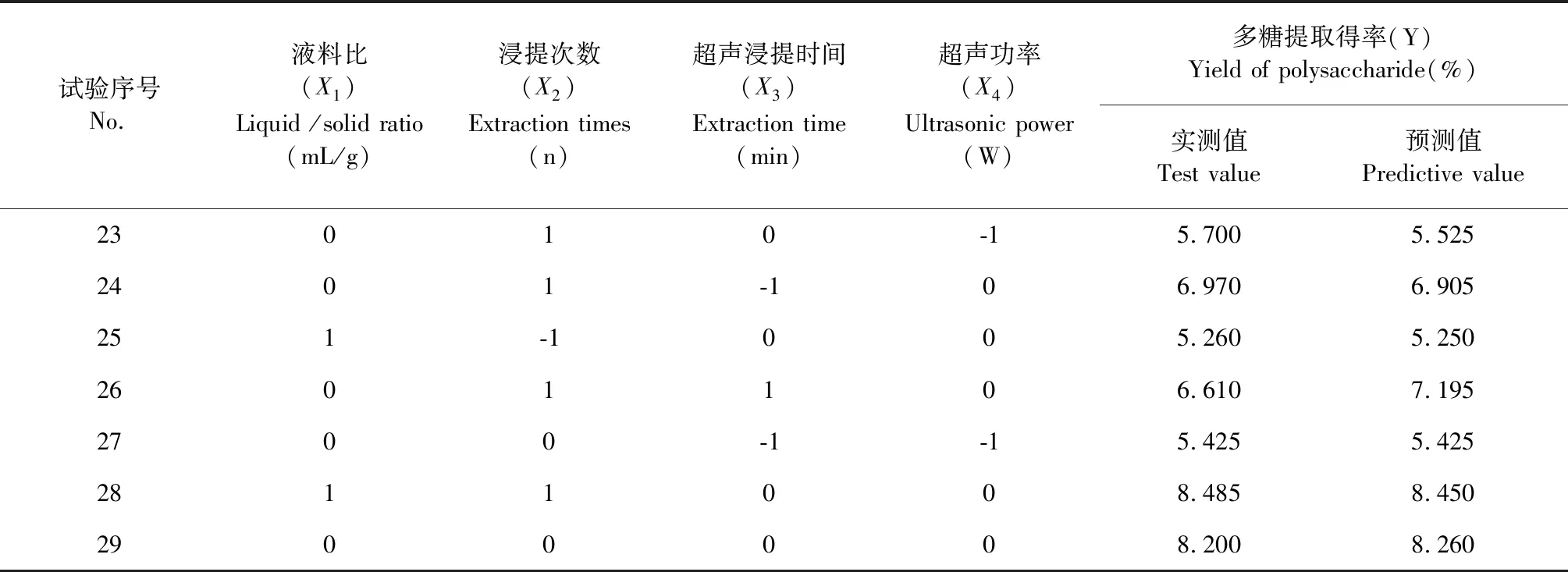
試驗序號No.液料比(X1)Liquid /solid ratio(mL/g)浸提次數(X2)Extraction times(n)超聲浸提時間(X3)Extraction time(min)超聲功率(X4)Ultrasonic power(W)多糖提取得率(Y)Yield of polysaccharide(%)實測值Test value預測值Predictive value23010-15.7005.5252401-106.9706.905251-1005.2605.2502601106.6107.1952700-1-15.4255.4252811008.4858.4502900008.2008.260
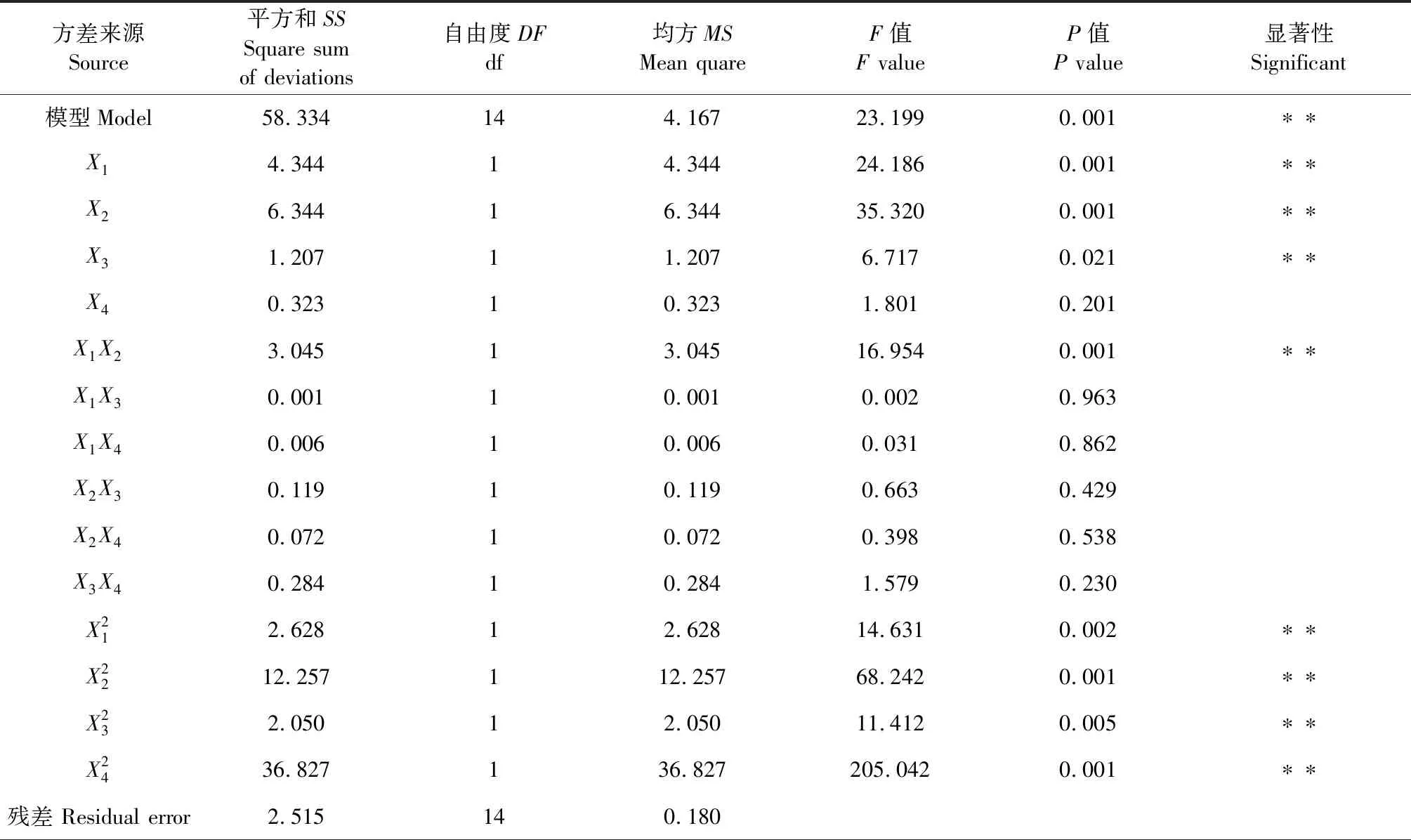
表2 回歸模型的方差分析 Table 2 Variance analysis of regression model
續表2(Continued Tab.2)
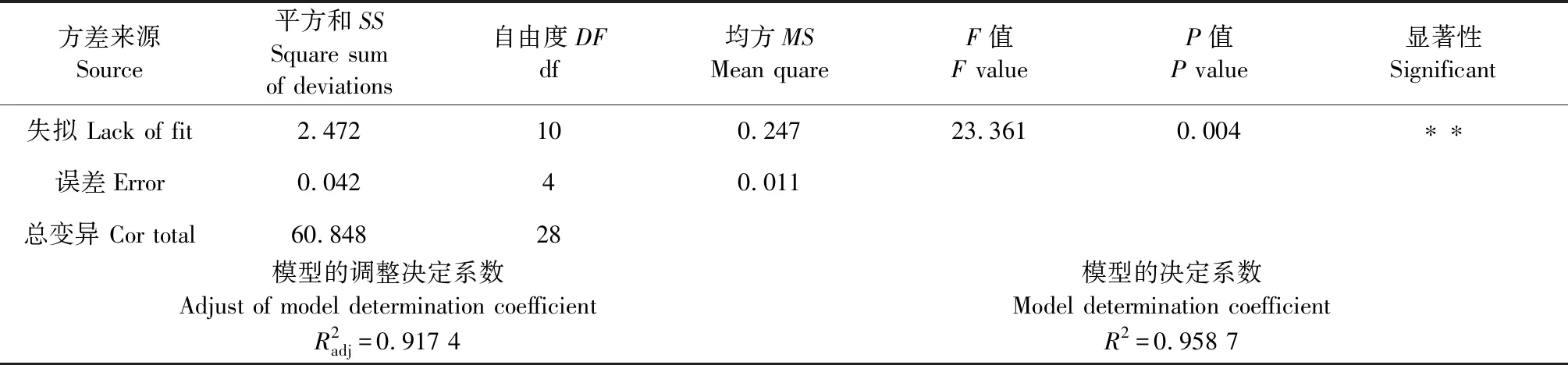
方差來源Source平方和SSSquare sum of deviations自由度DFdf均方MSMean quareF值F valueP值P value顯著性Significant失擬 Lack of fit2.472 10 0.247 23.361 0.004 ??誤差Error0.042 4 0.011 總變異 Cor total60.848 28 模型的決定系數Model determination coefficientR2=0.958 7模型的調整決定系數Adjust of model determination coefficientR2adj=0.917 4
注:*在a=0.05水平上顯著,**表示在a=0.01水平上極顯著。
Note:*Indicates significant at a=0.05 level,**Indicates extremely significant at a=0.01 level.
2.2.2 多糖提取條件的響應面優化分析
為了更直觀地表現二個因素對多糖提取得率的影響,繪制四因素交互作用的響應面圖(圖5),由圖5可知,響應面開口向下,隨著每兩個因素的值增加,響應值增大,當響應值增到極值后,又隨著每兩個因素的增加而逐漸減小。該模型有穩定點,且等高線圖中的曲線都隨著響應面的增加而形成一個頂點,即較佳的蕨菜多糖提取得率。
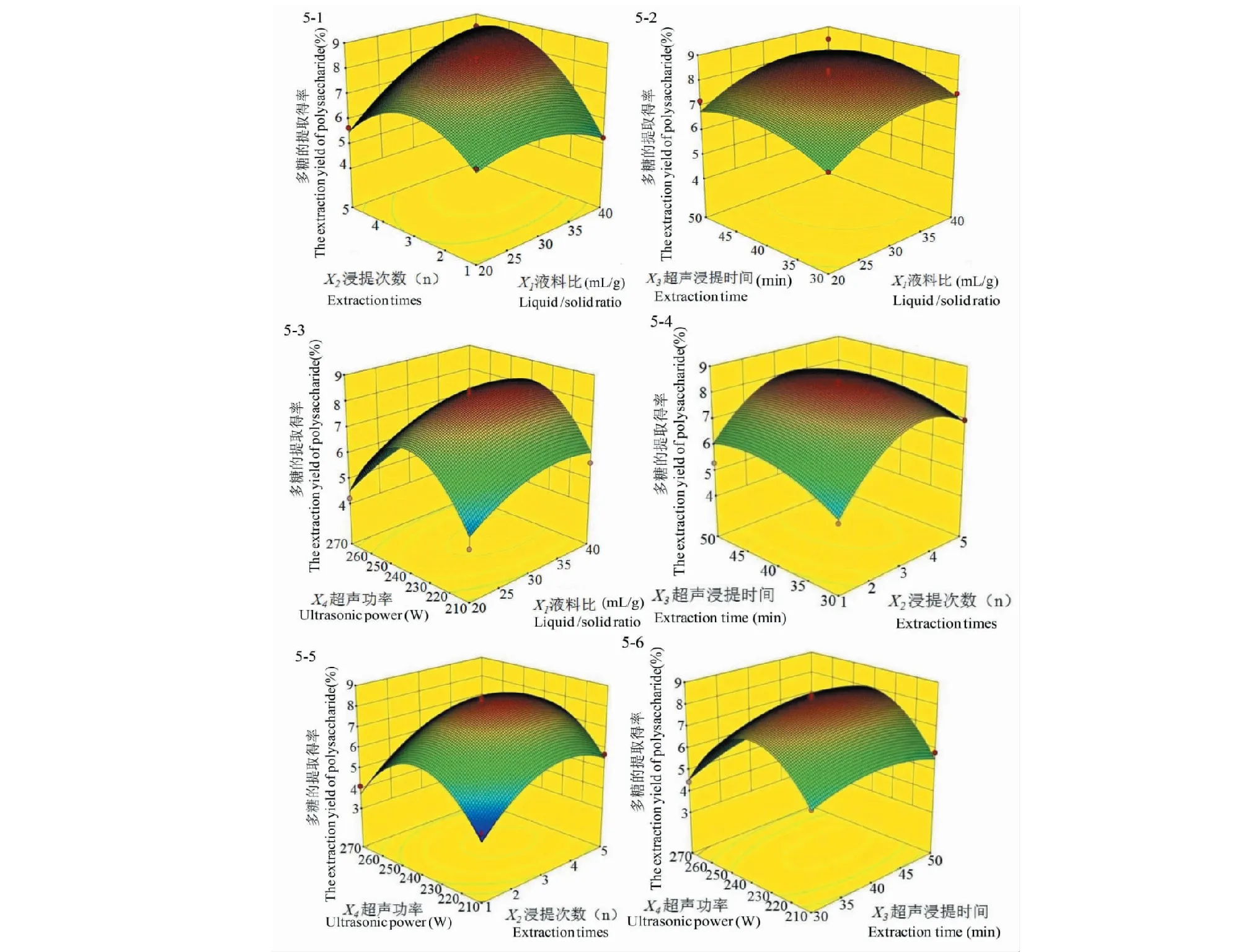
圖5 四因素交互作用對多糖提取得率的響應面圖Fig.5 Response surface plots showing the cross interaction among four factors on extraction rate of polysaccharide
經Design Expert 10.0 軟件分析該模型得到的多糖優化提取條件為液料比:36.2∶1 mL/g、 超聲浸提時間 :43.1 min、浸提次數:4.28次、超聲功率:239.17 W。 在此條件下,蕨菜多糖理論提取得率達 8.72%。 根據實際情況調整后的優化提取條件為:液料比:36.2∶1 mL/g、 超聲浸提時間:43.1 min、浸提次數:4次、提取功率:240 W。在此條件下,重復 3 次試驗得多糖提取得率如表3所示,其提取得率為 8.60%,預測值與實際值接近,因此該工藝參數可用來指導蕨菜多糖提取。

表3 預測值與優化工藝試驗值的比較Table 3 Comparison of simulation and optimized experimental results
2.3 蕨菜多糖藥理活性研究
2.3.1 蕨菜多糖對脾細胞增值的影響
蕨菜多糖對小鼠脾細胞增殖的影響如由圖6所示,空白對照組與陽性對照組相比具有顯著性差異(P<0.05),說明ConA誘導小鼠脾細胞增殖,提示造模成功,藥物組與空白對照組相比,(1~50 μg/mL)各組吸光度均有顯著差異(P<0.05),提示該濃度范圍內蕨菜多糖對誘導脾細胞增殖具有明顯的促進作用,且當蕨菜多糖的濃度達到1 000 μg/mL時,吸光度與空白對照組比較有顯著差異(P<0.05),其對脾細胞增殖具有抑制作用,因此表明蕨菜精制多糖在一定濃度范圍內具有免疫增強活性。
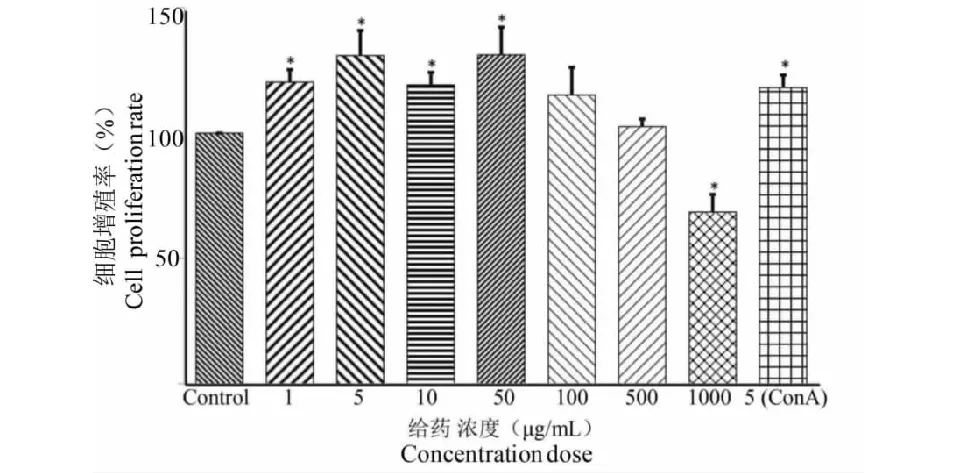
圖6 蕨菜多糖對小鼠脾淋巴細胞增殖的影響Fig.6 Effects of polysaccharide from P.aquilinum on proliferation of mice spleen lymphocyte
2.3.2 蕨菜多糖對腸癌細胞(HCT-8)的抑制效果
蕨菜多糖對結腸癌細胞HCT-8的抑制情況,使用CCK-8法檢測細胞增殖抑制情況,由圖7可得,細胞增殖抑制率與劑量(5~50 μg/mL)蕨菜多糖下呈依賴性抑制。且在該濃度范圍內反應時間相同時,蕨菜多糖的濃度越大,細胞增殖抑制率越高,與對照組比較具有顯著性差異(P<0.01);當蕨菜多糖劑量增加到500 μg/mL時,細胞生長抑制率超過常用抗癌藥物(100 nmol/L)紫杉醇對結腸癌細胞HCT-8的抑制率,結果為蕨菜多糖開發成抗癌藥物提供一定參考。
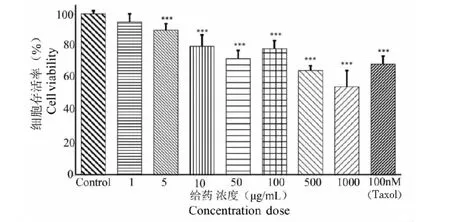
圖7 蕨菜多糖對結腸癌細胞增殖抑制的影響Fig.7 Effects of polysaccharide from P.aquilinum on inhibits the proliferation of HCT-8 cells
3 結論
采用響應面分析法優化蕨菜多糖提取工藝,得到優化工藝條件為:液料比:36.2∶1 mL/g、超聲浸提時間:43.1 min、浸提次數:4次、超聲功率:240 W。在此條件下,蕨菜多糖中多糖的提取得率達8.60%,且各因素對多糖提取得率的影響依次為:浸提次數>液料比>超聲浸提時間>超聲功率,此提取工藝條件合理可行。
通過比較不同濃度的蕨菜精制多糖對小鼠脾細胞增殖能力和抑制結腸癌細胞(HTC-8)增殖能力的影響,結果表明:在一定濃度范圍內蕨菜精制多糖能提高小鼠脾細胞增殖率和抑制結腸癌細胞(HTC-8)的增殖,提示蕨菜多糖在深度開發成提高免疫力和天然抗癌藥物等領域具有較好的潛力。

