青菜泡菜工業發酵過程中微生物群落結構變化分析
于文平,張亞豪,吳正云,宮尾茂雄,張文學,2*
(1.四川大學 輕紡與食品學院,成都 610065;2.四川大學錦江學院 白酒學院, 四川 眉山 620860;3.東京家政大學 家政學部,日本 東京 173-8602)
泡菜是一種以新鮮蔬菜為原料,在一定濃度食鹽水中泡漬,厭氧或兼性厭氧條件下自然發酵而成的蔬菜制品[1]。中國泡菜歷史悠久,文化深厚,最早可追溯到3000年前的周朝[2]。四川泡菜口感脆嫩,營養豐富,富含多種維生素、有機酸和活性乳酸菌,在中國西南地區被廣泛食用[3]。目前,對于泡菜的研究大多停留在對泡菜原料、發酵工藝的優化及風味物質的分析,對泡菜中微生物群落結構的研究較少,如侯方麗等[4]以甘藍為原料,通過自然發酵方式,探究出甘藍泡菜發酵的最佳工藝,曹東等[5]采用SPME-GC-MS 對自制泡菜在發酵過程中不同時期的揮發性風味進行分析。
近年來,分子生物學免培養技術被廣泛地應用到傳統釀造食品的微生物群落研究中,其中,變性梯度凝膠電泳(PCR-DGGE)是一種根據DNA片段溶解性質而使之分離的技術,最先由Muyzer等[6]提出,主要用于檢測樣品中免培養微生物的組成;實時熒光定量PCR(qPCR)作為一種對微生物進行定量的手段而被廣泛用于各種食品的微生物定量分析。為探究四川工業泡菜發酵過程中微生物群落結構,本研究利用PCR-DGGE和qPCR技術對四川工業青菜泡菜中主要微生物進行定性和定量分析,旨在為四川泡菜的工業化發展提供一定的理論基礎。
1 材料與方法
1.1 材料與試劑
材料:取發酵1,3,5,13,26,41,68,81,103,110 d的青菜泡菜液(四川李記醬菜調味品有限公司),置于-20 ℃下貯藏,以備后續實驗。
試劑:E.Z.N.A.?水樣DNA提取試劑盒(美國Omega公司)、DNA Marker(片段約200~2000 bp);瓊脂糖;2×Tag PCR MasterMix(法國Biowest公司);40%丙烯酰胺; 雙丙烯酰胺; 5×TAE緩沖液;尿素;過硫酸銨;去離子甲酰胺、SYBR Green I;無水乙醇;異丙醇;亞鐵氰化鉀;乙酸鋅;四硼酸鈉;對氨基苯磺酸;亞硝酸鈉;鹽酸萘乙二胺;0.1 mol/L NaOH標準溶液。
1.2 儀器
pH計(PHS-3C)、鹽度計(PAL-SALT);手持式阿貝折光儀(WZ-201);梯度PCR儀(MyCyclerTMThermal Cycler);高速冷凍離心機(Sorvall Legend Micro 17R);DGGE(D-CodeTMUniversal Mutation Detection System);熒光定量PCR儀(LightCycle?Nano);電泳儀(DYY-5);凝膠成像儀(Gel DocTMXR+);核酸微量分光光度計(NanoDrop 2000);單人單面凈化工作臺(SW-CJ-1FD);迷你離心機(LX-400);數顯恒溫水浴鍋(HH);微型旋渦混合儀(WH-2)。
1.3 實驗方法
1.3.1 泡菜理化指標測定
pH、鹽度(salinity)、可溶性固形物(TSS),分別使用pH計、鹽度計和手持式阿貝折光儀參照儀器使用方法測定。
泡菜液中總酸(以乳酸計,TTA)含量采用GB/T 12456-2008《食品中總酸的測定》[7]方法測定。
泡菜液中亞硝酸鹽含量(nitrite concentration)采用GB 5009.33—2016《食品安全國家標準 食品中亞硝酸鹽與硝酸鹽的測定》[8]方法測定。
1.3.2 泡菜DNA提取及PCR擴增
利用E.Z.N.A.?水樣DNA提取試劑盒提取泡菜液樣品中微生物的基因組DNA。使用P3f (5′-CC TAC GGG AGG CAG CAG-3′)和P2r (5′-ATT ACC GCG GCT GCT GG-3′)進行16S rRNA擴增,使用NS3f (5′-GC AAG TCT GGT GCC AGC AGC C- 3′)和YM951r (5′-TTG GCA AAT GCT TTC GC- 3′)進行18S rRNA擴增[9]。擴增體系為50 μL,包括2×PCR Mix(5 mL),前后引物各20 pmol,DNA模板10 ng,用雙蒸水補足。擴增程序參照Liang等[10]的方法擴增產物使用2%的瓊脂糖凝膠進行電泳得到目的條帶。
1.3.3 PCR-DGGE分析
將1.3.2得到的擴增產物在8%聚丙烯酰胺凝膠中進行電泳,電泳液是1×TAE緩沖液。細菌和真菌凝膠電泳的變性劑梯度濃度范圍分別是30%~55%和20%~40%。細菌PCR擴增產物在200 V恒壓下電泳4 h,真菌PCR擴增產物在160 V恒壓下電泳4.5 h。電泳結束后,用Gel DocTMXR (Bio-Rad Laboratories)進行成像,觀察結果。
將圖譜上的主要條帶進行切割回收,將回收產物送至生工生物工程(上海)股份有限公司進行克隆測序。將測序序列在NCBI中用BLAST進行序列對比,獲得與GenBank數據庫中相似的序列,然后在RDP中進行分類。
1.3.4 qPCR分析
實時熒光定量PCR用于檢測青菜泡菜發酵過程中乳桿菌屬的數量變化。擴增引物為Lac-f(5′-GCA GCA GTA GGG AAT CTT CCA-3′)和Lac-r(5′-GCA TTY CAC CGC TAC ACA TG-3′)[11]。擴增反應體積是20 μL(1 mL SYBR?Green PCR Master Mix, 2 pmol引物,DNA模板,用雙蒸水補足)。擴增程序:95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火30 s,72 ℃延伸15 s,共40個循環,每個循環末端收集熒光信號。反應結束后,以標準品濃度的對數作為橫坐標,閾值循環數Cq作為縱坐標繪制標準曲線。
2 結果與分析
2.1 泡菜發酵過程中的理化特性
泡菜發酵過程中pH、TTA、TSS、鹽度和亞硝酸鹽含量的變化見圖1。
觀察泡菜pH的變化趨勢,發現隨著發酵的進行,泡菜液的pH從起始的5.90逐漸下降,最終穩定在3.88;泡菜的起始TTA含量為0.67 g/L,隨著發酵進行逐漸上升,發酵81 d后達到最高6.86 g/L,之后再次下降,至終止取樣時降至5.53 g/L。一般認為,泡菜的pH小于4.0,且TTA大于3.0 g/L,是泡菜成熟的標志。可見發酵81 d時,青菜泡菜已可認為發酵成熟。
從發酵開始至發酵結束,泡菜TSS和鹽度有所波動,但變化不大;前者基本維持在8.80%~11.80%之間,后者基本維持在5.30%~6.60%之間,兩者在發酵81 d后基本保持穩定。
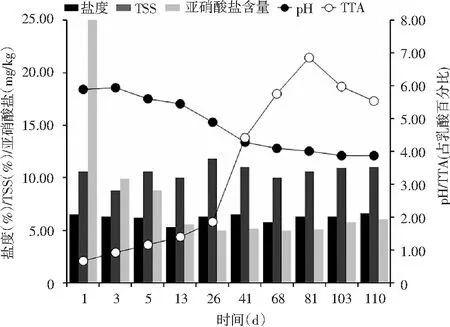
圖1 工業青菜泡菜發酵過程中理化特性變化Fig.1 The changes of physico-chemical properties of industrial pickled vegetables during fermentation
亞硝酸鹽具有致癌性,對人體有害,國標GB 2762-2017《食品安全國家標準 食品中污染物限量》規定泡菜中的亞硝酸鹽含量限量為20 mg/kg。由圖1可知,泡菜中亞硝酸鹽含量在發酵第1天為最高峰,亞硝酸鹽主要來源于青菜原料;隨著發酵進行,亞硝酸鹽含量持續降低,發酵第3天已低于限量值的一半以下,13 d后保持穩定,維持在6.0 mg/kg左右。
2.2 泡菜發酵過程中細菌群落結構
青菜泡菜發酵過程中多樣性指數(H,S和E)大小及其變化見表1。
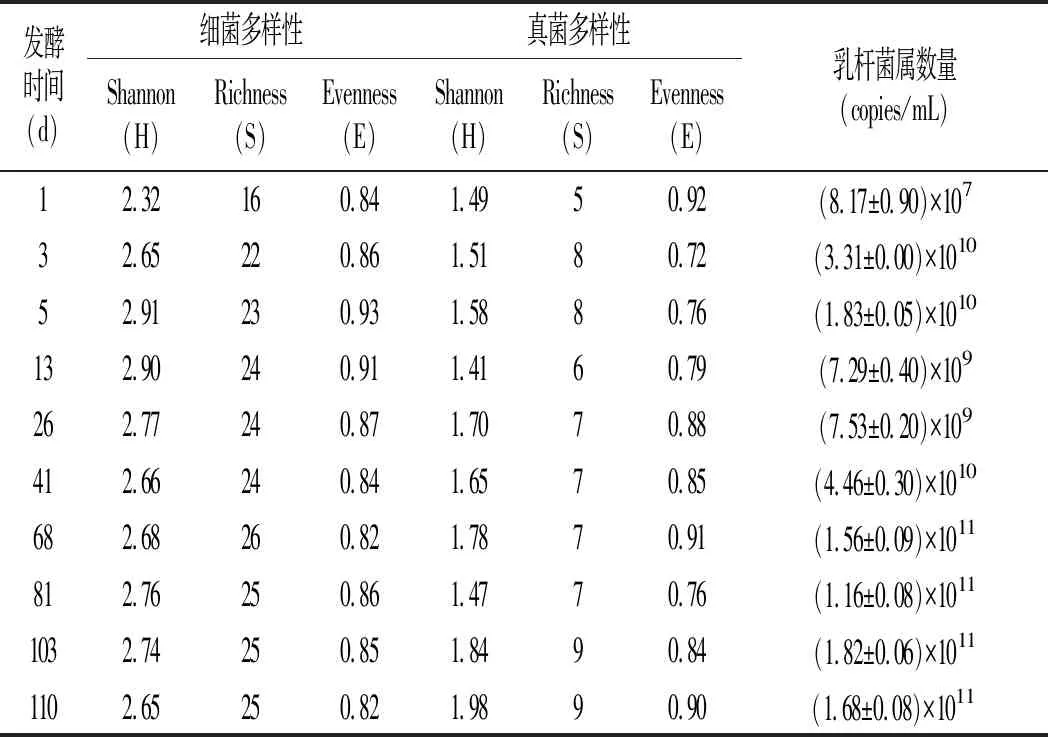
表1 工業青菜泡菜發酵過程中細菌和真菌多樣性 及乳桿菌屬qPCR定量結果Table 1 Diversity of bacteria and fungi during industrial pickled vegetables fermentation and qPCR quantitative results of Lactobacillus
H,S和E值分別代表微生物的群落多樣性、豐富度和均勻度。由表1可知,H值從第1天的2.32增至第5天的2.91,但隨后又降至第110天的2.65;S值從第1天的16增加至第13天的24,最終穩定在24~26之間;E值在發酵過程中始終穩定在0.82~0.93之間。總的來說,泡菜發酵不同階段微生物多樣性、豐富度和均勻度均有變化,推測與泡菜液中pH的變化有關,不耐酸微生物在低pH環境下生長受到抑制。
細菌的DGGE圖譜見圖2中A,共出現30個條帶,具體測序結果見表2。
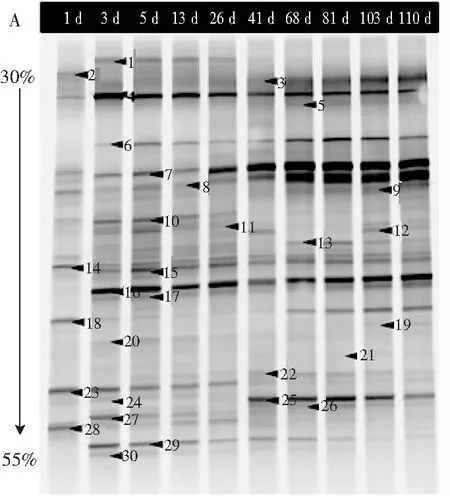
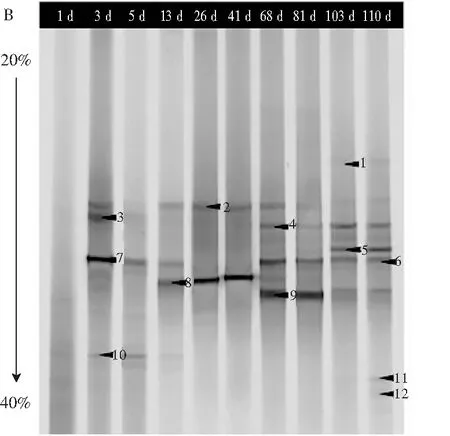
圖2 工業青菜泡菜的細菌(A)和真菌(B)PCR-DGGE條帶Fig.2 The bacteria (A) and fungi (B) PCR-DGGE banls of industrial pickled vegetables
注:泳道1~110表示泡菜發酵的1~110 d,黑色箭頭表示切下測序的條帶,具體測序結果見表2。

表2 DGGE條帶測序結果Table 2 The seguencing results of DGGE

續 表
由圖2中A和表2可知,泡菜樣品含有2個門,厚壁菌門(Firmicutes,19個條帶)和變形菌門(Proteobacteria,11個條帶),共包含12個屬,包括乳桿菌屬(Lactobacillus,條帶6,7,8,9,16,18,25,30)、鹽單胞菌屬(Halomonas,條帶17,28,29)、假單胞菌屬(Pseudomonas,條帶4,10,14),弧菌科細菌(Vibrionaceaebacterium,條帶2)、環菌絲屬(Brochothrixthermosphacta,條帶11)、歐文氏菌屬(Erwinia,條帶15)、鹽弧菌屬(Salinivibrio,條帶22)和其他未分類菌屬。
由圖3中A可知,乳桿菌屬是青菜泡菜中主要的優勢微生物,這與Liang等[12]之前的研究結果一致;而Xiong等的研究進一步發現中國自然發酵泡菜中主要存在的乳桿菌屬是植物乳桿菌(Lactobacillusplantarum)、干酪乳桿菌(Lactobacilluscasei)和玉米乳桿菌(Lactobacilluszeae)。乳酸菌在泡菜發酵過程中能產生大量的有機酸,如乳酸、草酸、檸檬酸、醋酸等,導致發酵液的pH值降低,進一步抑制其他雜菌的生長。
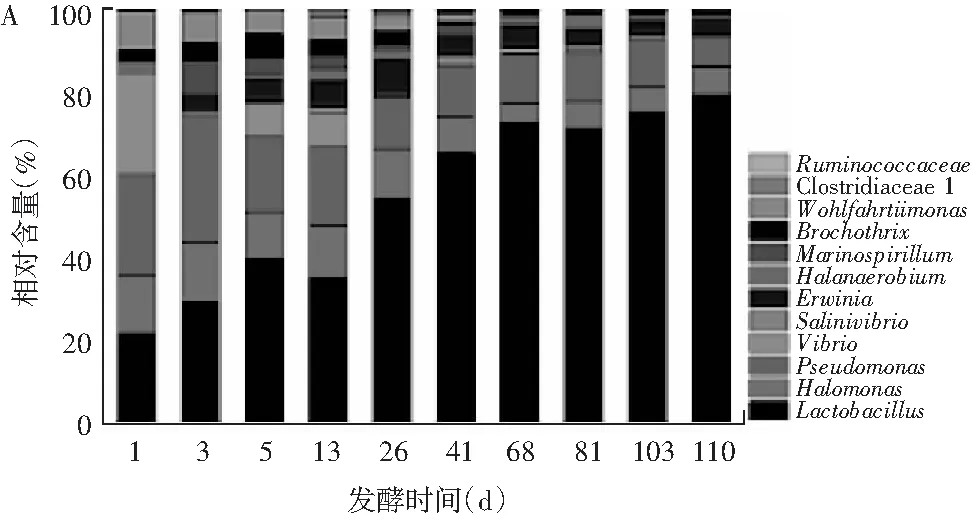
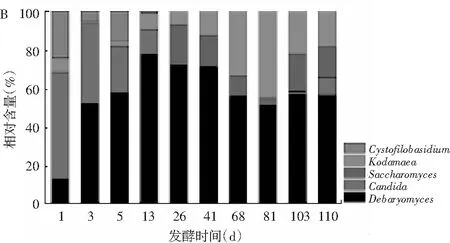
圖3 工業青菜泡菜發酵過程中細菌(A) 和真菌(B)屬水平上群落組成Fig.3 Community composition of bacteria (A) and fungi (B) on genera level during industrial pickled vegetables fermentation
由表2可知,工業青菜泡菜中的乳桿菌屬是消化乳桿菌(Lactobacillusalimentarius)和植物乳桿菌(Lactobacillusplantarum)。消化乳桿菌能夠抑制腐敗微生物的生長,延長發酵食品的保質期,提高產品的質量安全,是天然的生物防腐劑[13]。植物乳桿菌產生的乳酸,是泡菜酸味的主要來源,在發酵過程中可與醇、醛和酮類發生反應,產生大量的風味物質[14,15]。由圖3中A可知,工業青菜泡菜中相對含量最高的是乳桿菌屬、鹽單胞菌屬和假單胞菌屬。鹽單胞菌屬能夠耐鹽,分解葡萄糖,產生多種風味物質,它的存在與工業生產泡菜“鹽漬”這一步驟有關[16]。假單胞菌屬存在于新鮮蔬菜中,生存能力強,適應環境范圍廣[17]。
2.3 泡菜發酵過程中真菌群落結構
真菌DGGE圖譜見圖2中B,共出現了12個條帶,具體測序鑒定結果見表2。由表2可知,真菌群落的H值在1.41~1.98之間,S值在5~9之間,E值在0.72~0.92之間,由此可見真菌群落的多樣性和豐富度均低于細菌群落。結合圖2中B和表2可知,泡菜樣品含有5個屬的真菌,分別是德巴利氏酵母屬(Debaryomyces,條帶1,2,5,6,7,8)、假絲酵母屬(Candida,條帶3,11,12)、Cystofilobasidium(條帶10)、酵母屬(Saccharomyces,條帶4)、柯達酵母屬(Kodamaea,條帶9),其中德巴利氏酵母屬是工業青菜泡菜中的優勢真菌屬。漢遜德巴利氏酵母屬(Debaryomyceshansenii)是青菜泡菜風味物質形成的重要菌屬,可以分解葡萄糖產生D-阿拉伯糖和乙酸乙酯,使泡菜風味更加協調[18]。假絲酵母和酵母屬能夠利用果糖產生酒精[19,20]。
2.4 泡菜發酵過程中微生物群落的RDA分析
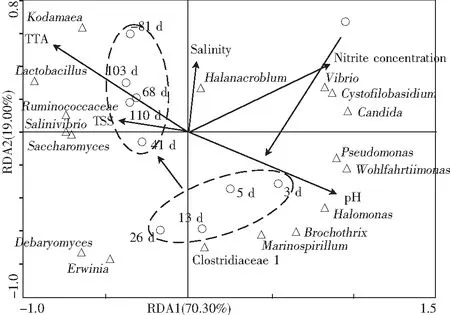
圖4 工業青菜泡菜微生物群落的RDA分析Fig.4 RDA analysis of microbial community structures of industrial pickled vegetables
注:箭頭和長度表示5種變量與微生物群落結構的相關性大小;○表示發酵時間,△表示微生物名稱。
由圖4可知,亞硝酸鹽含量(nitrite concentration)和鹽度(salinity)與發酵第1天的相關性較大,pH與發酵3~26 d的相關性較大,TTA和TSS則與發酵41~110 d的相關性較大。pH值的變化與發酵過程中產生的有機酸有關,低pH能夠抑制病原菌的生長,從而保證泡菜的安全。pH主要在發酵前期的作用較為明顯,而TTA在發酵后期的作用較為明顯,這與圖4反映的信息一致。研究表明,乳桿菌屬能夠抑制發酵過程中亞硝酸鹽還原酶的活性,降低泡菜中亞硝酸鹽的含量[21]。因此,隨著乳桿菌數量的增加,泡菜中亞硝酸鹽含量降低,這也解釋了亞硝峰出現在泡菜發酵前期的現象。
由圖4可知,微生物群落結構與泡菜發酵進程存在一定相關性,假絲酵母屬(Candida)、Cystofilobasidium、弧菌屬(Vibrio)、鹽厭氧菌屬(Halanaerobium)主要與發酵前期相關,假單胞菌屬(Pseudomonas)、Wohlfahrtiimonas、鹽單胞菌屬(Halomonas)、環絲菌屬(Brochothrix)、海螺菌屬(Marinospirillum)、梭菌屬(Clostridiaceae)、歐文氏菌屬(Erwinia)、德巴利氏酵母屬(Debaryomyces)與發酵中期相關,乳桿菌屬(Lactobacillus)、柯達酵母屬(Kodamaea)、酵母屬(Saccharomycescerevisiae)、鹽弧菌屬(Salinivibrio)、疣微菌科(Ruminococcaceae)與發酵后期相關。
2.5 乳桿菌屬的熒光實時定量PCR結果
根據細菌DGGE條帶結果發現乳桿菌屬是工業青菜泡菜中的優勢菌屬。工業青菜泡菜發酵過程中乳桿菌屬數量的變化見表1,所有樣品中,乳桿菌屬的拷貝數為107~1011copies/mL,這表明發酵前后,乳桿菌屬數量迅速增加,然后下降,最后穩定在1011copies/mL,該結果與張亞豪等[22]的研究結果一致。
3 結論
本文結合PCR-DGGE和qPCR技術主要研究了工業青菜泡菜發酵過程中的微生物群落結構演替規律及乳桿菌屬含量變化。細菌群落中,發現2個門(厚壁菌門和變形菌門)、12個屬,主要包括乳桿菌屬、鹽單胞菌屬、假單胞菌屬、弧菌屬、鹽弧菌屬、歐文氏菌屬等,其中乳桿菌屬是優勢菌屬,發酵過程中其含量維持在107~1011copies/mL。種水平上,優勢菌是消化乳桿菌和植物乳桿菌。真菌群落中共檢測到5個屬,包括德巴利氏酵母菌屬、假絲酵母屬、酵母屬、柯達酵母屬、Cystofilobasidium,其中德巴利氏酵母屬是優勢真菌屬。另外,本研究還發現,微生物群落結構與發酵進程具有相關性,因此不同發酵階段優勢菌屬不同。
利用PCR-DGGE和qPCR技術能夠分析出工業青菜泡菜發酵過程中的微生物群落結構,本次研究結果能夠為提高工業化泡菜的質量和規模提供技術支持。

