條件實驗綜合分析滴定法測定藥品含量實驗誤差在教學中的應用
田宗明,田 瓊,毛 燕
(1.浙江醫藥高等專科學校,浙江 寧波 315100;2.湖北工程學院,湖北 孝感 432000)
1 滴定法在藥品含量測定中的應用現狀
藥品的有效成分含量是藥品質量重要指標之一[1],藥品含量的測定通常采用化學分析和儀器分析,而化學分析中的滴定法在藥品含量測定中有廣泛的用途。滴定法起源很早,一直沿用到今天仍然普遍應用,雖然滴定分析實驗步驟多較,而且大多需要控制實驗條件,但是只涉及到稱量、溶解、定容、加熱、移液、滴定等基本操作技術,實驗條件比較低,儀器設備簡單,操作快捷簡便,在藥品的生產企業、檢驗機構、科研院所等均有采用。滴定分析實驗多用于常量分析或半微量分析,相對標準偏差(RSD)在0.2%以內[2],測定結果的準確度很高,能滿足多數藥品含量測定準確度標準的要求。但理論基礎知識、實驗操作技術都會對滴定分析實驗結果的準確性產生很大的影響,也是產生實驗誤差的主要原因。
如何有效控制滴定法在測定藥品含量操作中實驗誤差,是在藥物分析過程中需要關注的重要問題,為提高滴定法在藥品含量的實驗誤差,我們需要進一步學習滴定分析的理論知識,建立實驗誤差分析的方法和思路,找到實驗誤差的來源并在實驗過程中合理實驗過程中合理控制實驗條件,減小實驗誤差,達到對含量藥品測定結果準確度的要求至關重要。采用逆向分析藥品含量實驗的實驗過程,清晰實驗步驟,找出實驗過程的關鍵點,深入理解在測定藥品含量實驗過程中實驗誤差產生的真正原因,利于加深對實驗誤差的認識,從而達到對滴定分析在藥品含量測定過程中產生誤差的精深理解在《中華人民共和國藥典》(簡稱《藥典》)1986版~2015版中,滴定法一直是測定藥品含量的重量方法,而且作為法定方法也是我國醫藥工作者在測定藥品含量過程中廣泛使用。但現實工作是很多人機械的按照藥典的方法測定藥品含量,對理論知識沒有真正的理解,不會融會貫通,在出現實驗誤差的時候,無法解釋并修正,甚至很難甄別、發現實驗誤差,無法確信實驗結果的準確性。總結多年的實驗數據發現,即使在熟練掌握滴定操作技術,得到的平行實驗實驗數據的精密度也很高的情況下,含量測定的結果卻出現較大的差異而產生了誤差,也正是在這種精密度很高準確度卻不高的情況下,處理實驗數據時的很難被甄別發現。
2 分析原因及解決方法
實驗測定過程總為何會出現實驗數據精密度高,實驗結果差異卻很大的問題呢?從實驗過程設計上分析,實驗操作人員參照《藥典》上的方法對藥品含量進行檢測時,如果只是機械地安排實驗步驟,不按實際實驗條件對實驗過程分析,沒有真正理解實驗原理,操作過程中對實驗關鍵點沒有真正控制好,實驗誤差也就很難避免,而且實驗過程中個人的操作習慣相對固定,導致產生誤差的原因往往重現,且對實驗結果影響的程度相近,從而導致實驗數據的很接近,實驗結果的精密度較高,正是這樣的實驗誤差不容易被操作者發現,從而影響實驗結果的準確性。
為了查找誤差來源,可以將藥品含量測定的滴定分析實驗逆向分析,設計成條件實驗,對實驗過程中的關鍵條件進行探討,深入解析誤差產生的原因及實驗條件對實驗結果的影響程度,通過條件實驗驗證,并分析條件實驗數據分析實驗關鍵條件解析的正確性,,進一步優化的實驗條件 通找到減小實驗誤差的關鍵因素,提高滴定法測定藥品含量準確性。在此基礎上可進一步將《藥典》中常見藥品含量測定的滴定分析實驗分類、歸納,列出實驗關鍵條件,分析誤差來源并總結規律,形成方便學習應用的技術資料。
3 條件實驗分析應用實例
現以葡萄糖(C6H12O6)注射液中C6H12O6含量測定實驗為例,深入解析條件實驗的解析及數據處理分析過程。參照《藥典》2000版[3],設計驗證實驗步驟:移取C6H12O6標準溶液4.00 mL至1000 mL容量瓶,稀釋、定容、搖勻,再移取C6H12O6稀釋液25.00 mL至250 mL碘量瓶中,加入25.00 mL,0.01 mol/L I2標準溶液,滴加2 mol/L NaOH溶液至碘量瓶,至溶液呈淺黃色后,加蓋后水封,于暗處放置約15 min,加6 mL,2 mol/L HCl溶液,用0.02 mol/L Na2S2O3標準溶液滴定,當碘量瓶中反應液顯淺黃色后,再加0.5%淀粉指示劑1 mL,接著滴加Na2S2O3標準溶液至藍色恰好消失,記錄消耗Na2S2O3標準溶液的體積,平行5次實驗,計算注射液中C6H12O6的含量 。
分析實驗過程,解析實驗原理:單質碘(I2)與氫氧化鈉(NaOH)反應,生成的次碘酸鈉(NaIO)能定量的將葡萄糖(C6H12O6)氧化成葡萄糖酸(C6H12O7),用鹽酸(HCl)酸化,未與葡萄糖反應的次碘酸鈉轉化成的單質碘再用硫代硫酸鈉(Na2S2O3)標準溶液滴定,最后計算葡萄糖的含量,其反應如下[4]:
I2與NaOH反應:
I2+2NaOHNaIO + NaI + H2O
NaIO與C6H12O6反應:
C6H12O6+NaIOC6H12O7+ NaI
I2氧化C6H12O6的總反應:
I2+ C6H12O6+ 2NaOHC6H12O7+ 2NaI + H2O
C6H12O6反應完后, 堿性條件下NaIO歧化:
加HCl酸化,析出I2:
NaIO3+ 5NaI + 6HCl3I2+ 6NaCl + 3H2O
析出的I2與Na2S2O3反應:
I2+2Na2S2O3Na2S4O6+ 2NaI
分析反應式可以得出:C6H12O6與I2反應的物質的量之比為1∶1;剩余的I2與Na2S2O3反應的物質的量之比為1∶2。故注射液中C6H12O6的含量ρ(C6H12O6)(g/L)如下式計算:
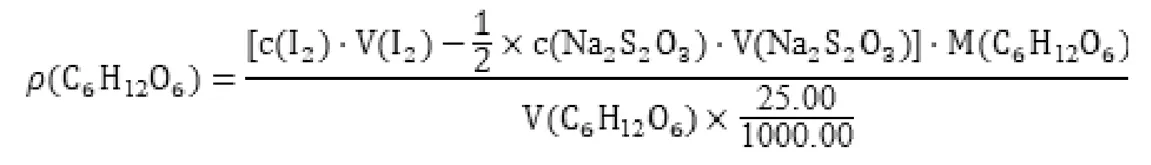
M(C6H12O6) =180.16g/mol[5]
實驗過程中有四個影響實驗結果的關鍵條件[6]:①NaOH溶液用量及加入速度。②加NaOH溶液后,于暗處放置時間。③HCl溶液用量。④淀粉指示劑的用量及加入時機。已葡萄糖標準溶液為參照,分別設計條件實驗來驗證實驗誤差,探討測定葡萄糖含量的最佳滴定實驗條件。
3.1 實驗儀器及試劑
3.1.1 實驗儀器
電子天平(Sartorius BAS224S,已校準)、棕色堿式滴定管(25 mL,已校準);容量瓶(1000 mL,250 mL,已校準)、碘量瓶(250 mL)、量筒(10 mL)、移液管(25 mL,已校準)、吸量管(5 mL,已校準)。
3.1.2 實驗試劑
HCl溶液(2 mol/L)、NaOH溶液(2 mol/L)、淀粉指示劑(0.5%)、葡萄糖注射液(5%)、Na2S2O3標準溶液(0.02017 mol/L)、I2標準溶液(0.01026 mol/L)。
3.2 NaOH溶液用量及加入速度實驗
堿性太弱時,I2歧化反應不完全,生成NaIO的量少,不能完全氧化C6H12O6,使得C6H12O6含量測定結果偏低;堿性太強時,加入相同量HCl溶液后,未反應的碘在酸性偏弱的條件下不能以完全以I2形式析出,且酸性較弱時Na2S2O3與I2反應生成SO42-,使得Na2S2O3標準溶液消耗偏少,C6H12O6含量測定結果偏高,所以要嚴格控制NaOH溶液的用量。在加入NaOH溶液時,也應注意加入速度,加入速度太快會使生成的NaIO進一步歧化,導致C6H12O6不能被完全氧化;加入速度太慢時,I2揮發和生成的NaIO分解都會導致Na2S2O3標準溶液消耗偏少,C6H12O6含量測定結果偏高。
設計5次平行實驗,分別加入2 mol/L NaOH溶液2.0、3.0、4.0、5.0、6.0 mL,考察NaOH溶液用量對C6H12O6含量測定結果的影響,分析表1實驗數據,選擇最合理的NaOH溶液體積。再設計5次平行實驗,分別以1次性、分3次、每秒3滴、每秒1滴、每5秒1滴、每10秒1滴的速度加入NaOH溶液,考察加入NaOH溶液的速度對C6H12O6含量測定結果的影響(表1),根據實驗數據表2分析最合理的NaOH溶液加入速度。
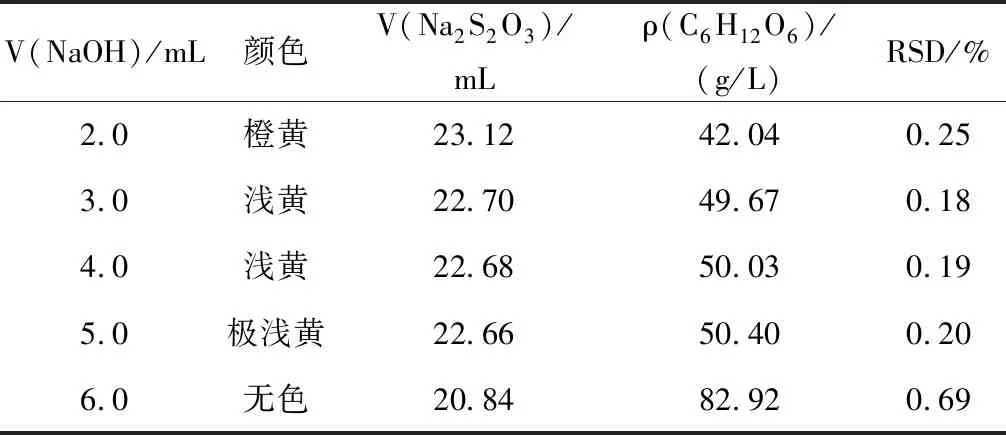
表1 不同NaOH溶液用量的實驗數據Table 1 Experimental data of the amount of sodium hydroxide solution
注:V(Na2S2O3)為5次實驗Na2S2O3標準溶液消耗體積的平均值;顏色是指加入NaOH后反應液呈現的顏色。
分析表1實驗數據,與葡萄糖標準溶液濃度比較,當加入3.0~5.0 mL,2 mol/L的 NaOH溶液時,C6H12O6含量測定結果合理,RSD較小。
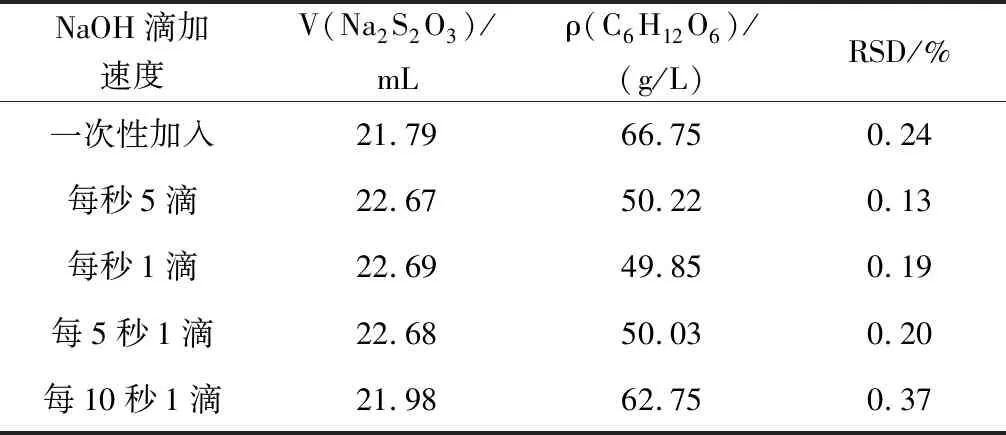
表2 NaOH溶液滴加速度不同的實驗數據Table 2 Experimental data of dropping of sodium hydroxide solution
注:V(Na2S2O3)為5次實驗Na2S2O3標準溶液消耗體積的平均值。
分析表2實驗數據,在加入NaOH溶液時,速度不能太快或太慢,實驗中以每秒3滴至每5秒1滴邊滴邊搖的方式加入實驗結果準確,RSD也在合理范圍內。
3.3 加入NaOH溶液后放置時間實驗
實驗過程中,加入NaOH溶液后需在暗處放置一段時間,是因為I2與NaOH歧化生成的NaIO氧化C6H12O6的反應速度并不是很快,放置時間如果太短,C6H12O6不能被完全氧化,導致測定C6H12O6含量測定結果偏低;放置時間如果太長,剩余的I2揮發和NaIO不穩定分解,都導致C6H12O6含量測定偏高。
設計5次平行實驗,在加入NaOH溶液后,選擇分別在暗處放置5、10、15、20、25分鐘后再測定C6H12O6含量,考察加入NaOH溶液后在暗處放置時間對C6H12O6含量測定結果的影響,根據表3實驗數據分析合理的暗處放置時間。
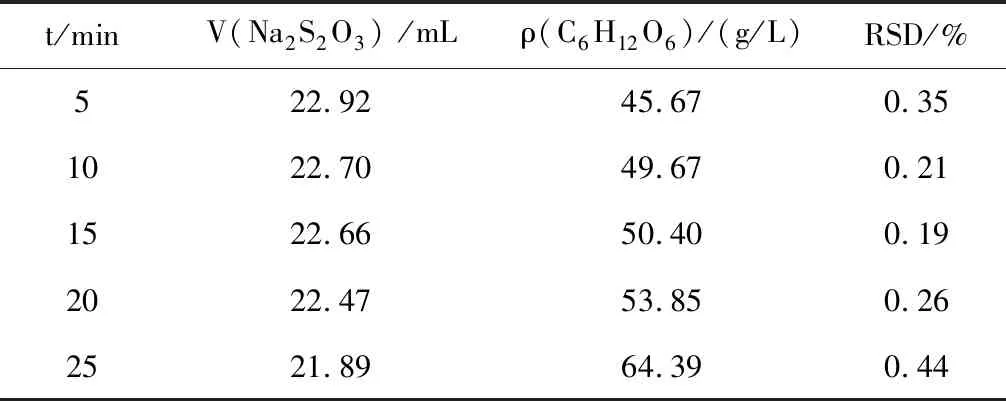
表3 加NaOH溶液后放置時間不同的實驗數據Table 3 Experimental data of the place time after dropping the sodium hydroxide solution
注:t指加入NaOH溶液后于暗處放置的時間;V(Na2S2O3) 為5次實驗Na2S2O3標準溶液消耗體積的平均值。
分析表3實驗數據,加入NaOH溶液后于暗處放置的時間對測定結果的準確性影響很大,參照C6H12O6標準溶液濃度,滴加NaOH溶液后在暗處放置10~16 min,測含量定結果準確,RSD合理。
3.4 HCl溶液用量實驗
加入NaOH溶液于暗處放置后,為了剩余的碘以I2析出,需要再加一定量的HCl溶液,如果HCl溶液用量過少時,溶液酸性弱,Na2S2O3與I2反應生成SO42-, Na2S2O3標準溶液消耗體積偏少,使C6H12O6含量測定結果偏高; 如果HCl溶液用量過多時,溶液酸性太強,Na2S2O3會分解, Na2S2O3標準溶液消耗體積增多,使C6H12O6含量測定結果偏低。
設計5次平行實驗,分別在加入NaOH溶液于暗處放置后再加入3.0、5.0、7.0、9.0、11.0 mL,2 mol/L HCl溶液,考察HCl溶液用量對C6H12O6含量測定結果的影響,然后根據表4實驗數據分析出合理的HCl溶液用量。

表4 不同HCl溶液用量的實驗數據Table 4 Experimental data of the amount of hydrochloric acid
注:V(Na2S2O3) 為5次實驗Na2S2O3標準溶液消耗體積的平均值;顏色是指加入HCl溶液后反應液呈現的顏色。
分析表4實驗數據,酸性的強弱導致的副反應直接關系反應進行的完全程度,標準溶液的消耗體積差異明顯,對C6H12O6含量測定結果的準確性影響很大,數據表明加入 2 mol/L HCl溶液 5.0~7.0 mL最佳。
3.5 淀粉指示劑用量及加入時機實驗
間接碘量法需要在接近終點時加入淀粉指示劑,加入指示劑時溶液顏色呈現淺黃較合適,如果顏色太深表明I2量多,與淀粉生成包合物中的I2容易被牢固吸附而不易被滴定, Na2S2O3標準溶液消耗的體積會增加,滴定終點滯后導致C6H12O6含量測定結果偏低。
設計5次平行實驗,分別選擇在消耗Na2S2O3標準溶液10.00、15.00、20.00、21.00、22.00 mL后加入1.00 mL 0.5%淀粉指示劑,考察加入淀粉指示劑時機對C6H12O6含量測定結果的影響,根據表5實驗數據分析加入淀粉指示劑的最佳時機。
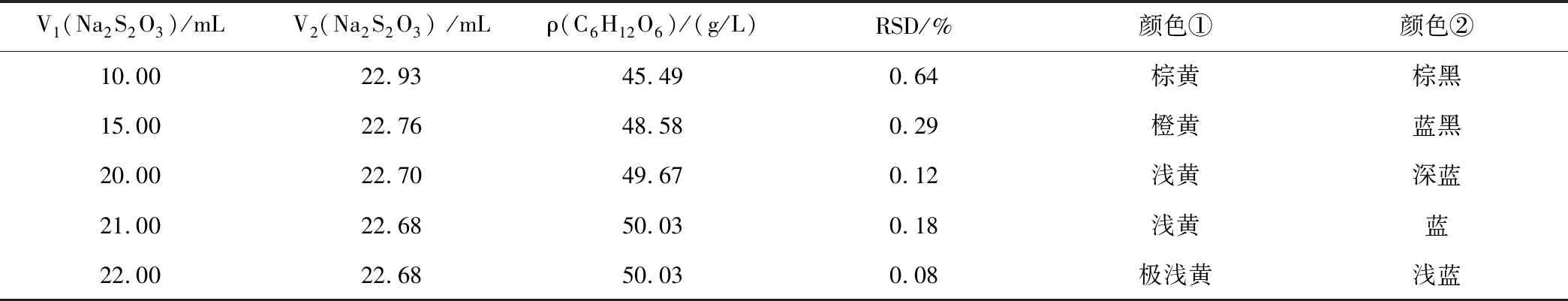
表5 淀粉指示劑加入時機的實驗數據Table 5 Experimental data of starch indicator added opportunity
注:V1(Na2S2O3)為加淀粉指示劑時Na2S2O3標準溶液已消耗體積;V2(Na2S2O3) 為5次實驗Na2S2O3標準溶液消耗體積的平均值;顏色①是指加淀粉指示劑時反應液呈現的顏色;顏色②是指加淀粉指示劑后反應液呈現的顏色。
分析表5實驗數據,加入淀粉指示劑時機對實驗結果的影響不如其他因素大,在實驗滴定過程中,當溶液顏色呈現較淺黃后再加淀粉指示劑,就可以得到合理的實驗結果及RSD。
淀粉指示劑的用量過少時溶液顏色太淺,很難判斷終點,容易導致實驗數據精密度不高,相對標準偏差也較大;用量過多時顏色深,包合物中I2被牢固吸附,滴定終點滯后,,滴定終點滯后導致C6H12O6含量測定結果偏高低。設計5個平行實驗,分別加入0.5%淀粉指示劑0.10、0.50、1.00、2.00、4.00 mL,考察淀粉指示劑的用量對C6H12O6含量測定結果的影響,根據表6實驗數據分析出合理的指示劑用量。
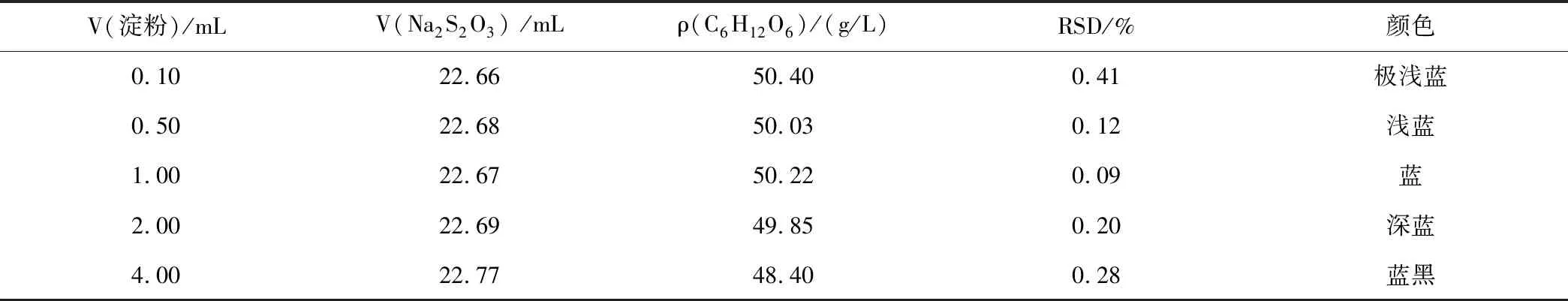
表6 淀粉指示劑用量不同的實驗數據Table 6 Experimental data of the amount of starch indicator
注:V(Na2S2O3) 為5次實驗Na2S2O3標準溶液消耗體積的平均值;顏色是指加入淀粉指示劑后反應液呈現的顏色。
分析表6實驗數據,如果指示劑用量太多時,溶液顏色太深,滴定終點滯后,相應Na2S2O3標準溶液消耗體積也偏大,導致C6H12O6含量測定結果也偏低;如果指示劑用量太少時,實驗終點判斷困難,RSD偏大,當加入0.5%淀粉指示劑0.50~2.00 mL時,測定結果合理。
4 結論
通過解析實驗原理,設計條件實驗,通過分析30組實驗驗數據可以明確間接碘量法測定C6H12O6注射液含量實驗的最合理條件:取質量分數為0.5%的C6H12O6注射液25.00 mL,加入0.01026 mol/L的 I2標準溶液25.00 mL后,以約每秒5滴至約每秒1滴且邊滴邊搖的速度加3.0~5.0 mL 2 mol/L NaOH溶液后,在暗處放置10~15 min后,加入5.0~7.0 mL 2 mol/L的HCl溶液,再用0.02017 mol/L的Na2S2O3標準溶液滴定,溶液呈淺黃色后,加入0.50~2.00 mL 0.5%的淀粉指示劑,繼續用Na2S2O3標準溶液滴至藍色剛好消失,實驗數據重現性好,RSD≤0.2%,C6H12O6含量測定結果準確合理。
實驗過程中,要完成這種條件實驗分析的滴定分析實驗誤差,必須先掌握滴定分析的基本實驗操作技術,包括稱量、溶解、定容、移液、滴定等,還要掌握實驗數據處理的一般方法及實驗誤差分析等知識。設計并完成條件實驗后,可以通過條件實驗數據對整個藥品含量滴定實驗進行實驗條件分析,比較直觀的分析出不同實驗條件對藥物含量測定結果影響的程度,進而更透徹的理解實驗原理、把握實驗關鍵點,提升綜合分析處理實驗數據的能力。實驗過程中剖析關鍵點,設計合理的條件實驗是關鍵,要求實驗工作者深入研究并能準確預估不同的實驗條件對實驗結果可能的影響,最終通過分析條件實驗數據得到最佳的實驗條件,減小實驗誤差,提高藥品含量測定結果的準確性。

