脂肪干細胞抑制老年類風濕關節炎小鼠的炎癥反應
李宏亮 孫璇 龔蕓蕓 成嘉祁 劉暢 劉明珠 王生存 劉春 王慶華 邵義祥
(南通大學 1杏林學院,江蘇 南通 226001;2醫學院;3實驗動物中心)
類風濕關節炎(RA)是以對稱性滑膜慢性炎癥、關節軟骨和骨破壞為特征的一種系統性自身免疫性疾病〔1〕。臨床表現為多關節炎,主要累及手、腕、足等小關節,常反復發作,對稱分布,遷延難愈,此外還有發熱、疲乏等全身表現〔2〕。主要以關節滑膜細胞增生、血管翳形成、炎性細胞浸潤、軟骨及軟骨下骨破壞為病理變化,最終導致關節畸形強直,功能障礙〔3〕。本病的病因尚未完全闡明,多認為與感染、遺傳、環境、性激素水平及營養不良、外傷、勞累、神經精神狀態有關〔4,5〕。目前國內外對RA的治療主要采取藥物治療、外科治療和心理康復治療。藥物治療主要以非甾體類抗炎藥、抗風濕藥、糖皮質激素和植物制劑為主〔6〕,但效果不甚明顯,其發病率和致殘率仍居高不下。目前RA治療的最終目標是防止和控制關節損壞,阻止功能喪失。近年來干細胞技術在世界范圍內被廣泛成熟應用,脂肪干細胞(ADSCs)是從脂肪組織中分離得到的一種具有多向分化潛能的干細胞〔7〕。具有廣泛增殖和分化成多個細胞系的能力〔8〕,主要功能為組織細胞修復,促進細胞再生及免疫調控〔9,10〕。ADSCs因其諸多的優勢功能及來源廣泛、取材方便、不易衰老、排斥反應低等特點被大量的應用于臨床治療,成為骨組織工程研究的熱點〔11,12〕。研究發現其具有抑制效應T細胞和調節炎癥反應的能力〔13〕。但目前尚未見其用于治療RA的報道。本研究旨在探討ADSCs在RA治療中的抗炎作用及其機制。
1 材料與方法
1.1主要試劑 雞Ⅱ型膠原(CⅡ)購自Sigma公司產品,實時熒光定量-聚合酶鏈反應(RT-PCR)試劑盒、逆轉錄試劑盒及Trizol購自南京諾維贊生物技術有限公司產品;蘇木素-伊紅(HE)染色試劑盒購自索萊寶生物科技有限公司產品;白細胞介素(IL)-1β、IL-10、IL-6及腫瘤壞死因子(TNF)-α檢測試劑盒購自武漢優爾生公司;引物由南京思普金生物科技有限公司合成。小鼠ADSCs由南京大學模式動物研究所提供。
1.2實驗動物 健康雌性SPF級C5BL/6J小鼠30只,8周齡,23~27 g,由南通大學實驗動物中心提供〔實驗動物生產許可證號:SCXK(蘇)2014-0001〕。飼養于實驗動物中心屏障環境動物實驗室〔SYXK(蘇):2015-0016〕,5只/籠,相對濕度40%~70%,12 h/12 h明暗周期光照,溫度22~25℃,自由采食和飲水。實驗動物飼養及取材操作規程獲得南通大學實驗動物管理委員會批準。
1.3RA模型的誘導 CⅡ以2 mg/ml的濃度溶解于0.1 mol/L pH3.2的乙酸中,置于4℃冰箱中過夜充分溶解。次日用等體積的完全弗氏佐劑(CFA)混合乳化,隨后每只老鼠以100 μl劑量尾部皮下均勻注射4~6個點。注射日計作0 d,其后每日觀察小鼠關節炎癥情況。第7天進行加強免疫,每只小鼠腹腔注射100 μl的CⅡ/CFA乳劑;第14天再次加強免疫,每只小鼠腹腔與尾部皮下各注射100 μl的CⅡ/CFA乳劑,皮下多點注射,最終存活個體作為實驗對象。隨機抽取3只小鼠進行X線平片(X-Ray)檢測,并結合小鼠關節炎評分確定造模是否成功。
1.4ADSCs治療及取材 ADSCs采用膠原酶裂解法獲得,用標準高糖混合F12培養基(DMEM-F12)進行擴增。第3代ADSCs被用于RA模型的治療,治療前檢測微生物和內毒素。當小鼠關節炎評分>2分,并確認造模成功后進行干細胞治療,治療組小鼠尾靜脈注射含有2×106個ADSCs的DMEM-F12培養液200 μl,對照組小鼠注射等量DMEM-F12,并計作0 d。在7 d、14 d再次進行治療。小鼠雙后足踝關節注射CⅡ/CFA乳劑誘導炎癥發生5 d后,用便攜式測厚儀測量各組小鼠雙側踝關節直徑,并根據其腫脹程度進行關節評分,每隔2天檢測1次,至第35天。小鼠踝關節的病變程度按5級評分法,評分標準:關節無紅腫計0分;踝關節輕度紅腫,不累及足趾計1分;踝關節輕度紅腫,累及足趾計2分;踝關節中度紅腫,并伴有組織腫脹計3分;踝關節重度紅腫,并出現功能障礙計4分。開始治療后30 d,動物麻醉后心臟采血,取膝關節滑膜及周圍組織置于4%多聚甲醛溶液(PFA)中固定,4℃保存備用。
1.5病理學切片制作及分析 膝關節滑膜及周圍組織在PFA中充分固定后,磷酸鹽緩沖液(PBS)清洗1 h,重復1次,接著10%乙二胺四乙酸(EDTA)溶液脫鈣處理4 w,隨后經30%、50%、70%、80、90%乙醇溶液各1 h,無水乙醇1 h,重復1次,二甲苯透明30 min,重復1次,透蠟2 h,重復1次,包埋,徠卡石蠟切片機行5 μm切片,常規脫蠟復水后進行HE染色,中性樹膠封片后鏡檢并拍照存儲。
1.6RNA提取及qRT-PCR分析 膝關節滑膜及周圍組織經液氮處理后存放于-80℃冰箱,檢測時取出加入1 ml總RNA提取試劑(Trizol)后冰浴勻漿,在室溫下靜置5 min后于4℃下12 000 r/min離心15 min,上清液用異丙醇沉淀RNA,再次離心10 min,75%乙醇洗滌,焦碳酸二乙酯(DEPC)水溶解并測定濃度。0.8%的瓊脂糖凝膠電泳檢測RNA完整性后,將RNA逆轉錄成cDNA,并利用SYBR熒光體系在ABI7300上進行qRT-PCR檢測,每個樣品設3個復孔,計算2-ΔΔCt值,以GAPDH為內參,引物序列:IL-10:正向:5′-CAGAGTCTAGGATGGGTTCATTAC-3′,反向:5′-TCCCAGCTGCACTTCATTT-3′;IL-6:正向:5′-GTCAACTCCATCTGCCCTTC-3′,反向:5′-TGTGGGTGGTATCCTCTGTG-3′;IL-1β:正向:5′-GA AGAAGAGCCCATCCTCTG-3′,反向:5′-TCATCTCGGAGCCTGTAGTG-3′;TNF-α:正向:5′-CCAAAGGGATGAGAAGTTCC-3′,反向:5′-CTCCACTTGGTGGTTTGCTA-3;GAPDH:正向:5′-GAAGGTGAAGGTCGGAGTC-3′,反向:5′-GAAGATGGTGATGGGATTTC-3′。
1.7酶聯免疫吸附試驗(ELISA) IL-1β、IL-10及TNF-α按照試劑盒說明書進行檢測。
1.8統計分析 采用SPSS23.0軟件進行t檢驗。
2 結 果
2.1小鼠關節直徑及腫脹程度測定 模型組小鼠的評分始終維持在4分水平,而干細胞組小鼠的評分在用藥后第20天基本達到2分甚至1分,說明其腫脹程度被明顯抑制。
2.2兩組關節水腫情況 從外觀上發現模型組小鼠雙足踝關節有明顯的腫脹,皮膚顏色較深,伴有運動功能障礙,甚至出現跛行。相較于模型組,干細胞組關節腫脹程度明顯被抑制(圖1)。
2.3兩組關節病理情況 經HE染色,模型組踝關節出現典型的炎癥表現,如軟骨損傷,滑膜增生,大量的炎性細胞浸潤。而干細胞組關節病理變化得到顯著改善,軟骨損傷及滑膜增生減輕,炎性細胞浸潤明顯減少(圖2)。
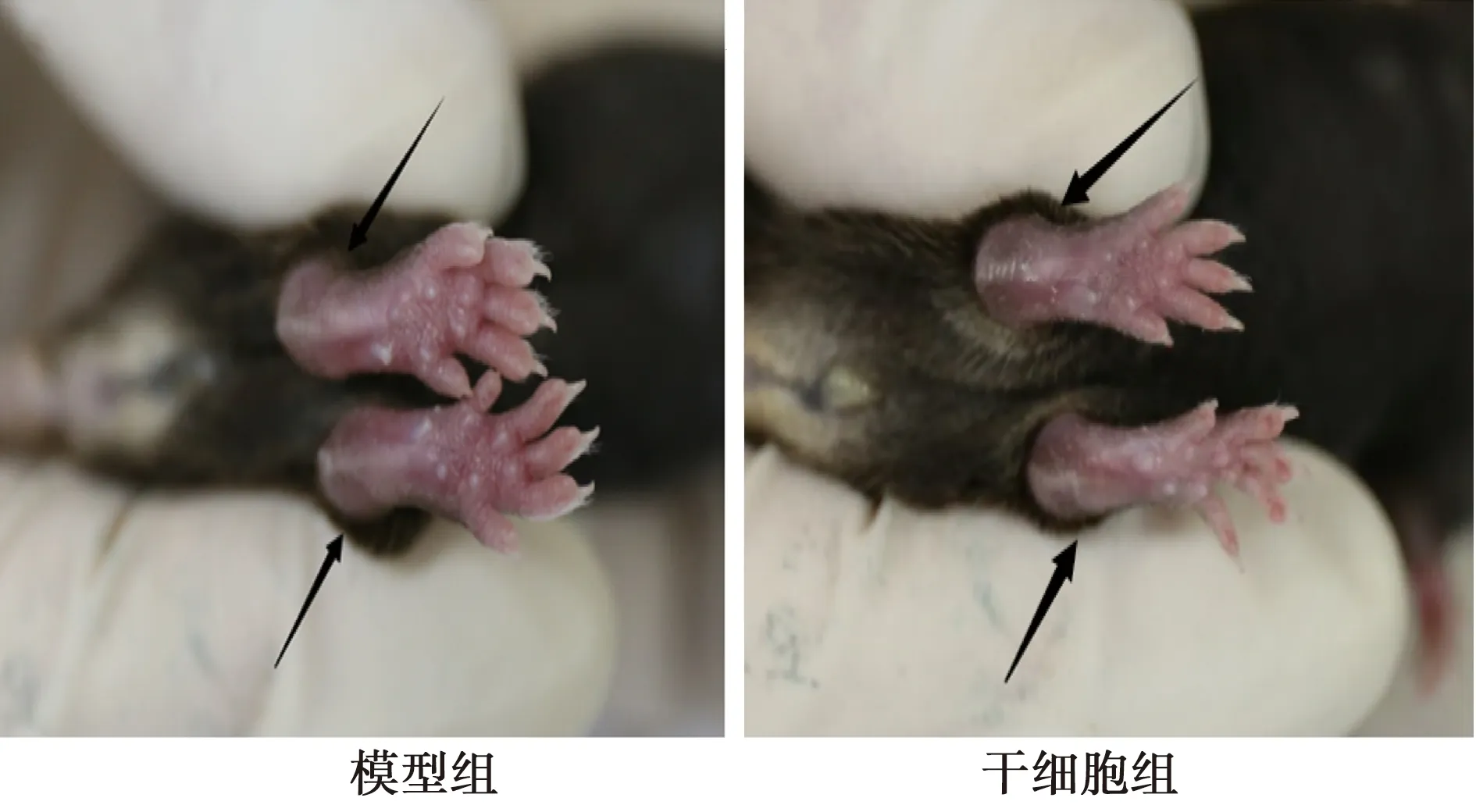
圖1 兩組小鼠關節水腫情況
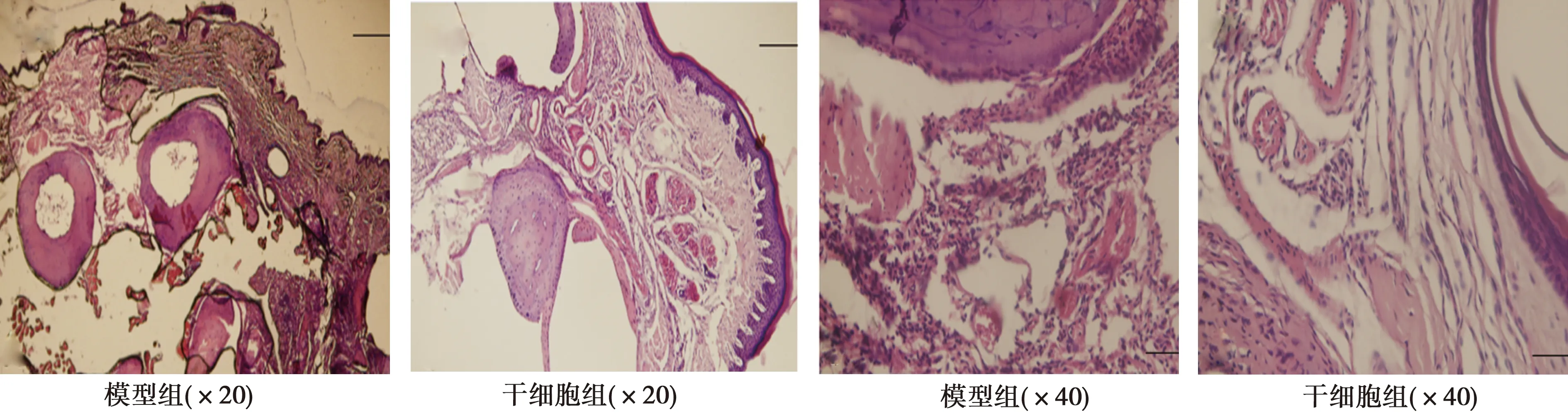
圖2 兩組關節病理情況(HE染色)
2.4兩組關節炎癥因子表達情況 干細胞組治療后關節組織中TNF-α、IL-1β、IL-6水平極顯著下降(P<0.001)。而IL-10的表達量則表現出相反的趨勢,干細胞組治療后其表達量極顯著升高(P<0.001)。干細胞組血清中TNF-α,IL-1β呈極顯著降低,IL-10呈極顯著增加(P<0.001),見表1。
表1 兩組炎癥因子表達情況
與模型組比較:1)P<0.001
3 討 論
采用雞膠原法誘導的小鼠關節炎模型能夠較好地模擬人類RA的臨床表現,是篩選和研究治療RA藥物的良好模型。多種炎癥因子參與RA疾病的發生及發展,TNF-α及其受體、IL發揮著不可忽視的作用〔14〕。IL-6是骨吸收的主要調節者,低濃度IL-6刺激破骨細胞形成,較高濃度則能刺激成熟的破骨細胞骨吸收功能。在RA發生過程中,成骨細胞在外界刺激下產生IL-6,IL-6與受體復合物及膜受體糖蛋白130結合,啟動下游多種轉錄因子,促進單核細胞融合,刺激多核破骨細胞的分化成熟,促進急性時相反應蛋白的表達與分泌,最終導致炎癥細胞過度增殖和自身免疫性損傷〔15,16〕。
ADSCs能直接或間接作用于T細胞、B細胞、樹突細胞、自然殺傷細胞、巨噬細胞等免疫細胞,從而抑制IL-1β,TNF-α,干擾素(IFN)-γ,IL-6等炎癥因子的表達,誘導IL-10等抗炎因子的產生〔17〕。
本研究ADSCs顯著抑制了RA小鼠關節局部TNF-α、IL-1β、IL-6的轉錄水平,同時顯著提高了IL-10的轉錄水平與表達。證明ADSCs對RA小鼠具有良好的治療作用,其作用機制及靶點值得進一步研究。

