蛋氨酸特異性合成途徑關(guān)鍵酶
——高絲氨酸O-酰基轉(zhuǎn)移酶的研究進(jìn)展
劉詩(shī)夢(mèng),韓彩靜,高云娜,趙 蘭,盧紅妍,閔偉紅*
(吉林農(nóng)業(yè)大學(xué)食品科學(xué)與工程學(xué)院,小麥和玉米深加工國(guó)家工程實(shí)驗(yàn)室,吉林 長(zhǎng)春 130118)
高絲氨酸O-酰基轉(zhuǎn)移酶屬于α/β水解酶超家族,通過(guò)催化底物高絲氨酸發(fā)生酰基化得到產(chǎn)物酰基高絲氨酸,激活蛋氨酸特異性合成途徑,是蛋氨酸合成過(guò)程中的關(guān)鍵酶。該酶不但與高絲氨酸激酶共同競(jìng)爭(zhēng)底物高絲氨酸,決定高絲氨酸在蛋氨酸合成途徑的利用率,而且直接硫化和轉(zhuǎn)硫途徑都需經(jīng)過(guò)該酶催化才能進(jìn)行,可見(jiàn)高絲氨酸O-酰基轉(zhuǎn)移酶在蛋氨酸合成途徑中十分重要。
蛋氨酸作為人和動(dòng)物體內(nèi)唯一含硫必需氨基酸,在食品、醫(yī)藥及飼料行業(yè)中應(yīng)用廣泛。目前用于生產(chǎn)蛋氨酸的化學(xué)合成法[1]存在環(huán)境污染、產(chǎn)物為DL型混合物分離困難等問(wèn)題,迫使學(xué)者和生產(chǎn)企業(yè)急需尋找環(huán)境友好的微生物發(fā)酵法[2]替代化學(xué)合成法。已有多位學(xué)者對(duì)微生物體內(nèi)蛋氨酸的合成代謝網(wǎng)絡(luò)進(jìn)行研究[3-5],均取得一定成果,為提高蛋氨酸產(chǎn)量積累了經(jīng)驗(yàn)。但由于蛋氨酸合成途徑代謝調(diào)控復(fù)雜,現(xiàn)有的改造策略僅能在實(shí)驗(yàn)室水平小幅度提高蛋氨酸產(chǎn)量,不能達(dá)到工業(yè)生產(chǎn)要求;因此,如何構(gòu)建高產(chǎn)蛋氨酸工程菌成為發(fā)酵法產(chǎn)蛋氨酸亟待解決的難題和瓶頸,引起了各國(guó)學(xué)者的廣泛關(guān)注[6-8]。
蛋氨酸的合成途徑在大腸桿菌(Escherichia coli)和谷氨酸棒桿菌(Corynebacterium glutamicum)中已被闡明[9](圖1)。作為蛋氨酸特異性合成途徑的第一個(gè)酶,高絲氨酸O-酰基轉(zhuǎn)移酶對(duì)高絲氨酸的米氏常數(shù)Km為2.8 mmol/L[10],與底物高絲氨酸的結(jié)合能力較弱,酶活力和酶量受終產(chǎn)物(甲硫氨酸和S-腺苷甲硫氨酸)[11]的反饋抑制和阻遏,且極不耐熱,在30 ℃下半衰期大約只有40 min[12],超過(guò)32 ℃后極易失活[12-14]。致使高絲氨酸主要被蘇氨酸合成途徑消耗,較少作為蛋氨酸合成的中間代謝物。在解除了蛋氨酸合成途徑兩個(gè)限速酶(天冬氨酸激酶和高絲氨酸脫氫酶)的反饋抑制后[15-16],位于二者之后的高絲氨酸O-酰基轉(zhuǎn)移酶作為下一個(gè)影響蛋氨酸積累的關(guān)鍵因素,決定了碳通量用于合成蛋氨酸的程度。因此,解除高絲氨酸O-酰基轉(zhuǎn)移酶受到的調(diào)控,提高酶對(duì)底物親和力和高溫下的熱穩(wěn)定性,對(duì)于蛋氨酸的合成至關(guān)重要。

圖1 細(xì)菌中蛋氨酸合成途徑[9]Fig. 1 Biosynthesis pathway of methionine in bacteria[9]
由此,本文對(duì)高絲氨酸O-酰基轉(zhuǎn)移酶的結(jié)構(gòu)、反應(yīng)機(jī)理和現(xiàn)有的分子改造策略進(jìn)行總結(jié),并探討了通過(guò)改造該酶獲得穩(wěn)定性強(qiáng)且催化效率高的突變體來(lái)提高蛋氨酸產(chǎn)量的可能性。
1 高絲氨酸O-酰基轉(zhuǎn)移酶在蛋氨酸合成途徑中的作用
高絲氨酸O-酰基轉(zhuǎn)移酶將乙酰-輔酶A(coenzyme A,CoA)或琥珀酰-CoA的酰基轉(zhuǎn)移到高絲氨酸的羥基氧上,使高絲氨酸酰基化,為下一步硫化做準(zhǔn)備。該酶存在底物特異性,根據(jù)酰基供體不同,可分為高絲氨酸乙酰基轉(zhuǎn)移酶(homoserine acyltransferase,HTA)和高絲氨酸琥珀酰基轉(zhuǎn)移酶(homoserine succinyltransferase,HTS)。多數(shù)真菌及少數(shù)細(xì)菌(如C. glutamicum)使用HTA進(jìn)行催化,大多數(shù)細(xì)菌(如E. coli)則使用HTS進(jìn)行催化。二者之間無(wú)序列相似性,但都遵循乒乓反應(yīng)的酶化學(xué)機(jī)理[17],催化相似的酰基化反應(yīng)。
HTA以乙酰-CoA為酰基供體,乙酰基首先轉(zhuǎn)移到此酶催化三聯(lián)體[18]的親核殘基上,再轉(zhuǎn)移到高絲氨酸的γ-羥基,生產(chǎn)乙酰高絲氨酸(圖2)。
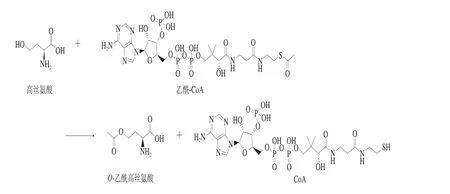
圖2 HTA催化過(guò)程Fig. 2 Catalytic process of homoserine acetyltransferase
HTS以琥珀酰-CoA為酰基供體,將琥珀酰-CoA的琥珀酰基基團(tuán)首先轉(zhuǎn)移到親核殘基,隨后轉(zhuǎn)移到高絲氨酸形成產(chǎn)物琥珀酰高絲氨酸(圖3)。
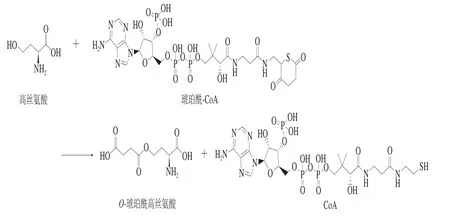
圖3 HTS催化過(guò)程Fig. 3 Catalytic process of homoserine succinyltransferase
2 高絲氨酸O-酰基轉(zhuǎn)移酶的結(jié)構(gòu)及催化機(jī)理
部分高絲氨酸O-酰基轉(zhuǎn)移酶的晶體結(jié)構(gòu)[19-21]已公布在蛋白質(zhì)數(shù)據(jù)庫(kù)(Protein Data Bank,PDB)上(圖4),從蛋白折疊類型上看,該酶屬于α/β水解酶超家族,特點(diǎn)是核心由圍繞著α-螺旋的平行β-折疊片層組成,活性位點(diǎn)由高度保守的“催化三聯(lián)體”殘基組成。催化三聯(lián)體包括酸性、堿性和親核殘基,3 個(gè)殘基同時(shí)作用攻擊底物形成不穩(wěn)定的共價(jià)中間復(fù)合物,降低反應(yīng)活化能從而提高反應(yīng)效率。
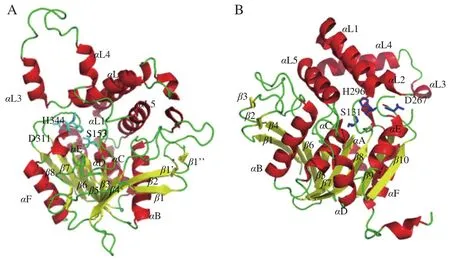
圖4 鉤端螺旋體中HTA結(jié)構(gòu)(A)[19]和金黃色葡萄球菌中HTA結(jié)構(gòu)(B)[21]Fig. 4 Structure of homoserine acetyltransferase in Leptospira interrogans (A)[19] and structure of homoserine acetyltransferase in Staphylococcus aureus (B)[21]
Wang Mingzhu等[19]研究了鉤端螺旋體(Leptospira interrogans)中的HTA(PDB∶2PL5)的結(jié)構(gòu),由10 個(gè)α-螺旋和10 個(gè)β-折疊組成,分為兩個(gè)獨(dú)立的結(jié)構(gòu)域,包括1 個(gè)含有催化三聯(lián)體的核心α/β結(jié)構(gòu)域和1 個(gè)由5 個(gè)α-螺旋組成的Lid結(jié)構(gòu)域(圖5)。其催化三聯(lián)體由S153(親核殘基絲氨酸)、D311(酸性殘基天冬氨酸)和H344(堿性殘基組氨酸)組成(圖6)。H344奪取S153的1 個(gè)氫原子,激活S153的親核試劑活性,使其進(jìn)攻乙酰-CoA的羰基碳,形成四面體過(guò)渡態(tài)。同時(shí)H344構(gòu)象發(fā)生變化,使底物高絲氨酸進(jìn)入,四面體過(guò)渡態(tài)解離,產(chǎn)生乙酰-HTA中間產(chǎn)物并釋放CoA,去質(zhì)子化的高絲氨酸作為親核試劑進(jìn)攻乙酰-HTA,再次形成四面體過(guò)渡態(tài),隨后H344構(gòu)象變化,釋放產(chǎn)物酰基高絲氨酸。
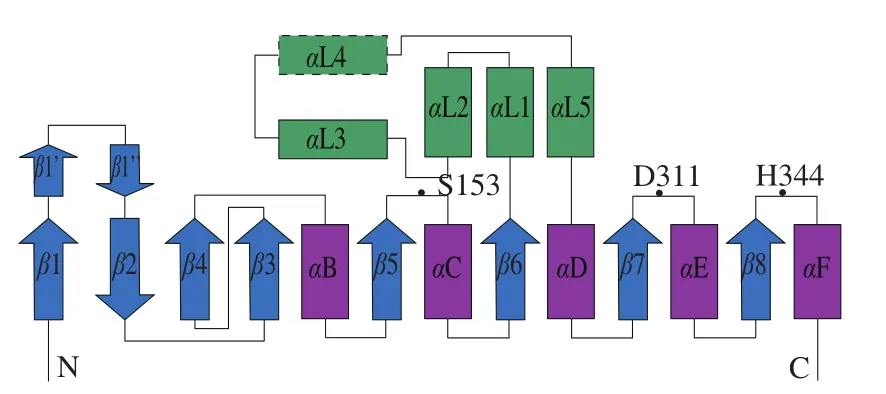
圖5 高絲氨酸乙酰轉(zhuǎn)移酶二級(jí)結(jié)構(gòu)[19]Fig. 5 Secondary structure of homoserine transacetylase[19]
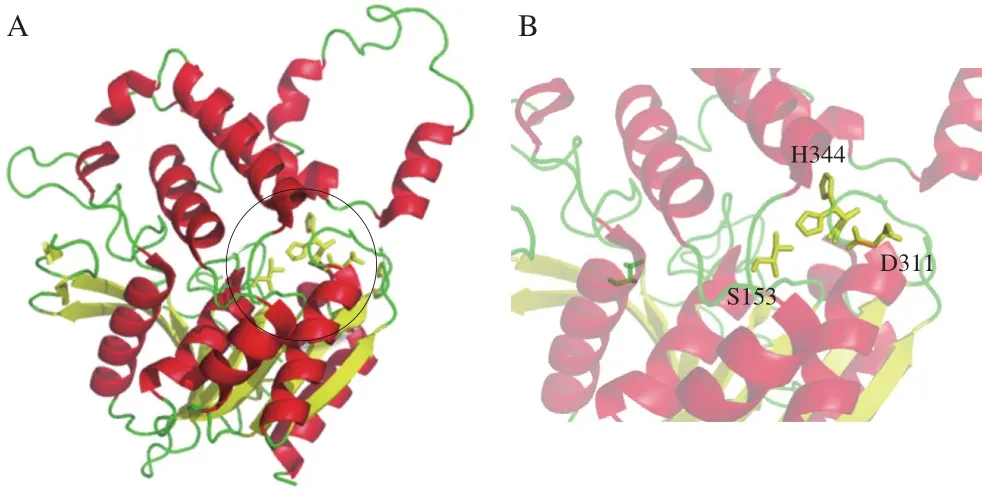
圖6 Leptospira interrogans中HTA催化三聯(lián)體位置(A)和HTA催化三聯(lián)體(B)[19]Fig. 6 Position of the catalytic triad of homoserine acetyltransferase (A)and the catalytic triplet of homoserine acetyltransferase (B) in Leptospira interrogans[19]
E. coli中HTS的編碼基因?yàn)閙etA,Rosen等[22]通過(guò)質(zhì)譜鑒定其活性位點(diǎn),發(fā)現(xiàn)琥珀酰基與D47共價(jià)結(jié)合,推測(cè)D47是催化反應(yīng)的親核殘基。但Coe等[23]通過(guò)定點(diǎn)突變得出不同結(jié)論,認(rèn)為HTS的催化三聯(lián)體由親核殘基半胱氨酸(C142)、堿性殘基組氨酸(H235)和酸性殘基谷氨酸(E237)組成,D47作為穩(wěn)定琥珀酰基的關(guān)鍵殘基存在。2008年,周奕含等[24]利用同源模建的方法,以蠟狀芽孢桿菌(Bacillus cereus)HTS為模板,建立了E. coli中HTS三維結(jié)構(gòu),通過(guò)分子對(duì)接從結(jié)構(gòu)上佐證了C142為親核進(jìn)攻的殘基,并根據(jù)氫鍵及分子間非鍵作用推斷出穩(wěn)定琥珀酰-CoA和影響催化效率的14 個(gè)氨基酸殘基。
對(duì)高絲氨酸O-酰基轉(zhuǎn)移酶的分子改造,需要建立在了解其結(jié)構(gòu)和催化機(jī)制的基礎(chǔ)上,選擇底物高絲氨酸的結(jié)合位點(diǎn)和催化三聯(lián)體所處活性口袋附近的氨基酸殘基進(jìn)行突變,達(dá)到降低高絲氨酸Km、提高酶對(duì)底物親和力的目的,最終提高酶的催化效率。
3 高絲氨酸O-酰基轉(zhuǎn)移酶的分子改造策略
針對(duì)高絲氨酸O-酰基轉(zhuǎn)移酶受到的末端產(chǎn)物反饋抑制和高溫下易聚集失活的性質(zhì),研究人員通過(guò)隨機(jī)誘變或定點(diǎn)突變技術(shù)來(lái)解除該酶所受的反饋抑制和提高其熱穩(wěn)定性;或敲除阻遏蛋白來(lái)解除反饋?zhàn)瓒簦岣咂湓诘鞍彼岷铣赏分械拿富钚裕ū?)。
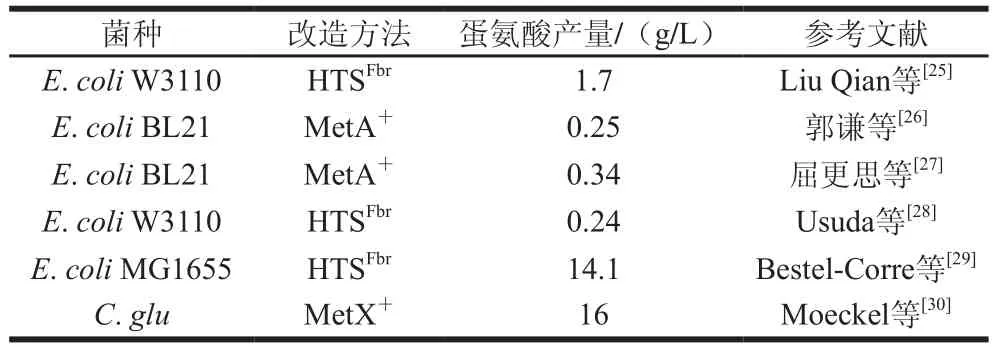
表1 高絲氨酸O-酰基轉(zhuǎn)移酶分子改造策略Table 1 Molecular modification strategies for homoserine O-acyltransferase
3.1 解除反饋調(diào)控的分子改造策略
反饋?zhàn)瓒羰俏⑸锖铣傻鞍彼徇^(guò)程中經(jīng)濟(jì)的調(diào)控方式,通過(guò)調(diào)節(jié)代謝途徑中酶的合成阻止代謝產(chǎn)物過(guò)量積累。解除高絲氨酸O-酰基轉(zhuǎn)移酶受到的反饋?zhàn)瓒糁饕ㄟ^(guò)敲除阻遏蛋白實(shí)現(xiàn)。在E. coli中,阻遏蛋白MetJ涉及蛋氨酸合成及轉(zhuǎn)運(yùn)基因的轉(zhuǎn)錄水平調(diào)節(jié),以二聚體形式結(jié)合到被稱為“met-box”的回文保守序列上[31],這段序列長(zhǎng)8 bp,存在于蛋氨酸特異性合成途徑和吸收系統(tǒng)中基因的啟動(dòng)子區(qū)域[32](圖7)。S-腺苷蛋氨酸是MetJ的輔阻遏物,與MetJ結(jié)合后可提高該阻遏蛋白對(duì)“met-box”的親和力。谷氨酸棒桿菌中的McbR是TetR型阻遏蛋白[33],由mcbR基因編碼,抑制蛋氨酸合成和硫代謝途徑中大部分基因的表達(dá)。2015年,Qin Tianyu等[4]敲除C. glutamicum的阻遏蛋白McbR后,HTA的編碼基因metX的轉(zhuǎn)錄水平上調(diào)。同樣,Han Guoqiang等[34]在C. glutamicum中敲除McbR,解除了HTA及幾乎所有蛋氨酸特異性合成途徑中的酶受到的反饋?zhàn)瓒簟5瞵揫5]在經(jīng)誘變的C. glutamicum中敲除McbR后,發(fā)現(xiàn)蛋氨酸合成途徑中的8 個(gè)酶轉(zhuǎn)錄水平無(wú)明顯變化,且蛋氨酸產(chǎn)量下降。由于McbR作為全局調(diào)控因子,不只是對(duì)蛋氨酸合成有調(diào)控作用,還參與硫代謝的調(diào)控,敲除后會(huì)引起胞內(nèi)氧化應(yīng)激反應(yīng),強(qiáng)烈改變還原型煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)的代謝,在蛋氨酸合成途徑中降低NADPH利用率,并影響細(xì)胞生長(zhǎng)[35]。僅通過(guò)敲除阻遏蛋白雖然能夠提高高絲氨酸O-酰基轉(zhuǎn)移酶的轉(zhuǎn)錄水平,但從菌體生長(zhǎng)上看,這種方法會(huì)導(dǎo)致細(xì)胞代謝失衡,存在一定隱患。如何解決阻遏蛋白敲除后引起的代謝紊亂問(wèn)題,可以作為解除高絲氨酸O-酰基轉(zhuǎn)移酶的反饋?zhàn)瓒舻囊粋€(gè)研究方向。
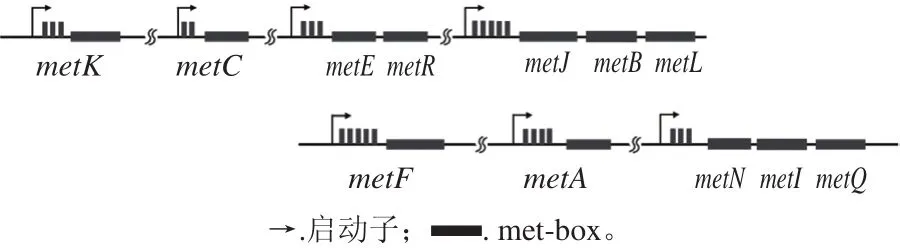
圖7 MetJ與蛋氨酸合成途徑及吸收途徑基因結(jié)合位點(diǎn)[32]Fig. 7 MetJ binding sites for the methionine synthesis pathway and the uptake pathway[32]
反饋抑制是蛋氨酸合成過(guò)程中基本且快速的調(diào)節(jié)方式,避免代謝物過(guò)量積累影響代謝平衡。E. coli是工業(yè)生產(chǎn)的模式菌株,E. coli中HTS受蛋氨酸和S-腺苷蛋氨酸(S-adenosyl methionine,SAM)的協(xié)調(diào)反饋抑制,1 mmol/L蛋氨酸或1 mmol/L S-腺苷蛋氨酸濃度條件下,HTS活力僅為4%或13%[28]。2005年,Usuda等[28]將E. coli W3110中HTS的R27、I296和P298分別替換為Cys、Ser和Leu,部分解除了蛋氨酸和S-腺苷蛋氨酸的反饋抑制作用,在濃度為100 mmol/L的蛋氨酸或1 mmol/L的S-腺苷蛋氨酸條件下相對(duì)酶活力可保持在80%以上,雖然減弱了HTS受到的反饋抑制,但突變后酶活力比野生型HTS更低,仍需進(jìn)一步研究在保證酶活力的基礎(chǔ)上解除反饋抑制(表2)。即便HTS突變后酶活力降低,Usuda等[28]的研究仍為隨后改造蛋氨酸合成途徑的研究提供參考,Liu Qian等[25]在E. coli中過(guò)量表達(dá)該解除反饋抑制的HTS(R27C、I296S、P298L)并敲除MetJ和過(guò)表達(dá)運(yùn)輸?shù)鞍譟jeH,使蛋氨酸產(chǎn)量達(dá)到1.7 g/L。2015年,段昭煒[36]經(jīng)定點(diǎn)突變后篩選出抗反饋抑制的突變體(Y299C),在1 mmol/L蛋氨酸或1 mmol/L S-腺苷蛋氨酸存在的情況下酶活力分別為86.3%及79.6%。此后關(guān)于該酶反饋抑制解除的研究鮮有報(bào)道,但可以看出HTS所受的反饋抑制沒(méi)有完全解除。相比于解除反饋?zhàn)瓒魜?lái)提高酶表達(dá)量,通過(guò)解除反饋抑制提高酶活力的方法更省時(shí),能耗更少,能更加有效地催化高絲氨酸。因此仍需更進(jìn)一步對(duì)酶的抑制劑結(jié)合位點(diǎn)進(jìn)行研究,提高該酶在抑制劑存在情況下的活力。
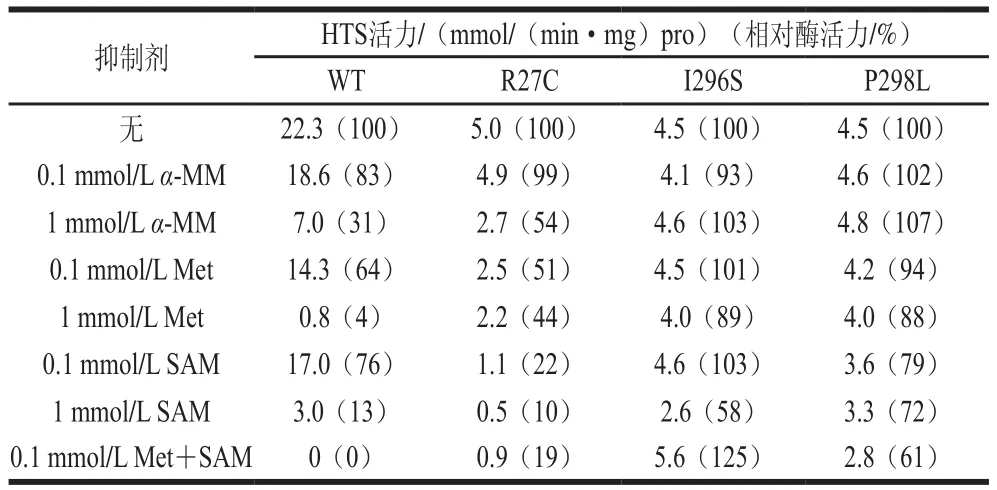
表2 抑制劑對(duì)HTS突變體的影響[28]Table 2 Effects of inhibitors on HTS mutants[28]
3.2 提高熱穩(wěn)定性的分子改造策略
Ron[37]和Gur[38]等于1971年開(kāi)始研究HTS與E. coli生長(zhǎng)速率之間的關(guān)系,其認(rèn)為高溫下HTS活力降低導(dǎo)致E. coli生長(zhǎng)緩慢。但關(guān)于如何提高高絲氨酸O-酰基轉(zhuǎn)移酶熱穩(wěn)定性的研究較少,Mordukhova等[39]在2008年使用對(duì)metA隨機(jī)誘變來(lái)改善高溫下的E. coli生長(zhǎng)情況,確定了I229T和N267D的突變使得E. coli菌株能夠在更高溫度下生長(zhǎng)并增加菌株耐受酸性條件的能力。在此基礎(chǔ)上,Mordukhova等[40]于2013年首先通過(guò)多重序列比對(duì)的方法鑒定出E. coli中HTS不同于嗜熱HTS的8 個(gè)氨基酸位點(diǎn),并分別突變得到突變體Q96K、L110V、I124L、R160L、A195T、A200E、D218G和F247Y,經(jīng)驗(yàn)證Q96K、I124L、F247Y 3 個(gè)突變體能夠改善升溫時(shí)E. coli的生長(zhǎng)。隨后使用I-Mutant 2.0建模工具進(jìn)行蛋白質(zhì)穩(wěn)定性預(yù)測(cè),推測(cè)并證實(shí)I229Y突變可以提高HTS的穩(wěn)定性,并提高E. coli在44 ℃下的生長(zhǎng)速率。最后同時(shí)對(duì)HTS進(jìn)行雙突變及三重突變,構(gòu)建了攜帶雙突變(I124L-I229Y)和三重突變(I124L-I229Y-N267D)的E. coli突變株,發(fā)現(xiàn)二者生長(zhǎng)速度均快于單突變株。
高絲氨酸O-酰基轉(zhuǎn)移酶高溫下易失活限制了其合成蛋氨酸的作用,為了解決這一問(wèn)題,需要對(duì)該酶進(jìn)行分子改造提高熱穩(wěn)定性。使用生物信息學(xué)方法借助蛋白質(zhì)數(shù)據(jù)庫(kù)并通過(guò)計(jì)算機(jī)模擬等手段分析酶的結(jié)構(gòu)-功能關(guān)系,識(shí)別并篩選該酶穩(wěn)定性差的關(guān)鍵位點(diǎn),分析理化性質(zhì)后應(yīng)用分子生物學(xué)技術(shù)如定點(diǎn)突變[41],在適當(dāng)位置引入二硫鍵[42]或糖基化位點(diǎn)[43-44]以及截去酶結(jié)構(gòu)中柔性較大的氨基酸序列[45]來(lái)提高該酶熱穩(wěn)定性。以上策略在其他熱不穩(wěn)定性酶中已獲得較成功的嘗試。劉曉萌等[46]應(yīng)用B-FITTER軟件分析了細(xì)胞色素單加氧酶晶體結(jié)構(gòu)中的溫度因子(B-factor),識(shí)別出一個(gè)不利于酶熱穩(wěn)定性的關(guān)鍵殘基位點(diǎn)G46,對(duì)該位點(diǎn)進(jìn)行定點(diǎn)飽和突變,篩選獲得一個(gè)突變體的半失活溫度比野生型高5 ℃,半衰期延長(zhǎng)一倍。Yin Xin等[47]通過(guò)MODIP和DbD兩種計(jì)算工具預(yù)測(cè)蛋白質(zhì)中可能的二硫鍵,經(jīng)分子動(dòng)力學(xué)模擬確定了A型阿魏酸酯酶的兩個(gè)氨基酸位點(diǎn)A126-N152,將其突變?yōu)榘腚装彼嵋攵蜴I后最適溫度提高6 ℃,在55 ℃和60 ℃下的半衰期分別為188 min和40 min,熱穩(wěn)定性提高10 倍且催化效率與野生型相近(圖8)。王小艷等[48]在β-葡萄糖醛酸苷酶模擬結(jié)構(gòu)分析的基礎(chǔ)上,半理性方法設(shè)計(jì)并通過(guò)定點(diǎn)突變引入N-糖基化位點(diǎn)得到3 株突變菌,其中兩株熱穩(wěn)定性得到改善,相比野生型分別提高13%和11%。
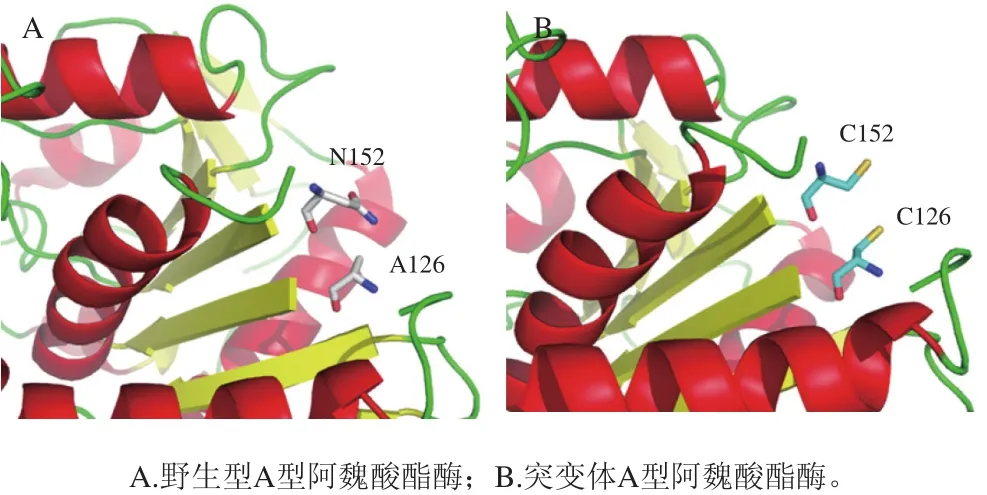
圖8 A型阿魏酸酯酶126和152位點(diǎn)突變前后示意圖[47]Fig. 8 Schematic diagram of type A feruloyl esterase before and after 126 and 152 mutations[47]
在實(shí)際生產(chǎn)中,發(fā)酵溫度是需要考慮的重點(diǎn)因素。伴隨著發(fā)酵產(chǎn)熱,發(fā)酵液溫度上升,高絲氨酸O-酰基轉(zhuǎn)移酶失活會(huì)影響蛋氨酸合成中碳流的利用,導(dǎo)致高絲氨酸積累,對(duì)細(xì)胞產(chǎn)生毒性或高絲氨酸被蘇氨酸合成途徑消耗,不能用于合成蛋氨酸。因此,增強(qiáng)高絲氨酸O-酰基轉(zhuǎn)移酶熱穩(wěn)定性是改造該酶的重要方向。
4 結(jié) 語(yǔ)
蛋氨酸合成途徑涉及多個(gè)酶的共同作用,僅改變途徑中單個(gè)酶無(wú)法達(dá)到理想產(chǎn)量,但酶作為調(diào)節(jié)細(xì)胞代謝的基本元件需要擁有良好的酶學(xué)性質(zhì)。針對(duì)高絲氨酸O-酰基轉(zhuǎn)移酶熱穩(wěn)定性差的性質(zhì),結(jié)合生物信息學(xué)分析方法,采用突變或敲除該酶熱穩(wěn)定性差的殘基或結(jié)構(gòu),獲得熱穩(wěn)定性高的酶分子。在此基礎(chǔ)上,通過(guò)突變?cè)撁傅囊种苿┙Y(jié)合位點(diǎn)和底物結(jié)合位點(diǎn)以解除反饋抑制,提高酶對(duì)底物的敏感性,從而提高酶的催化效率,進(jìn)一步調(diào)節(jié)該酶的酶活力和酶量,可以作為研究改造高絲氨酸O-酰基轉(zhuǎn)移酶的嘗試方向。
此外,國(guó)內(nèi)外多個(gè)實(shí)驗(yàn)室建立了可用于E. coli和C. glutamicum的CRISPR/Cas基因組編輯系統(tǒng),實(shí)現(xiàn)了在微生物染色體上進(jìn)行基因的敲除、敲入和突變[49-53]。應(yīng)用CRISPR/Cas技術(shù)直接對(duì)微生物基因組上的高絲氨酸O-酰基轉(zhuǎn)移酶進(jìn)行堿基的替換及部分結(jié)構(gòu)截除,或?qū)⒏脑旌蟮拿盖萌胫两?jīng)多點(diǎn)修飾且優(yōu)化代謝網(wǎng)絡(luò)的微生物染色體中,可以避免外源質(zhì)粒的添加,防止外源質(zhì)粒丟失引起菌種性能退化的同時(shí)又減少菌體代謝負(fù)擔(dān),對(duì)構(gòu)建用于大規(guī)模發(fā)酵的高產(chǎn)蛋氨酸工程菌具有重要價(jià)值。

