淺談基于化學核心素養的教學設計思路
——以《Fe2+與Fe3+的轉化》為例
隨著新課程改革的逐步推進,課堂教學模式也逐步由舊的填鴨式、一味地講授式向多形式的教學模式轉化,學生由被動接受知識向主動探究學習進步。本文基于化學核心素養,以《Fe2+與Fe3+的轉化》為例,談談教學設計的思路。
一、對常規教學設計的反思
1.常規教學設計的不足
《Fe2+與Fe3+的轉化》 是以Fe2+與Fe3+之間的轉化為主,兼帶鐵及其化合物性質的一節歸納總結課。對這節課,傳統的教法是教師通過以前的知識積累,直接教授哪些物質可以實現二者之間的轉化,輔以一些典型的實驗幫助學生加深印象,再補充一些新的例子,拓展學生的視野,最后通過書寫一些化學方程式來鞏固所學知識。學生是被動接受,很多同學上課學會了這幾個化學方程式的書寫,過段時間就忘了,或稍微變形卻又傻眼了,對于新情境下的化學方程式書寫,仍然不知所措。
2.需要解決的問題
面對新一輪教學改革,以及勢在必行地對學生化學核心素養培養的背景下,如何讓學生提升關于知識、技能、情感、態度、價值觀等多方面要求的綜合能力,在傳統教學中都不能得到很好地解決。筆者認為應從如下幾個方面入手:
(1)激發學生的學習興趣,讓學生從被動接受化學方程式到主動探究物質變化的轉化。
(2)將已學過的知識主動熟練應用于解決新知識的問題中。
(3)將宏觀物質之間的轉化關系,用微觀的化學微粒間的變化來解釋。
(4)將所學知識與實際應用聯系起來。
二、基于化學核心素養《Fe2+與Fe3+的轉化》的教學設計的思考
1.理論思考
以“全面發展的人”為目標的核心素養,包括文化基礎、自主發展、社會參與這三大層面及人文底蘊、科學精神、學會學習、健康生活、責任擔當、實踐創新這六大素養。化學核心素養包含五個維度:①宏觀辨識與微觀探析,②變化觀念與平衡思想,③證據推理與模型認知,④科學探究與創新意識,⑤科學精神與社會責任。“有人說,什么是素質?”當你把在學校學的知識都忘掉的時候,剩下的就是素質。今天孩子在課堂里學化學,不是讓他成為化學家,我們關注的是,畢業以后,作為一個公民,學過化學和沒學過化學有什么差異?化學能留給他終身受用的東西是什么?這就是核心素養。因此,在本教學設計上,應該考慮更多的是,學生真正能夠收獲什么。
鑒于《Fe2+與Fe3+的轉化》是在學生掌握鐵的氧化物的基本性質、Fe2+和Fe3+的檢驗的基礎上,利用已學的氧化還原反應、離子反應的基礎知識,來進一步學習Fe2+和Fe3+的轉化,深入思考如何解決之前的一系列問題。
2.原因探析與方案構想
(1)創設情境,激發學生的求知欲。原有教學模式下,先以回顧Fe2+和Fe3+的轉化規律作為本節課的開場白,難以激發學生的興趣。與Fe2+和Fe3+的轉化相關的生活情境有很多,如印刷電路板的制作、補血劑的作用、切開的蘋果久置會變黃、利用維生素C去除布料上粘有藍黑墨水污漬等。基于這些生活中的情景素材,創新設計魔術實驗“‘茶水’變‘墨水’”,則讓學生耳目一新,頓生興趣與求知欲。其原理是:茶水中含有大量的鞣酸,遇到FeSO4中的Fe2+立即生成鞣酸亞鐵,鞣酸亞鐵性質不穩定,易被氧化成鞣酸鐵的絡合物,呈藍黑色。加入維生素C后,Fe3+被還原成Fe2+,溶液又恢復茶水的顏色。由此說明Fe2+和Fe3+之間是可以轉化的。
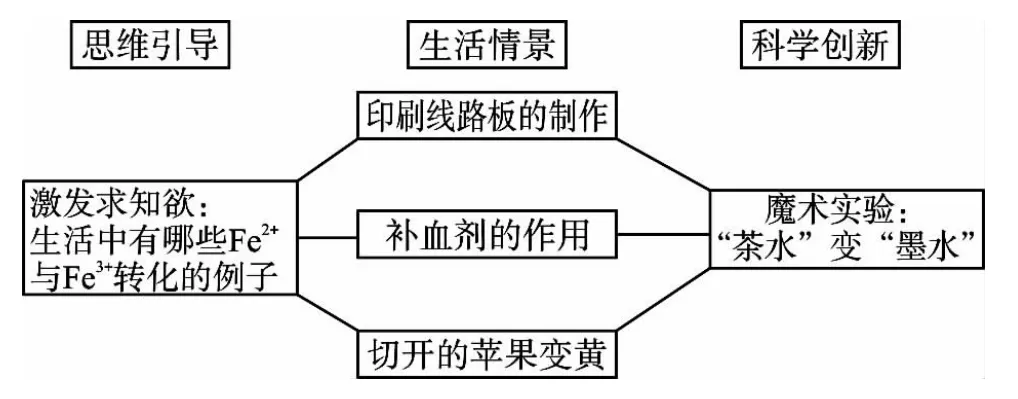
突出“科學探究與創新意識”的設計思路
(2)以氧化還原反應知識儲備解決學習中的新問題。引導學生用氧化還原反應原理的模型認知,從化合價的角度分析,Fe3+向Fe2+轉化,需要加入的試劑是還原劑;Fe2+向Fe3+轉化,需要加入的試劑是氧化劑。學生很自然地就會往下思考:符合條件的還原劑及氧化劑究竟有哪些呢?列舉出的還原劑與Fe3+反應確實可以發生嗎?如何去證明呢?在氧化劑與Fe2+反應中存在同樣的疑問。為了便于觀察,老師建議選擇現象變化明顯的實驗進行驗證。在Fe3+向 Fe2+轉化, 加入的還原劑可以是 Cu、Fe、KI、SO2等。選擇用I-與Fe3+反應,同時又出現了新的問題:如何驗證氧化產物及還原產物。借以鞏固前面所學Fe3+及Fe2+的檢驗。選取先將無色的KI溶液加入到淺黃色的FeCl3溶液中,溶液變成黃褐色。將此溶液分成兩份,分別加入淀粉溶液、鐵氰化鉀溶液。前者得到藍色溶液,說明反應后有I2生成,后者得到藍色沉淀,說明反應后有Fe2+生成。從而實現了Fe3+向Fe2+轉化。實現Fe2+向Fe3+轉化,加入的氧化劑可以是 Cl2、H2O2溶液、酸性 KMnO4溶液、HNO3溶液等。現以選擇酸性KMnO4溶液為例,實驗過程中將FeSO4溶液滴加到酸性KMnO4溶液中,溶液的紫紅色褪去。已知在酸性溶液中,MnO-4被還原成Mn2+,驗證氧化產物同樣是利用已學知識。如何設計實驗中還有沒有其他微粒參加反應,為下一步探究預設伏筆。
(3)從宏觀現象的變化到微觀本質的分析深入學習新知識。通過學習并掌握這種分析方法,尋求陌生環境下氧化還原反應方程式的書寫技巧,有助于繼續深入學習氧化還原反應知識。為能更加直觀地研究反應本質,采用了手持技術,即pH傳感器測定反應前后H+的濃度變化,以確定H+是否參加反應。實驗前需要控制實驗條件:酸性KMnO4溶液和FeSO4溶液的pH相同,避免因溶液混合引起的pH變化。實驗開始時,將pH傳感器浸泡在酸性KMnO4溶液中,連接好電腦、數據采集器、pH傳感器,設置好需要采集的數據及圖像的橫縱坐標參數,再逐滴滴加FeSO4溶液至溶液紅色褪去,同時引導學生觀察pH數據及圖像中pH的變化。通過實驗,我們會發現pH數據變大了,反映pH數據的線的走勢呈上升狀態。據此分析得出H+參與反應的結論,而且生成了H2O。確定好反應物及生成物之后,再利用已學的氧化還原反應中的得失電子守恒、電荷守恒、原子個數守恒,學生不難寫出反應的離子方程式與化學方程式。上述設計既是對前面所學知識的鞏固,又讓學生克服恐懼心理,提升了陌生情境下的化學方程式的書寫技能。
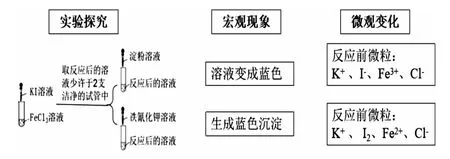
突出“變化觀念與平衡思想”的設計思路
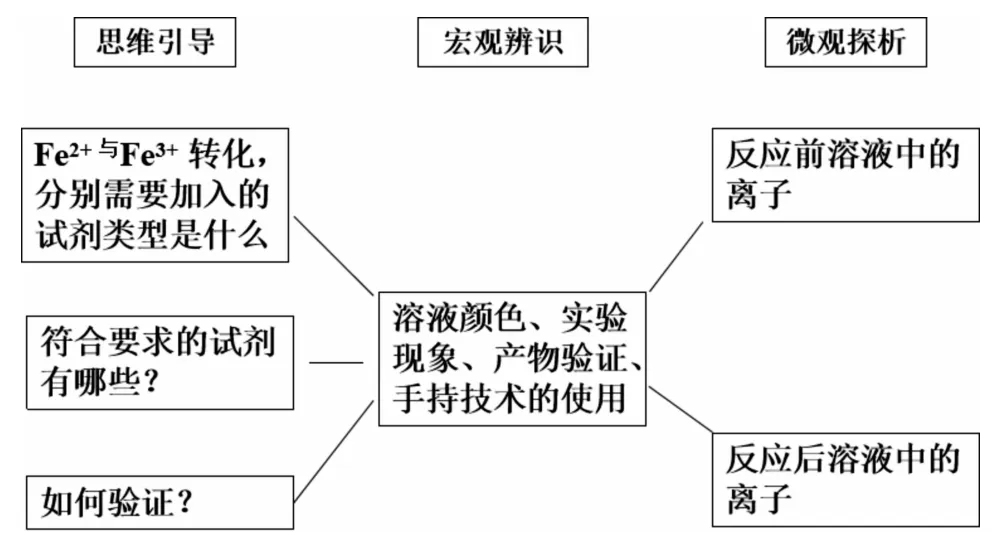
突出“宏觀辨識與微觀探析”的設計思路
(4)理論聯系實際、學以致用。學習完以上知識,學生便不難解釋生活情境:印刷電路板的制作、補血劑的作用、切開的蘋果久置會變黃等現象,知曉其實質就是Fe2+與Fe3+的轉化,呼應本節課開頭的情境,此外還可以解決一些實際問題。如在實驗室,FeSO4溶液需不需要特殊的保存方法?為什么?
三、對以上設計的評價
本教學設計,是在前一章氧化還原反應、離子反應的基本原理和規律之后的新課,將既抽象又有深度和難度的兩塊內容的學習貫穿整個高中,實現難度螺旋式上升,符合學生認知特點和規律,具有適切性。
本教學設計中的實驗探究,選取的都是現象非常明顯的案例,引導學生從宏觀現象的變化,探析微觀粒子變化的本質,體現了化學核心素養中“宏觀辨識與微觀探析”“科學探究與創新意識”“變化觀念與平衡思想”幾個維度,具有一定的深入性。
筆者認為以上兩個探究任務的方案構想,現象明顯、直觀,操作簡單,且可重復,具有一定的有效性。

