原子軌道雜化類型判斷的思維模式探析
山東
在凸顯核心素養觀念的命題指導下,使得化學試題更加注重對模型認知的構建能力、性質與結構之間相互推理能力的考查。由于中學階段的結構知識有限,使得對物質結構與性質模塊的知識考查難度不大,經常涉及中心原子的雜化及空間構型判斷問題上,因而教師在教學中除了注意知識深廣度及難度外,更應給學生滲透解答此類問題的認知模型與思維模型。
1.依據微粒的空間構型


雜化軌道類型雜化軌道空間構型鍵角sp直線形180°sp2平面三角形120°sp3正四面體109.5°

由此還可以擴展到以共價鍵形成的晶體或特殊結構單元。如金剛石中的碳原子、晶體硅和石英中的硅原子,都是以正四面體形式與周圍4個原子形成共價鍵的,故碳、硅原子采用sp3雜化;石墨的二維結構平面內,每個碳原子與其他三個碳原子結合形成平面六元環層,鍵角為120°,碳原子采用sp2雜化。
【例1】(1)(2018·全國卷Ⅱ·改編)固體三氧化硫中存在如圖(a)所示的三聚分子,該分子中S原子的雜化軌道類型為________。

圖(a)
(2)(2016·全國卷Ⅰ·改編)Ge單晶具有金剛石型結構,其中Ge原子的雜化方式為________,微粒之間存在的作用力是____________________。
【答案】(1)sp3(2)sp3共價鍵
【解析】(1)根據圖(a)可以得出固體三氧化硫中存在SO4原子團,為四面體構型,因此硫原子的雜化軌道類型為sp3。(2)Ge單晶具有金剛石型結構,故鍺原子與金剛石中的碳原子雜化方式相同,即為sp3,微粒之間存在的作用力是共價鍵。
2.運用價層電子對互斥理論


中心原子價電子對數價電子對幾何分布中心原子雜化軌道類型2直線形sp3平面三角形sp24正四面體sp3
中心原子的價電子對數計算有兩種方法:
第1種:價電子對數(n)=[中心原子(A)的價電子數+配位原子(B)提供的價電子數×m]÷2,當n出現奇數時則按照“四舍五入”處理。中心原子(A)為主族元素時,其價電子數=最外層電子數。配位原子(B)為鹵族、氫原子時則僅提供1個價電子。為氧族元素原子時則按不提供電子;在計算復雜離子價電子對數時,還應加上負離子的電荷數或減去正離子的電荷數。
第2種:價電子對數(n)=σ鍵數+中心原子上的孤電子對數。σ鍵數就是配位原子數m,孤電子對數=[中心原子的價電子數-m個配位原子(B)最多能接受的電子數]÷2。若B為氫時則接受電子數為1,若為其他原子時則接受電子數為(8-該原子的價電子數)。
注意:中心原子的價電子對構型與其對應的分子或復雜離子的空間構型不是同一個概念,價電子對構型中的軌道由成鍵電子對與孤對電子共同占有,而分子或復雜離子的空間構型則是所有成鍵原子之間構成的形狀,只有孤電子對數為0時,二者的構型才完全相同。
【例2】(1)(2018·全國卷Ⅰ·改編)LiAlH4是有機合成中常用的還原劑,LiAlH4中的陰離子空間構型是________、中心原子的雜化形式為______________。
(2)(2018·全國卷Ⅱ·改編)根據價層電子對互斥理論,H2S、SO2、SO3的氣態分子中,中心原子價層電子對數不同于其他分子的是________________。氣態三氧化硫以單分子形式存在,其分子的立體構型為________。
(3)(2018·全國卷Ⅲ·改編)《中華本草》等中醫典籍中,記載了爐甘石(ZnCO3)入藥,可用于治療皮膚炎癥或表面創傷。ZnCO3中,陰離子空間構型為________,C原子的雜化形式為________。

【答案】(1)正四面體 sp3(2)H2S 平面三角形 (3)平面三角形 sp3(4)V形 sp3

3.根據中心原子成鍵類型

【例3】(1)(2017·全國卷Ⅱ·改編)經X射線衍射測得化合物R的晶體結構,其局部結構如圖(b)所示。從結構角度分析,R中兩種陽離子的相同之處為________,不同之處為________。(填標號)

圖(b)
A.中心原子的雜化軌道類型
B.中心原子的價層電子對數
C.立體結構
D.共價鍵類型
(2)(2017·全國卷Ⅲ·改編)CO2和CH3OH分子中C原子的雜化形式分別為________和________。
(3)(2016·全國卷Ⅱ·改編)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液。①[Ni(NH3)6]SO4中陰離子的立體構型是________。②氨是________(填“極性”或“非極性”)分子,中心原子的軌道雜化類型為________。


4.根據等電子原理

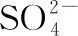
【例4】(1)(2015·全國卷Ⅰ·改編)CS2分子中,C原子的雜化軌道類型是________,寫出兩個與CS2具有相同空間構型和鍵合形式的分子或離子:________。
(2)科學家常用等電子體來預測不同物質的結構。據此原理,請你在表中①②③處填寫相應的化學式及其中心原子的雜化軌道類型。

N2O②CO2-3④①N2H2+6③PH+4



