把握考向,突破考點——氮氣及其含氮化合物考查類型賞析
安徽
從歷年的試題分析來看,氮及其化合物是元素化合物中的高頻考點,高考中絕大部分地區試題都是以選擇題、化學工藝流程題、實驗制備題、化學反應原理綜合題等形式加以出現,考查學生對基礎知識的掌握情況和遷移應用能力以及提取信息處理信息的能力。在教學實踐中,我發現絕大部分學生在解決這類習題時經常會出現錯誤,于是現將關于這種類型的習題進行系統總結,供老師和學生在復習時參考,以饗讀者。
一、結合阿伏加德羅常數進行考查
阿伏加德羅常數,是中學化學中常考的一個重要知識點,也是歷年高考必考選擇題考查的重點之一,設置的4個選項涉及范圍廣,延伸多,考查學生的綜合能力。
【例1】阿伏加德羅常數的值為NA,下列說法正確的是
( )

B.(2016·全國卷Ⅰ)1 mol N2與4 mol H2反應生成的NH3分子數為2NA
C.(2017·全國卷Ⅱ)標準狀況下,2.24 L N2和O2的混合氣體中分子數為0.2NA
【答案】D

二、結合氧化還原反應考查
氧化還原反應中氧化性、還原性、氧化劑、還原劑、基本規律和應用以及利用得失電子守恒進行相關計算仍然是新課標高考中的基礎內容,難度雖然不大,但是能和元素化合物知識相串聯,從多維度考查學生的基本能力和素養。
【例2】(2016·全國卷Ⅱ·26·節選)聯氨(又稱聯肼,N2H4,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料:回答下列問題:
(5)聯氨是一種常用的還原劑。向裝有少量AgBr的試管中加入聯氨溶液,觀察到的現象是________。聯氨可用于處理高壓鍋爐水中的氧,防止鍋爐被腐蝕。理論上1 kg的聯氨可除去水中溶解的O2________kg;與使用Na2SO3處理水中溶解的O2相比,聯氨的優點是________。
【答案】(5)固體逐漸變黑,并有氣泡產生 1 N2H4的用量少,不產生其他雜質(還原產物為N2和H2O,而Na2SO3產生Na2SO4)

三、結合氨氣的制備與催化氧化、氮氧化物溶于水或堿等相關性質進行考查
氨氣的制備、含氮化合物之間的相互轉化、氮氧化物溶于水等一直是元素化合物知識中的重點,有時候高考題結合這些考點考查相關的計算。
【例3】(2016·上海卷)稱取(NH4)2SO4和NH4HSO4混合物樣品7.24 g,加入含0.1 mol NaOH的溶液,完全反應,生成NH31 792 mL(標準狀況),則(NH4)2SO4和NH4HSO4的物質的量比為
( )
A.1∶1 B.1∶2 C.1.87∶1 D.3.65∶1
【答案】C
【解析】利用極值法分析,可知0.1 mol氫氧化鈉不足,故先將NH4HSO4反應完,再反應(NH4)2SO4,因共生成0.08 mol NH3,故與H+反應的氫氧化鈉為0.02 mol,則NH4HSO4為0.02 mol,(NH4)2SO4質量為7.24 g-115 g/mol×0.02 mol=4.94 g,(NH4)2SO4的物質的量為4.94 g÷132 g/mol=0.037 4 mol。因此(NH4)2SO4與NH4HSO4物質的量之比為1.87∶1。
四、結合金屬與硝酸反應進行考查
金屬與硝酸反應是中學化學中比較復雜的氧化還原反應,反應中反應條件、硝酸濃度等都對產物有影響,涉及金屬與硝酸反應的計算則更為復雜。一般常用的方法有電子守恒法、原子守恒法、極端假設法等。
【例4】(2013·四川卷·7)1.52 g銅鎂合金完全溶解于50 mL密度為1.40 g/mL、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體1 120 mL(標準狀況),向反應后的溶液中加入1.0 mol/L NaOH溶液,當金屬離子全部沉淀時,得到2.54 g沉淀,下列說法不正確的是
( )
A.該合金中銅與鎂的物質的量之比是2∶1
B.該濃硝酸中HNO3的物質的量濃度是14.0 mol/L
C.NO2和N2O4的混合氣體中,NO2的體積分數是80%
D.得到2.54 g沉淀時,加入NaOH溶液的體積是600 mL
【答案】D
【解析】設銅鎂的物質的量分別為x、y,則①64x+24y=1.52,②64x+24y+34x+34y=2.54,解得x=0.02 mol,y=0.01 mol,設N2O4、NO2的物質的量分別為a、b,則根據得失電子數相等:2x+2y=2a+b,a+b=0.05,則a=0.01 mol,b=0.04 mol,A、C正確;c(HNO3)=(1 000×1.4×63%/63) mol·L-1=14.0 mol·L-1,B正確;沉淀達最大時,溶液中只有硝酸鈉,根據原子守恒:n(NaOH)=n(HNO3)-(2a+b)=0.7 mol-0.06 mol=0.64 mol,氫氧化鈉溶液體積為640 mL,D錯誤。
五、結合物質結構、元素周期律綜合考查
該類試題與元素化合物的知識結合的比較多,元素推斷只是一種載體,主要通過必修2和選修3的知識進行解答。一般考查常見單質及其化合物的性質、典型用途、制備,涉及氮的核外電子排布、第一電離能、電負性、雜化的類型、分子結構、等電子體、氫鍵、配位鍵、鍵角、晶胞密度的計算等。
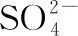

(3)與O3分子互為等電子體的一種陰離子為________(填化學式)。
(4)N2分子中σ鍵與π鍵的數目比n(σ)∶n(π)=________。
(5)[Fe(H2O)6]2+與NO反應生成的[Fe(NO)(H2O)5]2+中,NO以N原子與Fe2+形成配位鍵。請在[Fe(NO)(H2O)5]2+結構示意圖的相應位置補填缺少的配體。

[Fe(NO)(H2O)5]2+結構示意圖



六、結合電解質溶液氨水、銨鹽水溶液綜合考查
電解質溶液是每年高考考查的重點和熱點,一般都以選擇題或者在綜合題中以填空形式出現,主要就是結合氨水、銨鹽水溶液,酸堿中和滴定等綜合考查溶液中離子濃度的大小比較、電離平衡常數、水解平衡常數等。
【例6】(貴州省遵義航天高級中學2019屆高三上學期第五次模擬)25℃時,用0.10 mol·L-1的氨水滴定10.00 mLamol·L-1的鹽酸,混合溶液的pH與氨水的體積(V)的關系如圖所示。已知N點溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列說法不正確的是
( )

A.圖上四點離子種類相同
B.a=0.1


【答案】B

七、結合電化學中燃料電池綜合考查
電化學是每年高考考查的重點和熱點,主要就是結合最新科技(燃料電池)綜合考查電極反應式的書寫、化學計算、正負極的判斷等。一般都以選擇題或者在綜合題中以填空形式出現。
【例7】(黑龍江省青岡縣一中2018屆高二下學期期末)韓國三星公司因為手機電池爆炸而屢屢曝光,電池的安全性和環保性再次被公眾所重視。一種以引火性高的聯氨(N2H4)為燃料的環保電池,工作時產生穩定無污染的物質,原理如圖所示。下列說法正確的是
( )

A.N極為電源負極,聯氨從c口通入
B.負極上每消耗1 mol N2H4,轉移6 mol電子

D.可將聯氨改進為引火性低、穩定性好的N2H4·H2O
【答案】D

八、結合化學與生活、化學工藝流程等進行綜合考查
以環境問題、合成氨工業等工藝流程為素材并有效結合元素化合物知識、離子方程式的書寫、流程設計、反應條件的控制、化學計算等考查,有時候還涉及化學差量法的計算技巧。



(1)固體1的主要成分為Ca(OH)2、________。
(3)查閱資料可知:向2 mol氣體1中通入不同量的O2,并將所得混合氣體通入NaOH溶液中,有關含氮組分的物質的量變化如圖所示。

上述工藝流程中氣體1與O2的體積比(相同條件)應控制為____________________。
(4)為測定上述流程中所得NaNO2溶液的物質的量濃度,準確量取10.00 mL NaNO2溶液樣品與24.00 mL 0.05 mol/L 過量的酸性KMnO4溶液充分反應,反應后所得溶液用0.1 mol/L (NH4)2Fe(SO4)2標準溶液滴定至紫色剛好褪去,消耗(NH4)2Fe(SO4)2溶液10.00 mL。
通過計算確定NaNO2溶液的物質的量濃度為______________。


九、結合化學反應原理綜合題考查化學學方程式的書寫、氧化還原反應、蓋斯定律、化學平衡、電化學等
從近幾年課標試卷分析來看,結合選修中化學反應原理的相關知識考查的很多,側重于化學反應速率與化學平衡的有關分析與計算,題目難度較大。試題設計新穎,陌生感強,計算量較大,對學生的要求較高。壓強和平衡常數的計算是解答的難點,但是無論怎么考查,都回歸到元素氮及其化合物知識,所以在復習時要學會把前后所學的知識加以聯系,融會貫通。
【例9】(2018·全國卷Ⅰ·28)采用N2O5為硝化劑是一種新型的綠色硝化技術,在含能材料、醫藥等工業中得到廣泛應用。回答下列問題:
(1)1840年Devil用干燥的氯氣通過干燥的硝酸銀,得到N2O5。該反應的氧化產物是一種氣體,其分子式為________________。
(2)F.Daniels等曾利用測壓法在剛性反應器中研究了25℃時N2O5(g)分解反應:


2N2O4(g)
其中NO2二聚為N2O4的反應可以迅速達到平衡。體系的總壓強p隨時間t的變化如表所示(t=∞時,N2O5(g) 完全分解):

t/min040801602601 3001 700∞p/kPa35.840.342.545.949.261.262.363.1



②研究表明,N2O5(g)分解的反應速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min時,測得體系中pO2=2.9 kPa,則此時的pN2O5=________kPa,v=________kPa·min-1。
③若提高反應溫度至35℃,則N2O5(g)完全分解后體系壓強p∞(35℃)________(填“大于”“等于”或“小于”)63.1 kPa,原因是______________。





其中可近似認為第二步反應不影響第一步的平衡。下列表述正確的是________(填標號)。
A.v(第一步的逆反應)>v(第二步反應)
B.反應的中間產物只有NO3
C.第二步中NO2與NO3的碰撞僅部分有效
D.第三步反應活化能較高
【答案】(1)O2(2)①53.1 ②30.0 6.0×10-2③大于 溫度提高,體積不變,總壓強提高;NO2二聚為放熱反應,溫度提高,平衡左移,體系物質的量增加,總壓強提高 ④13.4 (3)AC
【解析】(1)氯氣在反應中得到電子作氧化劑,硝酸銀中只有氧元素化合價會升高,所以氧化產物是氧氣,分子式為O2。(2)①已知:


十、聯系化學實驗進行考查
一般以氨氣、二氧化氮、銀氨溶液、金屬與銨鹽反應、含氮化合物的制備為素材,結合了高中常見儀器綜合考查了化學基本儀器的名稱、實驗方案設計與評價、離子方程式的書寫、化學計算等。綜合性較強,具有很高的區分度。
【例10】(2017·全國卷Ⅰ·26)凱氏定氮法是測定蛋白質中氮含量的經典方法,其原理是用濃硫酸在催化劑存在下將樣品中有機氮轉化成銨鹽,利用如圖所示裝置處理銨鹽,然后通過滴定測量。已知:



回答下列問題:
(1)a的作用是______________。
(2)b中放入少量碎瓷片的目的是______________。
f的名稱是________。
(3)清洗儀器:g中加蒸餾水;打開k1,關閉k2、k3,加熱b,蒸氣充滿管路;停止加熱,關閉k1,g中蒸餾水倒吸進入c,原因是____________________;打開k2放掉水,重復操作2~3次。
(4)儀器清洗后,g中加入硼酸(H3BO3)和指示劑,銨鹽試樣由d注入e,隨后注入氫氧化鈉溶液,用蒸餾水沖洗d,關閉k3,d中保留少量水。打開k1,加熱b,使水蒸氣進入e。
①d中保留少量水的目的是______________。
②e中主要反應的離子方程式為______________,
e采用中空雙層玻璃瓶的作用是____________________。
(5)取某甘氨酸(C2H5NO2)樣品mg進行測定,滴定g中吸收液時消耗濃度為cmol·L-1的鹽酸VmL,則樣品中氮的質量分數為________%,樣品的純度≤________%。




