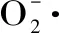雞樅菌粗蛋白超聲輔助提取工藝優(yōu)化及其抗氧化活性
劉 靜,李湘利,魏海香,趙 敏,薛麗萍,王雪萍
(濟(jì)寧學(xué)院生命科學(xué)與工程系,濟(jì)寧市特色農(nóng)產(chǎn)品高值化加工工程技術(shù)研究中心,山東曲阜 273155)
雞樅菌(Termitomycesalbuminosus)又稱(chēng)傘把菇、雞腳麟菇,為擔(dān)子菌綱口蘑科白蟻菌屬[1],菌柄具有纖維結(jié)構(gòu)、色澤似雞肉,食之有雞肉香味,故名雞樅[2]。雞樅菌主要分布于亞非等熱帶及南太平洋島嶼的亞熱帶地區(qū),我國(guó)主產(chǎn)于福建、臺(tái)灣和云貴川等地,是一種營(yíng)養(yǎng)豐富、風(fēng)味獨(dú)特的食用菌[3],其子實(shí)體蛋白質(zhì)含量極高,超過(guò)諸多食用菌蛋白質(zhì)含量,且人體必需氨基酸占總量的15.15%[4]。雞樅菌還有較高的醫(yī)療保健效果,可療痔止血、健脾和胃,抵制癌細(xì)胞,降低血糖,抗衰老、增強(qiáng)機(jī)體免疫力等[5]。

1 材料與方法
1.1 材料與儀器
雞樅菌 購(gòu)于金鄉(xiāng)縣聯(lián)盛菌業(yè)科技有限公司,采后削根于37 ℃烘干至恒重后粉碎,過(guò)40目篩備用;考馬斯亮藍(lán)G250 國(guó)藥集團(tuán)化學(xué)試劑有限公司;牛血清白蛋白(BR) 上海伯奧生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) Sigma分裝;2,2′-聯(lián)氮基-雙(3-乙基苯丙噻唑啉-6-磺酸)二銨鹽(ABTS) Amresco分裝;焦性沒(méi)食子酸、過(guò)硫酸鉀 天津市大茂化學(xué)試劑廠;Tris(三氨基甲烷) 天津市博迪化工有限公司。
XH-300B型電腦微波超聲波組合合成/萃取儀 北京祥鵠科技發(fā)展有限公司;723PC分光光度計(jì) 上海菁華科技儀器有限公司;FA2004N電子天平 上海精密科技儀器有限公司;FCD2000恒溫鼓風(fēng)干燥箱 上海瑯玕實(shí)驗(yàn)設(shè)備有限公司;TDL-60B低速臺(tái)式離心機(jī) 長(zhǎng)沙英泰公司;PHS-3C pH計(jì) 上海儀電科學(xué)儀器股份有限公司;LCJ-10冷凍干燥機(jī) 北京四環(huán)科學(xué)儀器長(zhǎng);FW135中草藥粉碎機(jī) 天津市泰斯特儀器有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 蛋白提取率的測(cè)定 采用考馬斯亮藍(lán)G250法測(cè)定蛋白質(zhì)含量。分別吸取0.1 mg/mL牛血清白蛋白標(biāo)準(zhǔn)溶液0、0.2、0.4、0.6、0.8、1.0 mL于試管中,補(bǔ)加蒸餾水至1.0 mL后,加入考馬斯亮藍(lán)G250試劑5.0 mL后搖勻靜置3 min,于595 nm測(cè)定吸光度,以吸光度為縱坐標(biāo),牛血清白蛋白含量(mg/mL)為橫坐標(biāo)繪制標(biāo)準(zhǔn)曲線,所得回歸方程為y=0.0018x+0.0246,R2=0.9916,線性范圍0~300 μg/mL,計(jì)算雞樅菌蛋白的提取總量(m1)。采用凱氏定氮法GB5009.5-2010測(cè)定雞樅菌粗蛋白含量(m0),計(jì)算雞樅菌蛋白提取率[21]。

式(1)
1.2.2 雞樅菌粗蛋白提取工藝流程 雞樅菌粉→超聲波輔助堿法提取→離心(3000 r/min,15 min)→取上清液→測(cè)定蛋白提取率→酸沉(1 mol/L的HCl溶液調(diào)至pI 4.0)→離心(4000 r/min,15 min)→取沉淀→水洗(至pH7.0)→減壓干燥(-80 ℃,1.4 MPa,24 h)→粗蛋白粉。
1.2.3 單因素實(shí)驗(yàn)設(shè)計(jì)
1.2.3.1 超聲功率對(duì)雞樅菌蛋白提取率的影響 在超聲時(shí)間1.0 h,超聲溫度60 ℃,料液比1∶30 g/mL,用pH8的NaOH溶液提取,考察超聲功率(300、400、500、600、700 W)對(duì)雞樅菌蛋白提取率的影響。
1.2.3.2 超聲溫度對(duì)雞樅菌蛋白提取率的影響 在超聲時(shí)間1.0 h,超聲功率500 W,料液比1∶30 g/mL,用pH8的NaOH溶液提取,考察超聲溫度(40、50、60、70、80 ℃)對(duì)雞樅菌蛋白提取率的影響。
1.2.3.3 pH對(duì)雞樅菌蛋白提取率的影響 在超聲時(shí)間1.0 h,超聲溫度70 ℃,超聲功率500 W,料液比1∶30 g/mL,用0.1 mol/L的NaOH調(diào)整提取液pH,考察pH(8、9、10、11、12)對(duì)雞樅菌蛋白提取的影響。
1.2.3.4 料液比對(duì)雞樅菌蛋白提取率的影響 在超聲時(shí)間1.0 h,超聲溫度70 ℃,超聲功率500 W,用pH11的NaOH溶液提取,考察料液比(1∶20、1∶25、1∶30、1∶35、1∶40 g/mL對(duì)雞樅菌蛋白提取率的影響。
1.2.3.5 超聲時(shí)間對(duì)雞樅菌蛋白提取率的影響 在超聲溫度70 ℃,超聲功率500 W,用pH11的NaOH溶液提取,料液比1∶25 g/mL,考察超聲時(shí)間(0.5、1.0、1.5、2.0、2.5 h)對(duì)雞樅菌蛋白提取率的影響。
1.2.4 正交實(shí)驗(yàn) 根據(jù)單因素實(shí)驗(yàn)結(jié)果,以蛋白提取率為指標(biāo),選取超聲功率(A)、超聲溫度(B)、pH(C)、超聲時(shí)間(D)四個(gè)因素設(shè)計(jì)L9(34)正交實(shí)驗(yàn),實(shí)驗(yàn)因素與水平見(jiàn)表1。

表1 正交實(shí)驗(yàn)因素與水平表Table 1 Factors and levers of orthogonal experiment
1.2.5 超聲波輔助與常規(guī)提取雞樅菌粗蛋白的比較 參照文獻(xiàn)[21]的方法,在料液比1∶25 g/mL、pH11、溫度70 ℃下提取1.5 h,提取雞樅菌粗蛋白,與正交實(shí)驗(yàn)最優(yōu)實(shí)驗(yàn)結(jié)果對(duì)比,比較超聲波輔助提取與常規(guī)方法的提取效果。
1.2.6 自由基清除能力的測(cè)定
1.2.6.1 ABTS+·自由基清除能力的測(cè)定 用2.45 mmol/L過(guò)硫酸鉀配制備7 mmol/L ABTS+·儲(chǔ)備液,避光靜置12 h。用10 mmol/L磷酸緩沖液(pH7.4)稀釋ABTS+·儲(chǔ)備液,使其在734 nm吸光值為0.7±0.02;將雞樅菌蛋白稀釋成20、40、60、80、100、120 mg/L,吸取3 mL蛋白稀釋液于試管中,加入12 mL ABTS+·測(cè)試液,搖勻后室溫避光反應(yīng)5 min,以95%乙醇為參比,于734 nm測(cè)吸光度(A1);同時(shí)測(cè)定以95%乙醇代替雞樅菌蛋白提取液的吸光度(A0),以相同濃度梯度VC作對(duì)照,計(jì)算ABTS+·清除率[22]。

式(2)
1.2.6.2 DPPH·自由基清除能力的測(cè)定 將雞樅菌蛋白稀釋成10、20、30、40、50、60 mg/L,吸取雞樅菌蛋白稀釋液6 mL于試管中,加入6 mL 0.01 mmol/L DPPH·溶液,搖勻室溫避光反應(yīng)30 min,以無(wú)水乙醇為參比,于517 nm測(cè)定吸光度(A1);同時(shí)測(cè)定以6 mL無(wú)水乙醇代替雞樅菌蛋白提取液的吸光度(A2),以6 mL無(wú)水乙醇代替DPPH的吸光度(A3);以相同濃度梯度VC作對(duì)照,計(jì)算DPPH·清除率[23]。
式(3)

式(4)
式中:ΔA0為鄰苯三酚的自氧化法速率;ΔA為加入酶解液后鄰苯三酚自氧化法速率(單位均為吸光度每分鐘的增加值)。
1.3 數(shù)據(jù)處理
采用IBM SPSS Statistics 22.0軟件對(duì)實(shí)驗(yàn)結(jié)果進(jìn)行統(tǒng)計(jì)分析,應(yīng)用Microsoft Excel 2003的FORECAST函數(shù)計(jì)算清除50%自由基所需雞樅菌蛋白濃度(IC50)。
2 結(jié)果與分析
2.1 單因素實(shí)驗(yàn)結(jié)果
2.1.1 超聲功率對(duì)雞樅菌蛋白提取率的影響 由圖1可知,隨超聲功率升高,蛋白提取率呈先升高后降低的變化趨勢(shì);功率500 W時(shí)蛋白提取率最大,可達(dá)26.970%±0.666%,且與其他組差異顯著(p<0.05)。由于超聲功率的增加,超聲波的機(jī)械效應(yīng)和空穴效應(yīng)增大,增加了對(duì)細(xì)胞壁的破碎作用,蛋白提取率增加;但功率過(guò)高也會(huì)導(dǎo)致泡沫產(chǎn)生,增加衍射衰減,不利于空穴現(xiàn)象的產(chǎn)生[25]。因此,超聲波輔助提取雞樅菌粗蛋白的功率在500 W左右。

圖1 超聲功率對(duì)雞樅菌蛋白提取率的影響Fig.1 Effects of ultrasonic power on extraction rate of protein from Termitomyces albuminosus注:圖中不同小寫(xiě)字母表示各組 數(shù)據(jù)差異顯著(p<0.05),圖2~圖5同。
2.1.2 超聲溫度對(duì)雞樅菌蛋白提取率的影響 由圖2可知,隨超聲溫度的升高,蛋白提取率呈先升高后降低的變化趨勢(shì);超聲70 ℃時(shí)蛋白提取率最大,可達(dá)37.049%±0.631%,且與其他組差異顯著(p<0.05)。因?yàn)闇囟壬呖商岣叩鞍踪|(zhì)溶解度,超聲空化效應(yīng)增強(qiáng);當(dāng)溫度過(guò)高時(shí),蛋白質(zhì)會(huì)出現(xiàn)變性現(xiàn)象,空間構(gòu)象被破壞,蛋白質(zhì)疏水基團(tuán)暴露,分子間相互結(jié)合而沉淀,溶解度下降[26]。所以,超聲波輔助提取雞樅菌粗蛋白的溫度在70 ℃左右。

圖2 超聲溫度對(duì)雞樅菌蛋白提取率的影響Fig.2 Effects of ultrasonic temperature on extraction rate of protein from Termitomyces albuminosus
2.1.3 pH對(duì)雞樅菌蛋白提取率的影響 由圖3可知,隨pH升高,蛋白提取率呈先升高后降低的變化趨勢(shì);pH11時(shí)蛋白提取率最大,可達(dá)52.305%±0.589%,且與其他組差異顯著(p<0.05)。因?yàn)檫m當(dāng)升高pH,蛋白質(zhì)溶解度增大,但堿性太強(qiáng)時(shí),蛋白質(zhì)可能會(huì)出現(xiàn)變性和水解[21],增加了美拉德反應(yīng)速度,加之蛋白質(zhì)可能出現(xiàn)異味,發(fā)生顏色變化,外觀質(zhì)量下降[27],故超聲波輔助提取雞樅菌粗蛋白的pH在11左右。

圖3 pH對(duì)雞樅菌蛋白提取率的影響Fig.3 Effects of pH on extraction rate of protein from Termitomyces albuminosus
2.1.4 料液比對(duì)雞樅菌蛋白提取率的影響 由圖4可知,隨料液比增大,蛋白提取率呈先升高后降低的變化趨勢(shì);料液比為1∶25 g/mL時(shí)蛋白提取率最大,可達(dá)52.271%±0.613%,且與其他組差異顯著(p<0.05)。因?yàn)殡S料液比增大,體系黏度降低,提取率增加;但料液比過(guò)大時(shí),物料過(guò)于分散,不利于蛋白質(zhì)后期沉淀[28]。為此,超聲輔助提取雞樅菌粗蛋白的料液比在1∶25 g/mL左右。

圖4 料液比對(duì)雞樅菌蛋白提取率的影響Fig.4 Effects of liquid ratio on extraction rate of protein from Termitomyces albuminosus
2.1.5 超聲時(shí)間對(duì)雞樅菌蛋白提取率的影響 由圖5可知,隨超聲時(shí)間的增加,蛋白提取率呈先升高后降低的變化趨勢(shì);超聲時(shí)間為1.0 h時(shí)提取率最大,可達(dá)52.352%±0.720%,且與其他組差異顯著(p<0.05),而后逐漸降低。因?yàn)檫m宜的超聲時(shí)間可使細(xì)胞破裂促進(jìn)蛋白質(zhì)的提取,但時(shí)間過(guò)長(zhǎng)會(huì)引起蛋白質(zhì)的變性甚至降解,故蛋白質(zhì)提取率呈下降趨勢(shì)[29]。因此,超聲輔助提取雞樅菌粗蛋白的提取時(shí)間在1.0 h左右。

圖5 超聲時(shí)間對(duì)雞樅菌蛋白提取率的影響Fig.5 Effects of time on extraction rate of protein from Termitomyces albuminosus
2.2 正交實(shí)驗(yàn)結(jié)果
為優(yōu)化超聲波輔助提取效果,在單因素實(shí)驗(yàn)基礎(chǔ)上,固定料液比1∶25 g/mL,以超聲功率(A)、超聲溫度(B)、pH(C)、超聲時(shí)間(D)4個(gè)因素進(jìn)行L9(34)正交實(shí)驗(yàn)優(yōu)化雞樅菌粗蛋白提取參數(shù),實(shí)驗(yàn)結(jié)果見(jiàn)表2,方差分析見(jiàn)表3。

表2 超聲波輔助提取雞樅菌粗蛋白正交實(shí)驗(yàn)設(shè)計(jì)及結(jié)果Table 2 Orthogonal array design and results of protein extraction of Termitomyces albuminosus with ultrasonic assisted

表3 超聲波輔助提取雞樅菌粗蛋白正交實(shí)驗(yàn)優(yōu)化工藝方差分析Table 3 Orthogonal test analysis of variance on extraction of protein from Termitomyces albuminosus with ultrasonic assisted
由表2可知,各實(shí)驗(yàn)因素對(duì)雞樅菌蛋白提取率的影響程度為B>A>C>D,即超聲溫度>超聲功率>pH>超聲時(shí)間。超聲波輔助提取雞樅菌粗蛋白的最優(yōu)化條件為A1B3C3D3,即超聲功率為400 W,超聲溫度為70 ℃,pH為11,超聲時(shí)間為1.5 h。
由表3可知,超聲功率、超聲溫度、pH、超聲時(shí)間均對(duì)粗蛋白提取有極顯著影響(p<0.01)。在正交實(shí)驗(yàn)所得最適提取條件超聲功率400 W,超聲溫度70 ℃,pH11,超聲時(shí)間1.5 h的條件下,進(jìn)行超聲波輔助提取雞樅菌粗蛋白的驗(yàn)證實(shí)驗(yàn),所得雞樅菌蛋白質(zhì)含量為86.525%±1.315%,蛋白提取率為67.322%±1.028%。無(wú)超聲處理的常規(guī)法,在相同條件下提取雞樅菌蛋白含量為74.067%±1.238%,蛋白提取率為42.238%±0.876%;400 W超聲波輔助雞樅菌蛋白提取率比常規(guī)法提高了59.387%,蛋白質(zhì)含量提高了16.820%,這說(shuō)明超聲波促進(jìn)了雞樅菌粗蛋白的溶解和擴(kuò)散,使蛋白提取率顯著提升(p<0.05)。
2.3 雞樅菌粗蛋白的抗氧化活性分析
2.3.1 對(duì)ABTS+·的清除能力分析 由圖6可知,雞樅菌粗蛋白對(duì)ABTS+·有一定的清除能力,隨粗蛋白濃度增加,對(duì)ABTS+·的清除能力逐漸增加,粗蛋白濃度為120 mg/L時(shí),ABTS+·清除率最大可達(dá)92.485%±0.515%(p<0.05),粗蛋白和VC清除ABTS+·的IC50分別為46.322、10.431 mg/L,但粗蛋白的清除效果低于同濃度VC的清除效果(p<0.05)。

圖6 雞樅菌蛋白對(duì)ABTS+·的清除能力Fig.6 ABTS+· radical scavenging activity of protein from Termitomyces albuminsous注:圖中不同小寫(xiě)字母表示同一質(zhì)量濃度不同清除率間 差異顯著(p<0.05),圖7、圖8同。
2.3.2 對(duì)DPPH·的清除能力分析 由圖7可知,雞樅菌粗蛋白對(duì)DPPH·有一定的清除能力,且隨粗蛋白濃度增加,對(duì)DPPH·的清除能力逐漸增加,粗蛋白濃度為60 mg/L時(shí),DPPH·最大清除率可達(dá)47.165%±3.185%,粗蛋白和VC清除DPPH·的IC50分別為61.176、3.890 mg/L,粗蛋白清除效果顯著低于同濃度VC的清除效果(p<0.05)。

圖7 雞樅菌蛋白對(duì)DPPH·自由基清除能力Fig.7 DPPH· radical scavenging activity of protein from Termitomyces albuminsous

圖8 雞樅菌蛋白的對(duì)自由基的清除能力 radical scavenging activity of protein from Termitomyces albuminsous
3 結(jié)論