應用微衛星DNA標記對廣西食蟹猴的遺傳學研究*
張潔宏 覃輝艷 李 彬 楊 慧 王 芳 陳華鳳
(廣西壯族自治區疾病預防控制中心,南寧 530028)
食蟹猴又稱長尾猴,屬于猴科,獼猴亞科,獼猴屬,食蟹猴種,因其喜歡在退潮后到海邊覓食螃蟹及貝類而得名,主要分布在亞洲東南部老撾、越南、印度尼西亞、馬來西亞等國家地區,國內主要為人工飼養種群。因其體型較小,適應性強,容易馴養繁殖,在生物進化上與人類的遺傳物質有98.5%的同源性,組織結構,生理代謝等與人類較接近,在生物學、心理學、醫學等多種生命科學研究中有著其他實驗動物無法替代的重要地位[1]。特別是在心腦血管疾病、神經系統疾病、生殖系統疾病、內分泌系統疾病、艾滋病、結核等惡性傳染病、器官移植等研究中食蟹猴有著極高的應用價值[2-3]。目前,食蟹猴已成為生命科學研究最常用的大型實驗動物之一,我國也是全世界作為實驗動物使用和出口食蟹猴最多的國家,檢測食蟹猴遺傳質量,建立遺傳背景清楚的食蟹猴種群,提供標準化的實驗食蟹猴,將有力保障研究結果的準確性、科學性和有效性。但目前我國食蟹猴遺傳背景研究較少。因此,本研究應用20個微衛星位點對廣西食蟹猴進行遺傳檢測,探討廣西食蟹猴的遺傳背景,并為建立廣西食蟹猴遺傳質量檢測方法和種群資源庫提供基礎資料。
1 材料與方法
1.1 實驗動物
選取廣西3家最大最具有代表性的食蟹猴養殖公司(以下分別簡稱為F、N和W)進行無關個體隨機采樣,共采樣成年食蟹猴30只,每個公司各10只,雌雄各半,年齡為3~4歲,體質量為3~4 kg,F、N和W 3家食蟹猴養殖公司目前的種猴數量均為4千只左右,總存欄猴數量均為1~1.2萬只,為避免選擇的個體相互間存在父子、母子、同胞關系,本研究根據養殖公司給定的記錄譜系,從育成待發猴群的不同欄舍進行無關個體隨機抽樣,空腹自上肢靜脈抽取全血2 mL,EDTA抗凝。
1.2 主要儀器與試劑
儀器:Sigma高速冷凍離心機、Bio-Rad電泳儀、UVP GelDoc-It2凝膠成像分析儀、ABI梯度PCR儀、ABI 3730XL測序儀等。
試劑:Qiagen DNeasy Blood & Tissue Kit核酸提取試劑盒、Takara Premix Ex TaqTMHot Start Version PCR反應試劑盒等。
1.3 實驗方法
1.3.1核酸樣品制備:全血樣品使用Qiagen公司貨號為69504的試劑盒DNeasy Blood & Tissue Kit(50)提取核酸。核酸提取后采用ND-1000 紫外分光光度計分析提取核酸的純度和濃度。采用1%瓊脂糖凝膠電泳檢測DNA樣品是否含有主帶。
1.3.2微衛星位點選取與引物合成:根據文獻[1,4-8]和GenBank數據庫提供的信息,選擇等位基因數、多態性含量豐富、盡可能分布于多條不同染色體的20個微衛星位點,其中位點D1S533、D10S611、D2S146、D3S1768、D3S3045、D4S1645、D5S1466、D6S311、D8S1106、D9S934、D11S1352、D12S67、D13S797、D15S644、D18S536、DXS6810選取于文獻1~6,位點D12S375、D16S409、D17S800、D22S419選取于GenBank數據庫。20個微衛星位點序列均在GenBank數據庫查找。各位點引物使用FAM標記,由華大基因合成。引物編號和序列見表1。
1.3.3PCR反應:PCR反應體系為:Premix Ex Taq Hot Start Version 10 μL、模板1 μL、10 μmol/L正向引物0.5 μL、10 μmol/L反向引物0.5 μL、無酶水補足至20 μL。擴增程序為:94 ℃預變性3 min、94 ℃變性30 s,最佳退火溫度(見表1)30 s,72 ℃延伸30 s,循環30次,72 ℃保持10 min。
1.3.5毛細管電泳:將甲酰胺與分子量內標按100∶1 的體積比混勻后,取9 μL加入上樣板中,再加入1 μL稀釋10 倍的PCR產物,使用ABI 3730XL 測序儀進行毛細管電泳。利用Genemarker 中的Fragment(Plant)片段分析軟件對測序儀得到的原始數據進行分析,將各泳道內分子量內標的位置與各樣品峰值的位置做比較分析,得到片段大小。

表1 20 個食蟹猴微衛星位點的擴增條件和染色體分布Table 1 Amplifying condition and chromosomedistribution of 20 microsatellite DNAloci in Macaca fascicularis
1.4 統計方法
采用POPGENE32和NTSYS軟件對樣品進行遺傳多樣性分析。計算各引物的等位基因數、有效等位基因數、觀測雜合度、期望雜合度、香隆信息指數、Nei’s基因多樣度以及多態信息含量等群體內的遺傳變異和遺傳距離、遺傳相似系數、F-統計量、基因流等群體間遺傳關系。
2 結果
2.1 20個微衛星位點片段大小
30個樣品20個檢測位點毛細管電泳片段大小范圍見表2。
2.2 群體遺傳多態性分析
由表3可見,30個樣本共檢測到等位基因237個,其觀察等位基因數Na為5~19個,平均為11.85個,其中最多的位點是D12S67,高達19個,最少的位點是D18S536,有5個等位基因。有效等位基因數Ne為3.2374~12.3288個,平均為6.9473個;觀察雜合度Ho為0.3~1,平均為0.7833,期望雜合度He為0.8508~0.9345,平均為0.85,平均期望雜合度He 略高于平均觀察雜合度Ho;Nei’s基因多樣度H為0.6911~0.9189,平均為0.8358;香隆信息指數I為1.3914~2.7085,平均為2.0954;多態信息含量PIC為0.6609~0.9135,平均為0.817,均大于0.5;表明廣西食蟹猴總群體在微衛星水平上表現出較高的遺傳多態性。分別對3個群體進行遺傳多態性分析(見表4),3個群體(F、N和W)分別檢測到等位基因158、158和173個,平均期望雜合度He分別為0.8371、0.8318和0.8642;平均多態信息含量PIC分別為0.7692、0.7653和0.8001,3個群體亦存在較高的遺傳多態性。
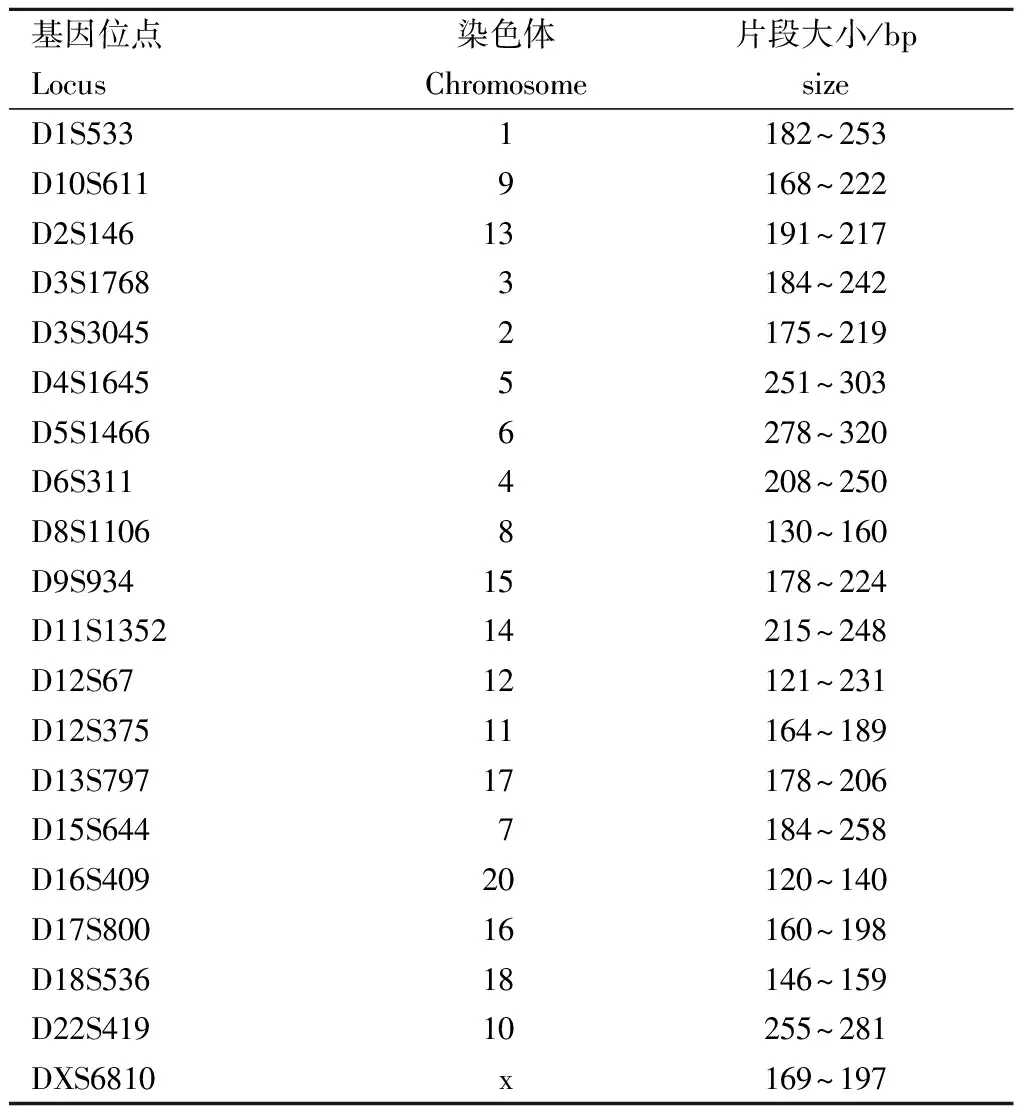
表2 20個微衛星DNA檢測位點片段大小Table 2 DNA fragment size of 20 microsatellite DNA loci
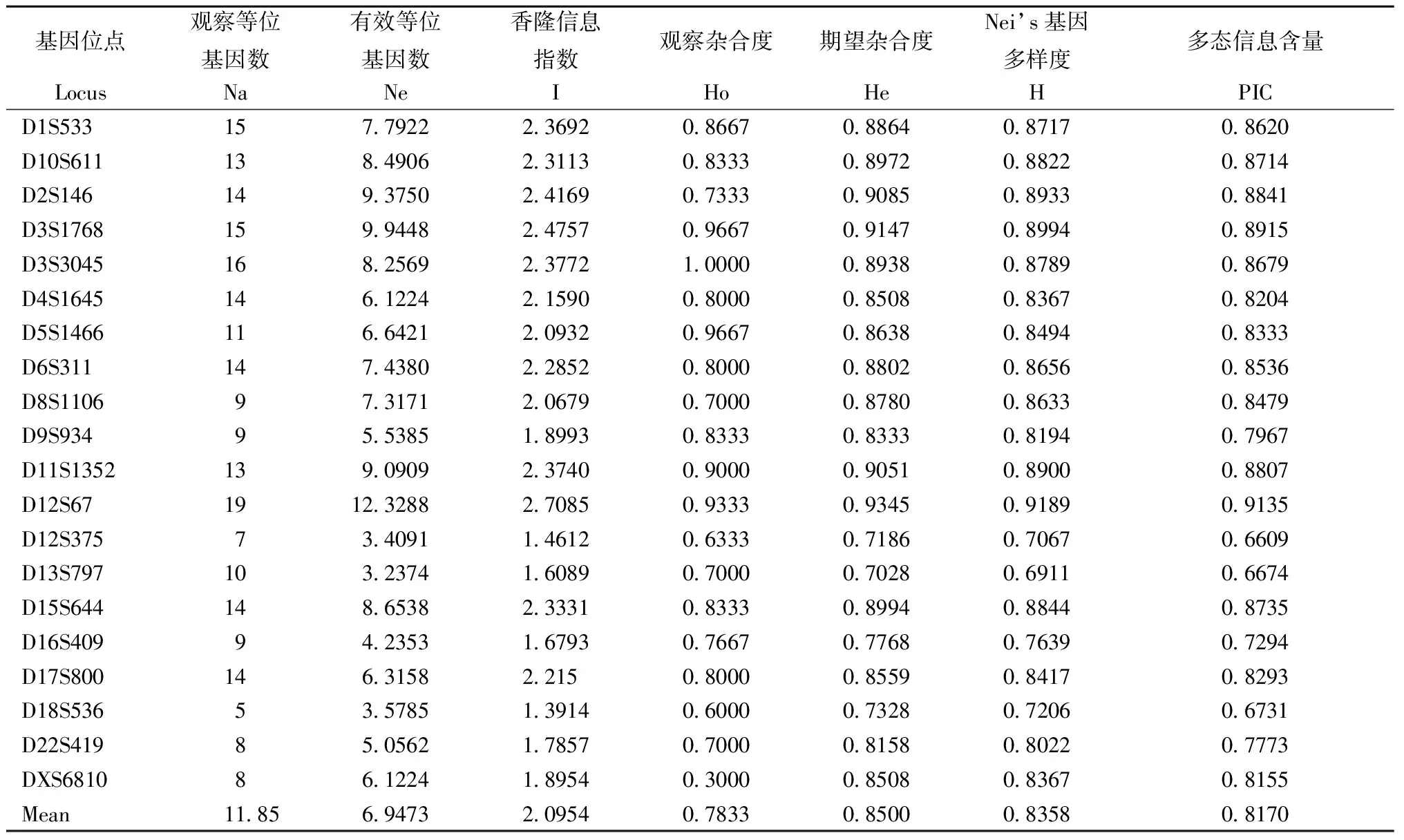
表3 30個樣品20個微衛星位點遺傳多態性檢測結果Table 3 Genetic polymorphism measured at 20 microsatellite loci in 30 samples
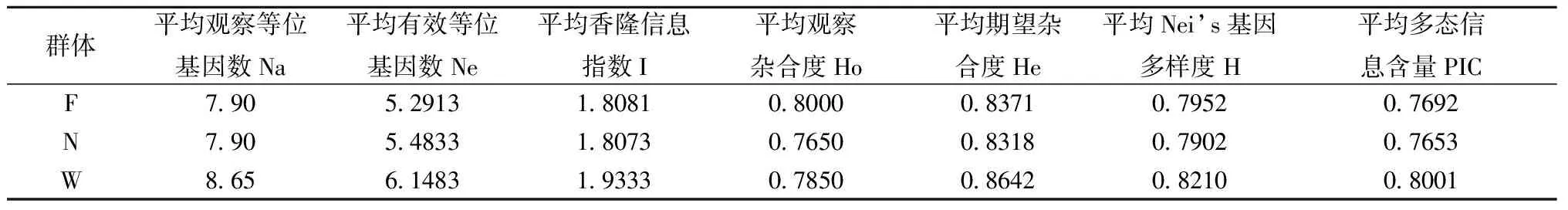
表4 3個群體遺傳多態性檢測結果Table 4 Genetic polymorphism in 3 groups
2.3 Hardy-Weinberg平衡檢測
Hardy-Weinberg平衡檢測結果表明(見表5),多數位點處于H-W平衡,只有F群體在位點D6S311、DXS6810上,N群體在位點D13S797、DXS6810上,W群體在位點D1S533、D9S934、D22S419上存在不平衡,P<0.05。

表5 Hardy-Weinberg平衡檢測結果Table 5 Result of Hardy-Weinberg equilibrium
2.4 遺傳距離和遺傳相似系數
表6星號上方是遺傳相似系數,下方是遺傳距離。由表6可見,3個群體遺傳距離變化范圍為0.2556~0.3223,遺傳相似度范圍為72.45%~77.45%。
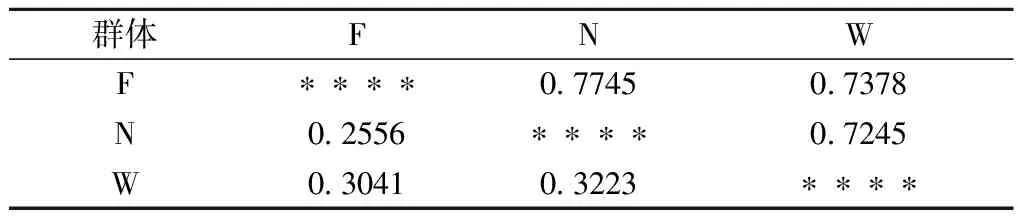
表6 Nei’s遺傳距離和遺傳相似系數檢測結果Table 6 Nei’s unbiased measures of geneticdistance and genetic identity
2.5 聚類分析
利用Nei’s遺傳距離進行UPGMA聚類分析,得到2大類,結果見圖1。F群體和N群體先聚為一類,再和W群體聚為一類。

圖1 基于Nei’s遺傳距離的UPGMA聚類圖Fig.1 UPGMA dendrogram based onNei’s genetic distance
2.6 F-統計量和基因流
由表7可見,Fis均值為0.0235,Fit均值為0.0628,表明群體受近親交配和人工選擇影響小。Fst均值為0.0402,Nm均值為5.9616,表明群體間遺傳分化小。
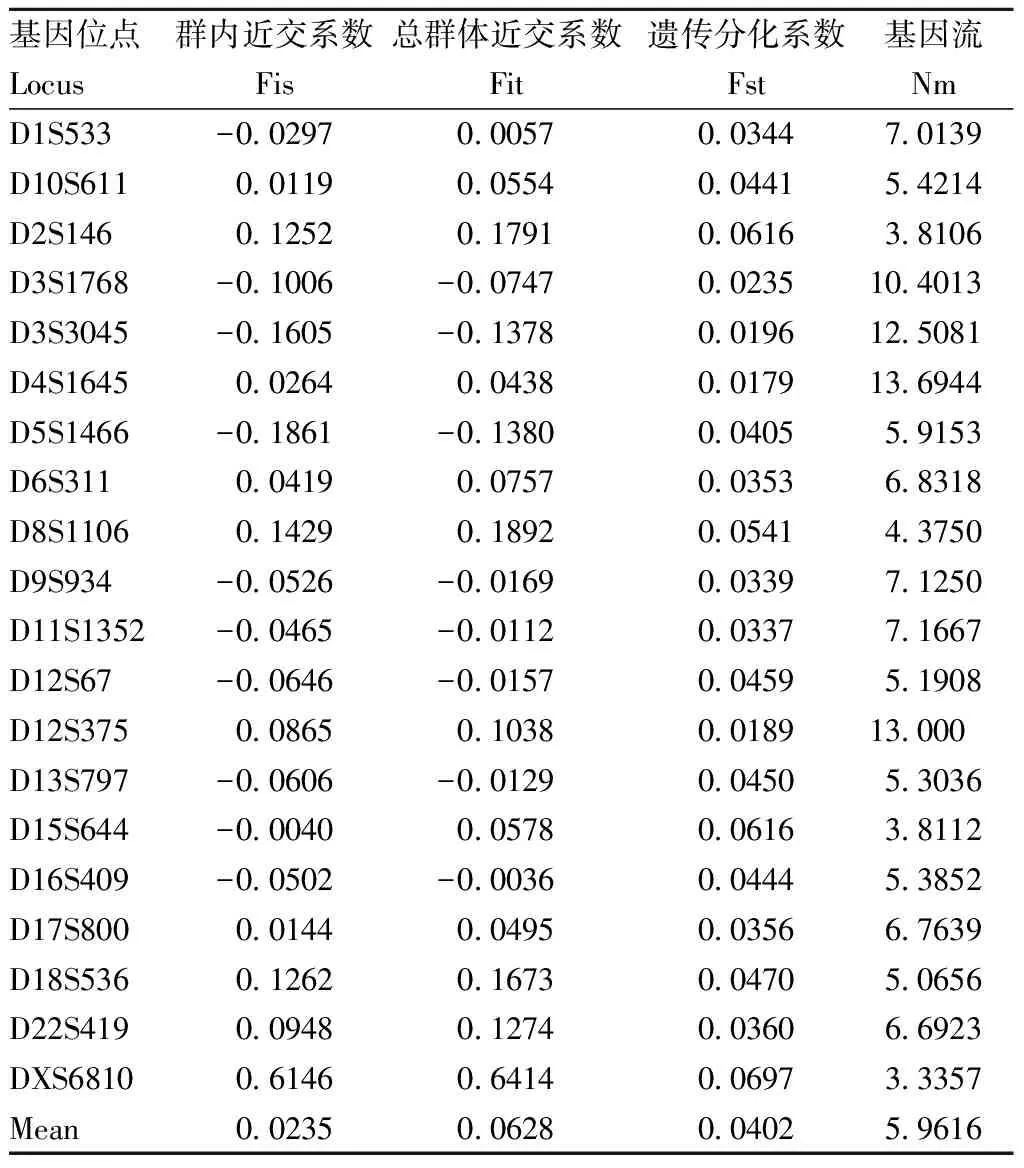
表7 F-統計量和基因流檢測結果Table 7 Result of F-statistics and gene flow
3 討論
實驗動物遺傳質量檢測是評價實驗動物質量的一個重要手段,其目的是為了確定被檢動物是否符合該品系或種群的生物學特性以及檢測該種群動物的近交程度等。隨著生物技術的發展,現遺傳標記研究主要集中在DNA分子水平上。微衛星是由2~6個核苷酸的串聯重復片段構成的DNA序列,因其具有分布廣泛、多態性豐富、易于檢測、結果穩定可靠等特點,現已被廣泛應用于親緣關系鑒定、人類疾病診斷、實驗動物遺傳質量檢測、生物群體遺傳多樣性遺傳結構與物種資源保護等多領域[9]。2007年Kikuchi 等[10]從人類基因庫中選取148個微衛星位點首次研究報道了食蟹猴的微衛星標記。近年來,Nikzad等[11]應用18個微衛星位點評估了馬來西亞6個島嶼野生食蟹猴的遺傳多樣性和種群結構,結果顯示總群體平均觀察雜合度為0.497,平均期望雜合度為0.803,Sunggala和Penang島食蟹猴群體具有較高的遺傳多樣性,馬來西亞食蟹猴遺傳距離和地理位置之間沒有較大關聯。Smith等[12]應用15個微衛星位點比較分析了菲律賓食蟹猴與印度尼西亞、新加坡、毛里求斯、柬埔寨食蟹猴的遺傳特性,菲律賓、毛里求斯食蟹猴遺傳多樣性較印度尼西亞、新加坡和柬埔寨低,群體間存在較大遺傳分化。國內李瑞生等[1]、劉歡[8]分別應用20個微衛星位點、18個微衛星位點有效分析了國內食蟹猴群體的遺傳多樣性,國內飼養食蟹猴的遺傳多樣性較高于東南亞地區。
本研究采用20個微衛星位點探討廣西食蟹猴的遺傳質量,多個基因位點的遺傳參數平均值是衡量群體遺傳變異大小和群體遺傳多樣性常用的指標,其中多態信息含量PIC是反應微衛星位點多態性的理想指標,當PIC>0.5時,微衛星位點具有高度多態性。雜合度是衡量群體內遺傳變異最直接和最有效的指標,其值越高群體的遺傳多樣性越豐富[13]。本研究結果顯示20個微衛星多態信息含量PIC均大于0.5,為0.6609~0.9135,平均為0.817,表明20個微衛星位點均為高多態性位點,能較好地反應廣西食蟹猴的遺傳多樣性,與文獻[1,4-8]報道的微衛星位點多態性相同。30個樣品20個微衛星位點觀察等位基因數Na為5~19個,平均觀察等位基因數Na為11.85個,平均有效等位基因數Ne為6.9473個,亦與文獻[1,4-8]檢測到的觀察等位基因數大致相同。總群體平均觀察雜合度Ho為0.7833,平均期望雜合度He為0.85,且Nei’s基因多樣度H和香隆信息指數I均較高,表明廣西食蟹猴猴群等位基因數多、雜合度大,遺傳多樣性豐富。分別對3個生產群(F、N和W)進行遺傳多態性分析,3個生產群雜合度H、多態信息含量PIC、Nei’s基因多樣度H和香隆信息指數I均較高,表明3個生產群亦存在較高的遺傳多態性。3個群體平均觀察雜合度接近平均期望雜合度,Hardy—Weinberg平衡檢測每個生產群在2~3個位點處于不平衡外,多數位點處于H-W平衡, F—統計量Fis均值和Fit均值均較低,表明各群體受人工選擇和近親交配影響小,基本處于隨機交配狀態,3家養殖公司開展的遺傳繁育方式較合理。種群的基因多樣性與群體來源的復雜程度、群體大小及繁育方式有著直接的關聯,廣西F、N和W 3家食蟹猴養殖公司食蟹猴基本以來源于越南、柬埔寨、緬甸和老撾等多個國家的野生群體為主,經過多次引種和本場育種形成,引種來源覆蓋面廣,且時間跨度大,存欄數量大,開展的遺傳繁育方式較合理,故本次檢測廣西食蟹猴雜合度較高。皮道元等[14]采用11個微衛星位點分析了廣西引種回來的柬埔寨、越南和老撾食蟹猴群體的遺傳多樣性,共檢測到平均等位基因數Na為11.82個,平均有效等位基因8.15個,總群體期望雜合度為0.8562。劉歡[8]采用18個微衛星位點對我國廣東、廣西、云南和海南4省飼養的食蟹猴進行遺傳多樣性分析亦顯示,廣西群體平均觀察雜合度分別為0.6546、0.6299、0.6948,平均期望雜合度分別為0.8390、0.8135、0.8326,與本研究雜合度相似。李瑞生等[1]的研究結果亦表明食蟹猴個體間均呈現高度的多態性,基因多樣性為0.7832~0.8801,香隆信息指數為1.5651~2.1592,且雌雄個體間無差異。
對3個生產群的群體間遺傳關系分析可見,群體間的遺傳分化系數Fst均值為0.0402,依據Wright[15]建議,當Fst在0~0.05之間說明種群間遺傳分化很小,0.05~0.15之間中等遺傳分化,0.15~0.25之間遺傳分化大,大于0.25遺傳分化極大。本研究3個生產群間的遺傳分化很小,平均95.98%的遺傳變異存在于群體之內,只有4.02%的遺傳變異存在于群體之間,群體內的遺傳變異是主要的變異來源。群體間的遺傳分化水平與基因流密切相關,Wright認為若基因流Nm<1,有限的基因流是促使群體發生遺傳分化的主要原因,若Nm>1,基因流能防止不同地區亞群體間發生遺傳分化[16]。本研究Nm均值為5.9616,群體間基因流動較頻繁,可防止群體間產生遺傳分化。對3個生產群的遺傳距離和親緣關系分析亦可見,3個群體的遺傳距離較小,親緣關系較近,F群體和N群體遺傳距離最近,為0.2556,遺傳相似度最高,達77.45%,N群體和W群體的遺傳距離最遠,為0.3223,遺傳相似度為72.45%。聚類分析也顯示,F群體和N群體先聚為一類,再和W群體聚為一類,符合3個繁殖猴場各自關聯引種歷史特征。劉歡[6]對國內廣西等4省籠養的食蟹猴進行遺傳多樣性研究,結果亦表明廣西群體遺傳距離為0.2126~0.3571,遺傳相似度為69.97%~80.85%,與本研究相似。
本研究運用微衛星DNA標記技術有效分析了廣西食蟹猴的遺傳多態性和群體間的遺傳關系,為今后建立廣西食蟹猴遺傳背景資源庫,指導食蟹猴的生產繁殖,建立遺傳背景清楚的食蟹猴種群提供了理論依據。同時也為在廣西建立食蟹猴微衛星DNA遺傳質量監測奠定了基礎。

