骨架蛋白降解對冰鮮草魚質構的影響
賈勝男,楊 方,2,*,臧金紅,夏文水,*,姜啟興,許艷順,于沛沛
(1.江南大學食品學院,食品科學與技術國家重點實驗室,江蘇省食品安全與質量控制協同創新中心,江蘇 無錫 214122 ;2.徐州一統食品工業有限公司江蘇省博士后創新實踐基地,江蘇 徐州 221004 )
我國是淡水漁業大國,淡水養殖魚類產量豐富;草魚是我國養殖產量最大的魚種[1]。目前,國內淡水魚市場仍以鮮銷為主,加工比例低,成品或半成品種類較少,這成為制約我國淡水漁業健康可持續發展的技術瓶頸[2]。雖然海水產品的冷鏈銷售初具規模,但由于淡水魚肉質細嫩、水分含量高,與海水產品的組成成分、結構特點和生化特性不同,淡水魚更易于腐敗變質,冷鮮銷售仍存在技術難題亟待解決,開發切實有效的保鮮技術對淡水魚行業發展尤為重要[3]。現階段應用較廣的食品保鮮技術有冷凍、冷藏、冰藏等。冷凍會導致冰晶的產生進而破壞細胞結構,解凍過程中汁液流失嚴重,影響魚肉品質[4];冷藏條件下,冰點以上的溫度對微生物和酶活力抑制效果有限,魚肉較易腐敗變質,使貨架期短[5]。冰藏條件下,冰晶產生少,減少了冷凍對細胞結構的破壞;冰藏溫度比冷藏條件低,對微生物及酶活力的抑制效果更明顯,具有較廣闊的市場前景[6-7]。
冰藏相對于冷凍、冷藏等保鮮技術雖有一定優勢,但冰藏條件下魚肉質構劣化現象仍然存在。現有的對引起魚肉質構劣化的肌原纖維蛋白的研究主要集中在較小分子質量肌球蛋白重鏈(220 kDa)、肌動蛋白(44 kDa)的降解上,而忽略了對細胞起支撐和鏈接作用的大分子質量的骨架蛋白[8]。在畜禽體系中,骨架蛋白的降解會使肌纖維解離及細胞結構坍塌,從而導致持水力、剪切力下降[9];但魚肉纖維結構和蛋白特性與畜禽肉有本質區別,無法將畜禽肉的知識作簡單的平行移動;因此魚肉體系中,骨架蛋白降解如何影響質構還有待研究。目前普遍采用聚丙烯酰胺凝膠電泳和免疫印跡技術對蛋白進行分析;但針對大分子蛋白的檢測,聚丙烯酰胺凝膠電泳技術檢測結果缺少大分質子量蛋白的Marker標記,免疫印跡技術主要應用于分子質量較小蛋白的測定,兩種實驗方法都不是對大分子骨架蛋白進行表征的最合適的方法[10-11]。已有研究通過免疫組化技術對骨架大蛋白進行半定量分析,可以清晰觀察目的蛋白的表達及分布[12-13]。
因此,本實驗以草魚作為研究對象,利用免疫組化技術特異性表征冰藏過程中骨架蛋白(伴肌球蛋白、伴肌動蛋白、抗肌營養不良蛋白)的降解情況,結合肌纖維結構、剪切力和滴水損失率等指標的分析,以期闡明冰鮮草魚質構劣化的原因,從而為調控冰鮮淡水魚的質構品質提供理論依據。
1 材料與方法
1.1 材料與試劑
實驗用草魚7 尾,2017年5月中旬購于無錫市濱湖區華潤萬家超市,草魚體質量為(5.0±0.5)kg,體質健康、規格整齊。
伴肌球蛋白抗體、伴肌動蛋白抗體、抗肌營養不良蛋白抗體、山羊抗小鼠IgG(H+L) 美國Proteintech公司;氯化鈉、三氯乙酸(trichloroacetic acid solution,TCA)、十二烷基硫酸鈉(sodium dodecyl s ulfate,SDS)、甘氨酸等均為國產分析純。
1.2 儀器與設備
3K-30型高速冷凍離心機 德國Sigma公司;FE20K型pH計 瑞士Mettler Toledo儀器有限公司;TA-XT2i型物性分析儀 英國Stable Micro Systems公司;UV-1000紫外-可見分光光度計 上海天美科學儀器有限公司;T18高速分散機 德國IKA公司;石蠟包埋機、石蠟切片機、Olympus BH-2生物顯微鏡、H-7500透射電子顯微鏡 徠卡顯微系統(上海)貿易有限公司。
1.3 方法
1.3.1 實驗設計
將草魚剖殺,去頭和內臟,用預冷的自來水沖洗干凈,取背部白色肌肉,切成2 cm×2 cm×2 cm塊狀,并隨機放置于多聚乙烯袋中,封口。將包裝好的草魚塊樣品放入裝有碎冰的塑料泡沫箱,并將其放入4 ℃冰箱中。在貯藏過程中,定時更換碎冰,確保貯藏溫度在(0.0±0.5)℃范圍內。分別在第0、1、3、7、10、14、21天時取樣,對冰藏過程中魚肉骨架蛋白(伴肌球蛋白、伴肌動蛋白、抗肌營養不良蛋白)的降解及超微結構、剪切力、滴水損失率的變化進行測定分析。
1.3.2 免疫組化分析
將魚肉從放滿冰的泡沫箱中取出,用手術刀將魚肉塊切成10 mm×10 mm×3 mm的薄片;用體積分數3%戊二醛溶液(由0.1 mol/L pH 7.4的磷酸鹽緩沖液配制)固定24 h;用不含戊二醛的相同磷酸鹽緩沖液漂洗5 次,每次15 min;采用體積分數30%、50%、70%、80%、90%、95%、95%、100%乙醇分別梯度脫水2 h;分別采用體積分數50%二甲苯、50%乙醇、100%二甲苯、100%二甲苯按順序各浸泡2 h。以上操作均在4 ℃條件下完成。然后在體積分數50%二甲苯、50%石蠟的混合體系中浸泡2 h后,用體積分數100%石蠟浸泡3 次,每次各2 h,在60 ℃下完成浸蠟操作。將蠟塊固定于切片機上進行切片,切片厚度為6 μm。
參照Cruz-Rico等[14]的方法對切片進行免疫組化分析。取1 500 mL檸檬酸三鈉溶液(0.01 mol/L、pH 6.0)于壓力鍋中,大火加熱直至沸騰;將脫蠟水化后的組織切片置于耐高溫塑料切片架上,浸入已沸騰的緩沖液中,熱蒸汽修復20 min,自然冷卻至室溫;使用磷酸鹽緩沖液(0.01 mol/L、pH 7.4)清洗3 次,每次5 min;使用免疫組化油性筆,圈出組織樣本位置;用5 g/100 mL脫脂奶粉溶液封閉30 min;吸去多余的封閉液,滴加稀釋的一抗溶液(空白對照組以0.01 mol/L pH 7.4磷酸鹽緩沖液替代抗體),將含有抗體的濕盒在4 ℃冰箱孵育過夜。第2天將濕盒從冰箱拿出,室溫放置15 min復溫;用磷酸鹽緩沖液(0.01 mol/L、pH 7.4)清洗5 次,每次5 min;吸去多余的磷酸鹽緩沖液,滴加第二抗體,室溫孵育30 min;再次使用磷酸鹽緩沖液(0.01 mol/L、pH 7.4)清洗5 次,每次5 min,免疫組化顯色;隨后蘇木素復染;梯度乙醇脫水,二甲苯透明,中性樹膠封片。
采用BH-2生物顯微鏡觀察拍照:先用肉眼觀察選取染色均勻、無氣泡、無斷裂、形狀完整的切片;然后在低倍鏡下觀察,找到厚度適宜、均勻平展、無污染的樣品優質區后,用高倍鏡觀察;當發現了重點目標時,進行拍照。顯色部分為目的蛋白的表達區。
使用IPP軟件對免疫組化圖片進行光密度灰度(integrated option density,IOD)分析,并按式(1)計算各個骨架蛋白的降解率。

式中:A為冰藏前IOD;B為冰藏后IOD。
1.3.3 超微結構觀察
超微結構觀察參照Ullah等[15]的方法并加以改進。將魚肉從放滿冰的泡沫箱中取出,用手術刀將魚肉切成1 mm×1 mm×1 mm的薄片,加入2 倍體積的體積分數2.5%戊二醛溶液(0.1 mol/L pH 7.4磷酸鹽緩沖液配制)預固定1 h;然后更換一次緩沖液,4 ℃過夜;將魚肉在2 倍體積的磷酸鹽緩沖液(0.1 mol/L,pH 7.4)中沖洗10 min;用體積分數70%、80%、95%、100%乙醇梯度脫水10 min;脫水后在丙酮和環氧樹脂的混合液(1∶1,V/V)中室溫浸泡過夜,次日用環氧樹脂包埋(60 ℃聚合)。超薄切片機切片,切片厚度為70 nm。切片用透射電子顯微鏡觀察并拍照。
1.3.4 剪切力測定
剪切力指標的測定參照Zang Jinhong等[16]的方法。采用質構儀測定草魚魚肉的剪切力,注意刀片平行于肌肉纖維的方向切割,速率2.0 mm/s,觸發力5 g,壓縮形變60%,刀片接觸魚肉后,以到達的最大峰值表征剪切力。
1.3.5 滴水損失率測定
滴水損失率的測定參照Mu Gang等[17]的方法并加以改進。取不同冰藏時間下的草魚,用濾紙輕輕拭去肉樣表面滲出水分并稱剩余肉樣的質量,按式(2)計算魚片的滴水損失率。
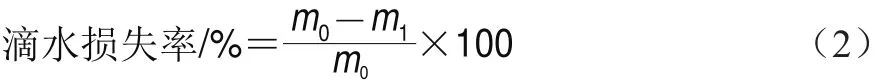
式中:m0為冰藏前魚片的質量/g;m1為冰藏后魚片的質量/g。
1.4 數據處理與分析
采用SPSS 19.0對數據進行統計分析,采用Duncan’s多重分析進行組間顯著性檢驗,P<0.05表示差異顯著。并用Origin 8.6軟件作圖。
2 結果與分析
2.1 草魚在冰藏過程中伴肌球蛋白的降解
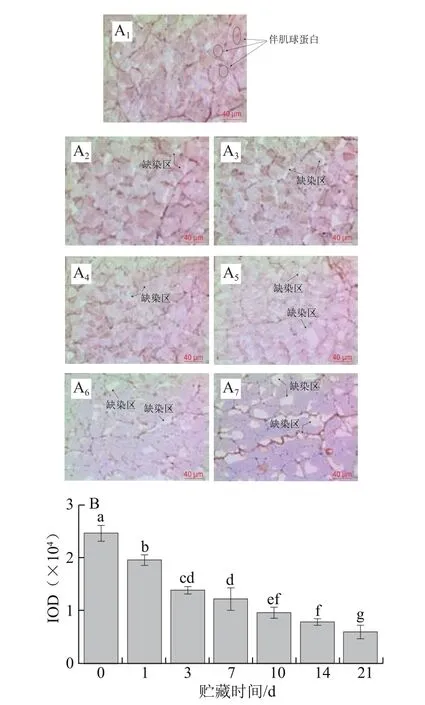
圖1 草魚在冰藏過程中伴肌球蛋白的免疫組化分析Fig. 1 Immunohistochemistry analysis of titin in ice-stored grass carp
伴肌球蛋白是分子質量約為3 000 kDa的肌原纖維大蛋白,約占肌原纖維質量的10%,間跨了半個肌節的長度,橫跨整個半肌小節,將Z線連接到肌節中的M線,C端和M線交迭[18]。伴肌球蛋白可以與抗體發生免疫陽性反應,呈現出棕褐色區域塊。如圖1A、B所示,冰藏1~3 d,褐色變淺且缺染區出現,說明在此期間伴肌球蛋白已發生降解;隨著冰藏時間的延長,伴肌球蛋白的降解程度逐漸增加,冰藏前3 d伴肌球蛋白已降解43.78%;冰藏第7~10天棕褐色變為淺褐色,降解率下降了10.59%;冰藏第14~21天褐色面積大幅度減少,缺染區增多,最終冰藏21 d時伴肌球蛋白的IOD由初始24 620減少至5 882,降解率達76.10%。實驗結果表明冰藏前期伴肌球蛋白降解較快,后期降解較慢。研究發現,豬肉成熟過程中,伴肌球蛋白在冷藏前期降解較慢,冷藏后期降解速率反而較快[19]。Annderson等[20]研究發現,牛宰后前3 d伴肌球蛋白降解達70%,同時牛肉嫩度增加。這說明伴肌球蛋白的降解速度和程度隨動物品種存在差異。
2.2 草魚在冰藏過程中伴肌動蛋白的降解
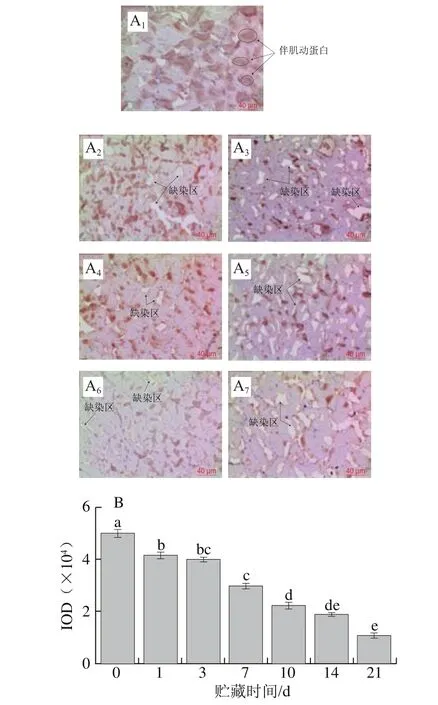
圖2 草魚在冰藏過程中的伴肌動蛋白的免疫組化分析Fig. 2 Immunohistochemistry analysis of nebulin in ice-stored grass carp
伴肌動蛋白是一種約600~900 kDa的高分子質量蛋白質,在肌原纖維蛋白中的質量分數約為5%,其多肽鏈橫跨肌纖維I帶并延伸至A帶,起著聯接肌動蛋白和Z盤的作用[21]。由圖2A、B可知,伴肌動蛋白在冰藏第1天伴肌動蛋白IOD降低了8 100,降解了17.53%;冰藏第3天出現缺染區且整體顏色變淡,在第7~10天缺染區增大,說明伴肌動蛋白在冰藏7~21 d期間逐步降解;冰藏第14天褐色變成淺褐色,冰藏第21天缺染區域大幅度增多,最終伴肌動蛋白IOD下降至10 982,降解率高達78.21%。牛肉中同樣發現伴肌動蛋白在貯藏期前7 d很容易發生降解,同時伴隨剪切力下降[22]。魚肉伴肌動蛋白的降解情況和雞肉[23]有所不同,雞肉樣品在第1天和第3天成熟時,聚丙烯酰胺凝膠電泳出現降解帶,但第1天和第3天的樣本之間沒有發現明顯的差異,這是由于雞肉中蛋白和酶的體系與魚肉中蛋白和酶的體系完全不同;雞肉體系中骨架蛋白的降解有利于雞肉的成熟嫩化,但是淡水魚中骨架蛋白降解會導致魚肉質構軟化,所以控制骨架蛋白降解對提高魚肉品質是十分必要的。伴肌球蛋白和伴肌動蛋白是維持肌原纖維結構完整性的主要蛋白,其降解會導致肌原纖維結構的破壞[24]。現有研究表明內源蛋白酶是影響蛋白降解的主要因素[11],故后續研究可以通過抑制蛋白酶活性延緩骨架蛋白的降解。
2.3 草魚在冰藏過程中抗肌營養不良蛋白的降解
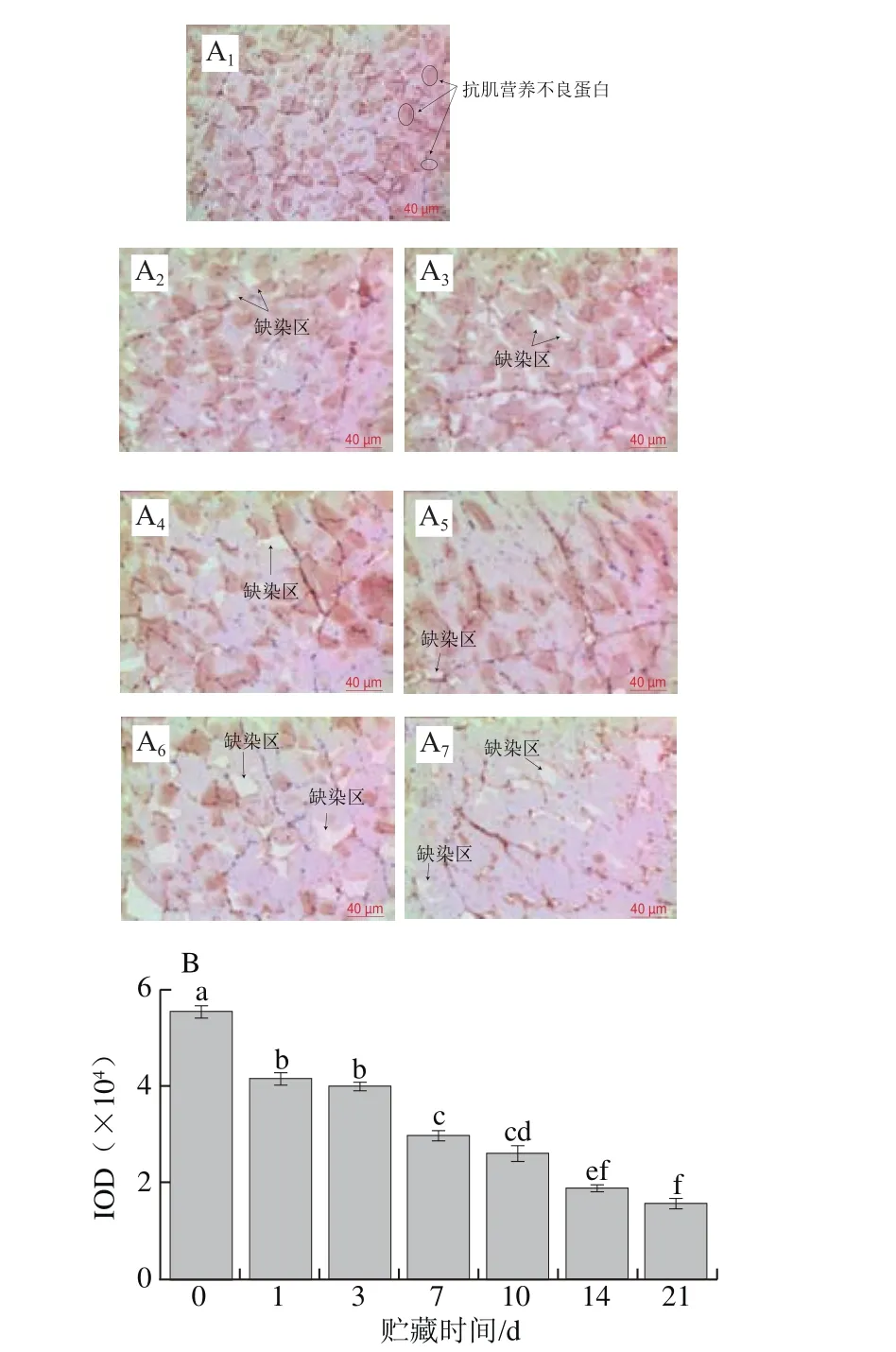
圖3 草魚在冰藏過程中的抗肌營養不良蛋白的免疫組化分析Fig. 3 Immunohistochemistry analysis of dystrophin in ice-stored grass carp
抗肌營養不良蛋白位于膜和肌動蛋白之間,它的破壞會導致Z線、M線、中間絲狀體斷裂,進而會造成肌纖維之間以及肌纖維與肌膜之間發生解離,引起肉品質構劣化[25]。圖3A所示為草魚冰藏期間背部肌組織上抗肌營養不良蛋白的表達、分布以及其含量的變化,肌細胞膜上出現強度不一的棕黃色完整條帶。抗肌營養不良蛋白的降解隨著貯藏時間的延長呈增加趨勢,前7 d降解率近60%。在貯藏1 d的樣品中沒有發現抗肌營養不良蛋白的降解,這表明抗肌營養不良蛋白前期以完整的形式存在于樣品中;冰藏第3天顏色變淡并開始出現缺染區,在7~10 d顏色變化不明顯,且缺染區面積無明顯變化;冰藏第14~21天,顏色由褐色變為淡褐色,缺染區明顯增大;第21天時抗肌營養不良蛋白IOD降為15 982,降解率達71.14%。李經倫等[26]利用免疫組化技術表征小鼠抗肌營養不良蛋白的表達,發現隨著飼養時間的減少淡染或缺染的情況顯著。也有研究表明,抗肌營養不良蛋白的降解使骨架蛋白遭到不可逆的破壞,從而使得細胞膜結構不穩定,不能抵抗肌纖維的伸縮牽拉而損傷[27]。
2.4 草魚在冰藏過程中組織超微結構
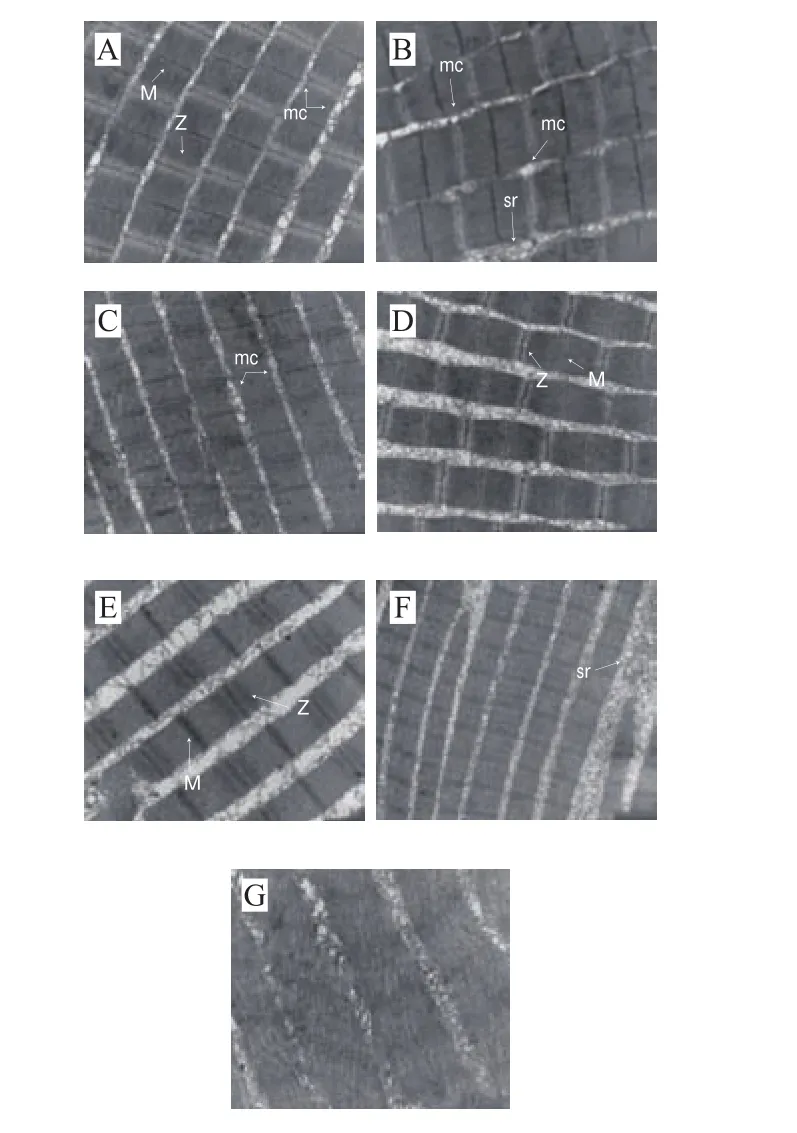
圖4 草魚在冰藏過程中的超微結構Fig. 4 Ultrastructure of ice-stored grass carp
如圖4所示,新鮮草魚肌原纖維結構排列整齊無空隙,可清晰觀察到肌節、明暗帶、M帶、Z帶的分布情況;冰藏第1天,肌纖維M帶、Z帶保持完整,具有清晰的明暗帶分布;冰藏第3~7天,草魚肌原纖維間隙擴大、扭曲斷裂,肌漿網囊泡聚集在纖維間隙,Z帶被破壞,其余條帶及肌節結構尚完整;在冰藏第10天,肌纖維雖然排列整齊,但M帶基本被破壞,明暗帶不分明,結合伴肌球蛋白和伴肌動蛋白所處位置,說明這兩種蛋白已開始降解;冰藏的第14天,肌原纖維結構破裂為分散的塊狀,各肌節條帶均模糊不清,M帶基本完全消失;冰藏的第21天,草魚肌原纖維結構松散,M帶、Z帶完全消失,明暗帶模糊,肌漿網溶解,說明各骨架蛋白大部分已降解,組織結構完全解離[28],草魚組織結構隨著冰藏時間的延長逐漸劣化。伴肌球蛋白可以將粗肌絲與Z線聯結以維持肌原纖維的完整性和穩定性[29],但隨冰藏時間延長,魚背肌中伴肌球蛋白降解程度變大,肌原纖維的穩定性變差,魚肉質構劣化嚴重。Takahash等[30]推測,伴肌動球蛋白的降解造成肌纖維結構的變化,破壞了原來肌纖維內部的緊密結構,使得肌肉舒張,質構劣化。草魚肌肉組織學形態與質構密切相關,在冰藏過程中草魚骨架蛋白的降解參與并影響魚肉質構的劣變[31]。
2.5 草魚在冰藏過程中剪切力和滴水損失率的變化
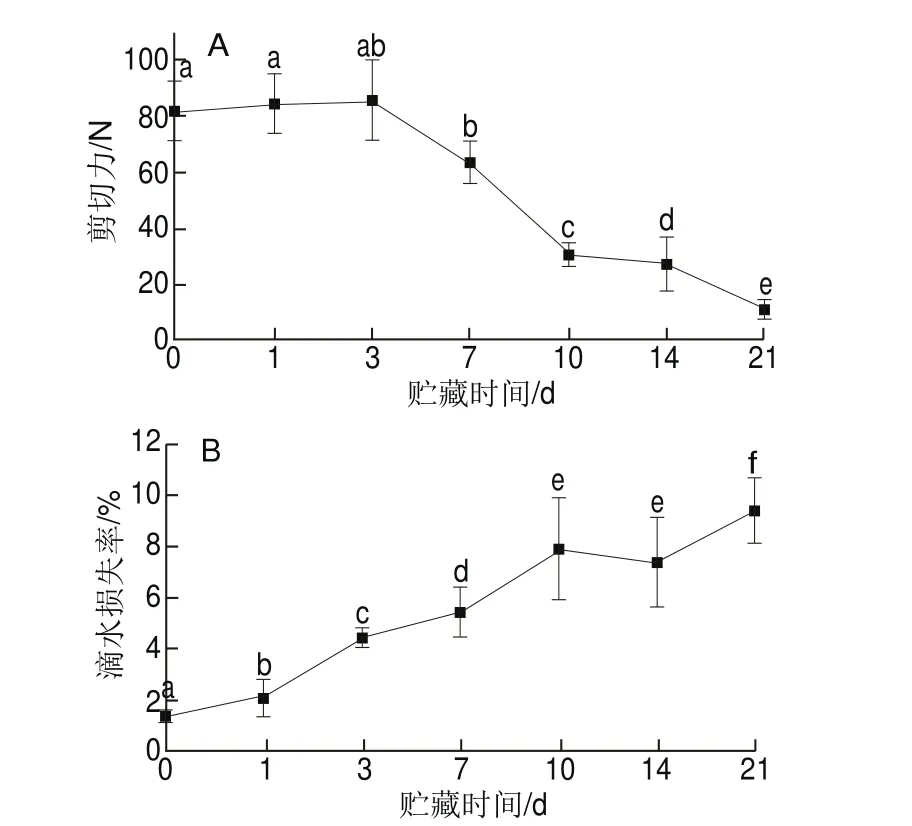
圖5 草魚在冰藏過程中的剪切力(A)和滴水損失率(B)變化Fig. 5 Changes in shear force (A) and drop loss (B) of ice-stored grass carp
剪切力和滴水損失率都是表征魚肉貯藏過程中質構變化的重要指標。剪切力測定模擬魚肉被牙齒咬斷咀嚼過程中的用力變化情況,因此能直觀表征魚肉質構品質[32];滴水損失率可以衡量肌肉蛋白質保持水分的能力,直接影響肉的風味、質地、多汁性等,與品種和肌肉部位等因素有關[33]。如圖5A、B所示,草魚冰藏第1天有滴水損失,在冰藏第1~3天,草魚肌肉出現僵直現象,且前3 d剪切力上升,但不顯著;在冰藏初期剪切力上升是肌肉進入僵直狀態的典型特征,隨后下降被認為是因為肌肉解除僵直[34]。冰藏條件下草魚塊的剪切力在10 d內由81 N快速下降至32 N,剪切力降低了60.49%;同時冰藏7~10 d滴水損失急劇增大,第10天滴水損失率達到初始值的4.9 倍。冰藏10 d內滴水損失率由1.6%增加至7.8%。第21天剪切力下降至11 N,相比冰藏第0天魚肉剪切力降低了86%;草魚冰藏第10~14天,滴水損失率無顯著變化。骨架蛋白降解會導致肌原纖維網格結構破壞,最終導致整個肌細胞結構損壞,系水能力變差,滴水損失率增加[35]。已有研究發現肌肉的滴水損失可歸因于細胞骨架蛋白的加速降解[36]。影響魚肉品質的因素很多,但歸結到肌肉的生理生化水平上,蛋白質的變化對持水性的影響尤為重要,特別近年來的研究發現骨架蛋白降解程度加深的同時,質構劣化,汁液流失增加[37]。
2.6 草魚在冰藏過程中骨架蛋白IOD與剪切力和滴水損失率的相關性分析結果
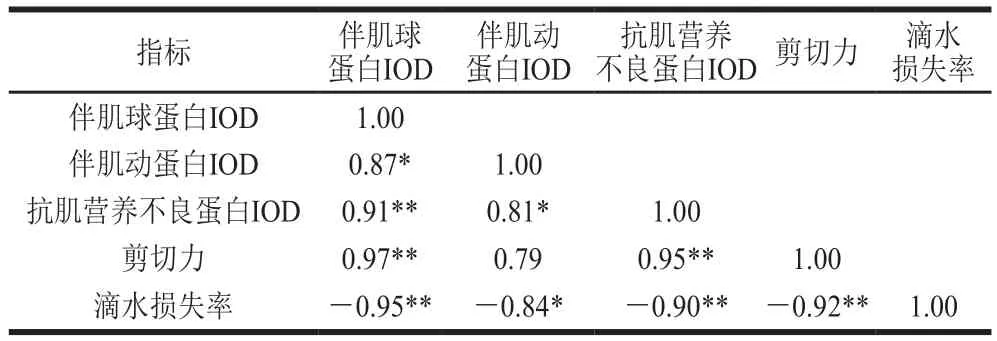
表1 草魚冰藏過程中各指標相關性分析Table 1 Correlation analysis between cytoskeleton proteins and shear force and drip loss in ice-stored grass carp
如表1所示,剪切力與伴肌球蛋白IOD、抗肌營養不良蛋白IOD均呈極顯著正相關(P<0.01),相關系數分別為0.97、0.95;滴水損失率與伴肌球蛋白、伴肌動蛋白、抗肌營養不良蛋白的IOD呈顯著負相關(P<0.05,P<0.01),相關系數分別為-0.95、-0.84、-0.09。骨架蛋白的降解使得Z盤弱化,M帶、Z帶完全斷裂,各蛋白間的鏈接細絲被破壞,細胞間隙增大,肌原纖維降解成數個肌節組成的串聯體或小片段形式[23];整個降解過程最終導致細胞功能的喪失和肌原纖維結構的削弱,使得魚肉剪切力下降,質構劣化。肌肉中的水分與蛋白質的極性基團結合形成水合離子而留存于蛋白質的空間結構中,這是肌肉具有持水性的原因[38];實驗結果表明肌肉系統中伴肌動蛋白和伴肌球蛋白的完整性可能影響系水力[39]。吳霜等[40]同樣發現滴水損失率與伴肌球蛋白和伴肌動蛋白的完整度有正相關性;這可能是由于伴肌球蛋白和伴肌動蛋白處于組織細胞明帶處,它們的降解會導致肌細胞收縮變形,形成汁液流失通道,加速滴水損失。但是,由于各個骨架蛋白在細胞內所處的位置及功能的不同,其與滴水損失率呈現出的相關性也不同。實驗結果進一步表明骨架蛋白的降解加速了魚肉質構劣化,影響其體內固化水的硬度和分布,導致冰藏過程中滴水損失率增加、剪切力下降,從而導致質構劣化。
3 結 論
骨架蛋白(伴肌球蛋白、伴肌動蛋白、抗肌營養不良蛋白)與冰藏條件下的草魚質構密切相關。草魚伴肌球蛋白、伴肌動蛋白、抗肌營養不良蛋白都隨著冰藏時間的延長而降解,且各骨架蛋白的IOD與剪切力均呈正相關,與滴水損失率均呈負相關。草魚組織結構隨著冰藏時間的延長逐漸劣化,說明骨架蛋白的降解參與并影響魚肉質構的劣變。然而,魚肉體系中骨架蛋白的降解途徑還有待進一步研究分析。

