兩種飼養方式下蘇尼特羊肉中鮮味物質含量及相關調控基因表達量
羅玉龍,劉 暢,李文博,王柏輝,竇 露,趙麗華,杜 瑞,王政綱,靳 燁*
(內蒙古農業大學食品科學與工程學院,內蒙古 呼和浩特 010018 )
蘇尼特羊是我國優良的綿羊品種,其產肉性能好、膻味輕、肉質鮮美,有很高的營養價值[1];其飼養方式以傳統放牧為主,隨著國家限牧政策的施行,部分飼養模式已轉變為舍飼。舍飼飼養羊的生產潛力雖有提高,但其風味品質已呈現出下降趨勢。鮮味是衡量羊肉風味的一項重要指標,核苷酸與呈鮮味氨基酸等決定了肉質鮮味,這些成分通過與舌上皮細胞的G蛋白偶聯受體作用產生味感[2]。研究發現,肌苷酸(inosine monophosphate,IMP)是鮮味最強的物質,能夠提高肉的鮮味[3-4]。目前的研究集中于雞、魚等動物,對羊肉中鮮味物質的研究還比較少。翁麗萍等研究養殖與野生大黃魚的鮮味物質,發現野生大黃魚滋味鮮美的原因與其肉中高含量的IMP有關[5]。張會豐等研究發現籠養雞肌肉中IMP含量顯著低于散養雞[6]。閆俊書等發現放養雞的肉更鮮,這與放養使雞的運動強度提高、代謝活動增強,從而提高了肉中IMP含量有關[7]。而鮮味物質的形成同時受多種酶的調控,其中腺苷-磷酸脫氨酶(adenosine monophosphate deaminase 1,AMPD1)、腺苷酸琥珀酸裂解酶(adenylosuccinate lyase,ADSL)、次黃嘌呤核苷酸環水解酶(aminoimidazole carboxamide ribonucleotide transformylase,ATIC)起關鍵作用,而這3 種酶的基因也是肉鮮味研究的候選基因[8]。
因此,本實驗通過對放牧和舍飼條件下的蘇尼特羊肉進行電子舌測定,從味覺指標上評價兩者差異,進而分析蘇尼特羊肉的鮮味物質含量以及相關調控基因表達量,并分析鮮味物質與調控基因之間的聯系,為蘇尼特羊肉鮮味物質的形成機理提供理論依據,為改進飼養管理模式、改善羊肉風味品質提供參考。
1 材料與方法
1.1 材料與試劑
從內蒙古烏拉特中旗畜牧業蘇尼特羊育種園區內隨機選擇放牧與舍飼兩種飼養條件下健康無病的12 月齡蘇尼特羊各10 只(公、母各5 只)。舍飼飼養以飼草料(玉米秸稈、葵盤粉等,并補充玉米精料及育肥飼料)為主,放牧飼養則以烏拉特中旗天然草原牧場中的牧草(芨芨草、蒙古蔥、沙生冰草、堿韭等)為主。
三乙胺、氯仿、無水乙醇、磷酸、高氯酸(均為分析純) 北京國藥集團試劑公司;甲醇、次黃嘌呤(hypoxanthine,HYP)標準品、肌苷(inosine,INO)標準品、IMP標準品、二磷酸腺苷(adenosine diphosphate,ADP)標準品、一磷酸腺苷(adenosine monophosphate,AMP)標準品(均為色譜純) 美國Sigma公司;焦碳酸二乙酯 美國Thermo Fisher公司;RNAiso Plus、6×loading buffer、Marker DL2000、Premix Taq?Version 2.0、PremeScriptTMRT reagent Kit with gDNA Eraser、SYBR?Premix Ex TaqTM大連寶生物工程有限公司。
1.2 儀器與設備
1260型高效液相色譜儀 美國安捷倫公司;5810-R型低溫臺式冷凍離心機 德國Eppendorf公司;BG-power5000型穩壓穩流電泳儀 北京百晶生物科技有限公司;水平電泳槽、凝膠成像分析儀、CFX96TM實時熒光定量聚合酶鏈式反應(quantitative real-time polymerase chain reaction,qPCR)儀 美國Bio-Rad公司;普通PCR儀 美國Applied Biosystems公司;TS-5000Z型電子舌 北京盈盛恒泰科技公司。
1.3 方法
1.3.1 羊肉的處理
對所選取20 只蘇尼特羊現場屠宰,宰前禁食24 h,禁水2 h,在宰后的1 h內從羊的背最長肌、臂三頭肌以及股二頭肌各取約2 g肌肉放入無菌無酶管中,于-80 ℃保藏待用,用于鮮味物質及調控基因的測定;另各取約50 g肌肉于-20 ℃保藏,進行電子舌測定。
1.3.2 滋味檢測
稱取切成肉糜狀的羊肉10 g,加入100 mL 0.1 mol/L KOH溶液,磁力攪拌30 min后3 000 r/min、4 ℃離心10 min,取上清液80 mL用于電子舌測試。
電子舌分析條件[9]:傳感器在RefSol參比溶液(30 mmol/L KCl溶液與0.3 mmol/L酒石酸溶液混合液)中歸零30 s,達到平衡后于樣品溶液中進行鮮味測定。測試時間為30 s,用參比溶液清洗330 s,再于參比溶液中進行回味測定30 s,每個樣品重復測定3 次。
1.3.3 鮮味物質含量測定
取1 g肉樣置于10 mL離心管中,加入4 mL體積分數5%高氯酸后勻漿;勻漿液3 500 r/min、4 ℃離心5 min后取上清液過濾,調至pH 6.5,濾液轉移至25 mL棕色容量瓶定容,取1 mL溶液用0.45 μm水系濾膜過濾,用于高效液相色譜分析。
色譜條件:C18色譜柱(250 mm×4.6 mm,5 μm);流動相,體積分數5%甲醇+體積分數95%磷酸-三乙胺溶液;流速0.7 mL/min;柱溫25 ℃;紫外檢測波長254 nm;進樣量20 μL;運行時間34 min。
混合標準品標準曲線:取混合標準品系列工作液重復測定3 次后取平均峰面積。以相應鮮味物質峰面積對其質量濃度進行線性回歸,得到各標準品的回歸方程。通過標準曲線計算鮮味物質含量。
1.3.4 基因表達量的測定
1.3.4.1 qPCR引物設計合成
引物序列如表1所示,AMPD1、ATIC、ADSL、18S rRNA引物由上海生工生物工程有限公司設計并合成,以18S rRNA作為內參基因。
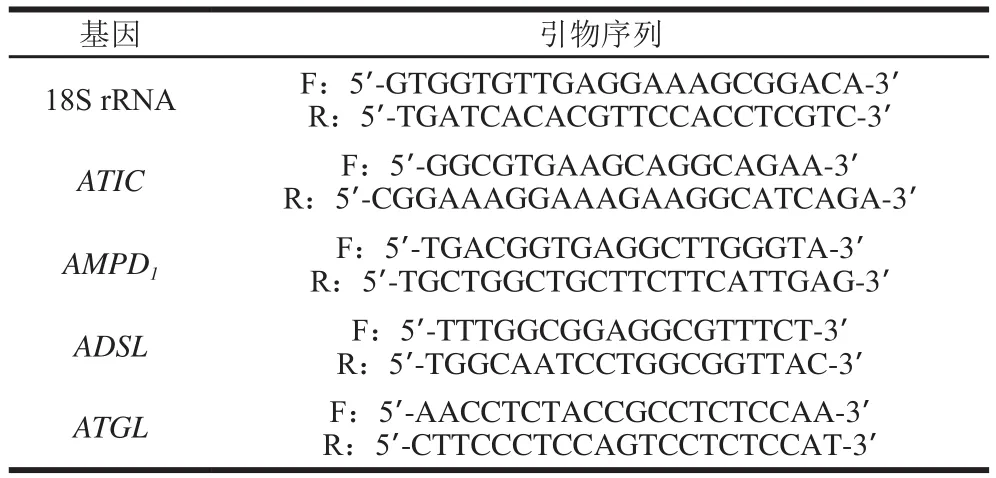
表1 qPCR引物Table 1 Primer sequences used for qPCR
1.3.4.2 總RNA的提取與反轉錄
稱取約100 mg肉樣放入經液氮冷卻的研缽中,研磨至細粉末狀用于RNA提取。參照文獻[10]的方法提取RNA并測定吸光度(A260nm/A280nm)及質量濃度。用質量分數1.5%瓊脂糖凝膠電泳檢測RNA質量。將RNA樣品稀釋至500 ng/μL后反轉錄為cDNA,反轉錄方法參照試劑盒說明書的兩步法進行,將得到的cDNA放入-20 ℃冰箱內保存。
1.3.4.3 qPCR分析
以cDNA為模板,參照試劑盒說明書的兩步法進行qPCR分析[11]。PCR體系為:12.5 μL SYBR?Premix ExTaqTMII (TLi RNaseH Plus)、1.0 μL引物F、1.0 μL引物R、2.0 μL cDNA模板、8.5 μL RNase Free dH2O。程序為:預變性95 ℃、30 s;變性95 ℃、5 s,退火60 ℃、30 s,延伸72 ℃、30 s,35 個循環;延伸72 ℃、10 min。
樣本重復測定3 次,得到不同樣本的Ct值,以18S rRNA為內參基因,采用2-ΔΔCt法計算目的基因的相對表達量。
1.4 數據統計與分析
用SPSS 20.0軟件進行統計學分析,用單因素分析法分析數據差異性,P<0.05時差異顯著;P<0.01時差異極顯著,用雙變量相關分析法(Pearson)分析數據相關性。
2 結果與分析
2.1 兩種飼養方式下蘇尼特羊肉的電子舌檢測結果
屠宰后,由于外界環境和自身反應,羊肉會產生特有的滋味,如蛋白質水解成小分子肽、氨基酸等,其中帶有疏水性氨基酸的肽能產生苦味,而一些核苷酸、谷氨類氨基酸可產生鮮味[12-13]。以電子舌測定味覺指標的無味點為0,無味點以下認為樣品沒有此種味道[14]。本研究中,鮮味、咸味、苦味、澀味和苦味回味均在無味點以上,可以作為有效的評價指標。其中鮮味和咸味對羊肉滋味的影響最大,苦味次之。

表2 兩種飼養方式下蘇尼特羊肉的味覺特征差異分析Table 2 Comparative taste characteristics of meat from Sunit sheep under different feeding patterns
由表2可知,整體上放牧飼養蘇尼特羊肉的鮮味顯著高于舍飼飼養(P<0.05),這反映了放牧飼養蘇尼特羊肉質更為鮮美。在放牧和舍飼兩種飼養條件下,羊臂三頭肌的鮮味均顯著低于背最長肌和股二頭肌(P<0.05),說明肌肉部位也會造成羊肉中的鮮味差異,而背最長肌和股二頭肌的肉質較為鮮美。咸味主要來自肉中的谷氨酸單鈉鹽、天冬氨酸鈉以及氯化鈉等無機鹽[15]。在放牧和舍飼兩種飼養條件下,羊背最長肌的咸味均顯著高于股二頭肌和臂三頭肌(P<0.05);對于同一部位,放牧飼養羊背最長肌的咸味顯著高于舍飼飼養(P<0.05),而其股二頭肌和臂三頭肌的咸味與舍飼飼養差異不顯著(P>0.05)。產生澀味的化學物質主要有明礬類與多酚類等;而苦味則以單寧、苯硫脲為主[16]。在放牧飼養條件下,羊背最長肌的苦味顯著低于臂三頭肌和股二頭肌(P<0.05),但澀味顯著高于股二頭肌(P<0.05)。在舍飼飼養條件下,羊背最長肌的苦味和澀味均顯著低于臂三頭肌和股二頭肌(P<0.05)。整體上,放牧飼養蘇尼特羊肉的苦味和澀味低于舍飼飼養,這是由于放牧飼養羊長期攝入一些草本植物(沙蔥、堿韭、沙茴香等),可有效抑制羊肉中的不良滋味;而舍飼飼養羊長期食用飼料,其肉中積累了大量的單寧,使的肉的苦澀味增加[17]。放牧飼養蘇尼特羊肉鮮味和咸味高于舍飼飼養,苦味和澀味低于舍飼飼養,從味覺指標上評價,放牧飼養羊肉更為鮮美。
2.2 兩種飼養方式下蘇尼特羊肉的鮮味物質含量
蘇尼特羊肉風味優良,“鮮”是其突出的風味特征,肌肉中鮮味的主要來源是一些呈鮮肽類和核苷酸[18]。蘇尼特羊肉中IMP含量較高,且降解緩慢,在很大程度上能夠提高肉的鮮味,被作為評定肉質中鮮味的重要指標[3]。同時,與IMP代謝相關的產物也共同影響著肉的鮮味,包括INO和HYP等[19]。

表3 兩種飼養方式下蘇尼特羊肉的鮮味物質含量Table 3 Comparative contents of umami substances of meat from Sunit sheep under different feeding patterns
由表3可知,放牧飼養條件下,羊背最長肌和臂三頭肌的IMP含量顯著高于舍飼飼養(P<0.05);舍飼飼養條件下,各部位之間IMP含量沒有顯著差異(P>0.05)。整體上,放牧飼養羊肌肉IMP含量高于舍飼飼養,這與張會豐等的研究結果[6]一致。產生差異的原因可能是運動量不同導致了IMP含量的不同,放牧飼養羊運動強度大,其肌肉中的代謝活動會增強,使得ATP含量增加,合成IMP的能力提高,這使得放牧飼養羊的肉質較為鮮美[20];另一方面,放牧飼養羊攝食大量牧草,肉中的抗氧化物質豐富,屠宰后組織細胞膜的完整性得到保護,鮮味物質流失減少,這也提高了IMP含量[21]。
IMP可在磷酸脂酶和核苷水解酶的作用下進一步分解形成INO和HYP[22]。整體上,放牧飼養蘇尼特羊肉的INO含量顯著高于舍飼飼養(P<0.05)。放牧飼養羊背最長肌的INO含量顯著高于臂三頭肌和股二頭肌(P<0.05);舍飼飼養羊臂三頭肌的INO含量顯著低于背最長肌和股二頭肌(P<0.05)。放牧方式對HPY含量沒有顯著影響,但其均在背最長肌中含量最高(P<0.05)。ADP和AMP是形成IMP的前體物質,AMP可在脫氨酶作用下脫氨形成IMP,這兩者在肉中的含量相對較少,在背最長肌中的含量較其他部位更高。對于同一部位,放牧飼養羊臂三頭肌和股二頭肌中AMP含量顯著高于舍飼飼養(P<0.05),但其背最長肌中AMP含量顯著低于舍飼飼養(P<0.05)。造成羊肉中鮮味物質含量差異的原因不僅與運動強度以及攝食飼料不同有關,也與屠宰后肉中IMP等物質的降解程度有關,這些因素造成了放牧飼養羊肉中IMP和相關代謝物比較豐富,從而使肉的鮮味變得濃郁[23-24]。
2.3 兩種飼養方式下調控鮮味物質候選基因表達量
調節控制IMP形成的酶由AMPD1、ADSL、ATIC組成。AMPD1能催化AMP水解、脫氨,生成IMP;ADSL具有催化嘌呤核苷酸的起始合成與循環的雙功能作用,是影響IMP生成的關鍵限速酶;ATIC是一種具有氨基咪唑氨甲酰核苷酸轉甲酰基酶和ATIC催化活力的雙功能酶,能調控IMP的合成[25-26]。

表4 兩種飼養方式下蘇尼特羊肉中調控鮮味物質候選基因表達量的差異Table 4 Comparative expression levels of umami-related genes in meatfrom Sunit sheep under different feeding patterns
由表4可知,放牧飼養羊背最長肌的AMPD1基因表達量顯著高于臂三頭肌和股二頭肌(P<0.05);同時,背最長肌和股二頭肌的ADSL基因表達量顯著高于臂三頭肌(P<0.05);ATIC基因表達量在股二頭肌中最高(P<0.05)。舍飼飼養羊背最長肌和股二頭肌的ADSL基因表達量顯著高于臂三頭肌(P<0.05),與放牧飼養羊呈現一致性。對于同一部位,放牧飼養羊背最長肌的AMPD1基因表達量顯著高于舍飼飼養(P<0.05);股二頭肌的ADSL和ATIC基因表達量顯著高于舍飼飼養(P<0.05)。整體上,放牧飼養羊肌肉中AMPD1、ADSL、ATIC基因表達量較舍飼飼養羊高,進一步調控形成鮮味物質的酶來提高羊肉中的鮮味物質含量,從而使放牧飼養羊肌肉中鮮味物質含量高于舍飼飼養。
2.4 調控鮮味物質基因表達量之間的相關性分析
由表5可知,3 種調控蘇尼特羊肉鮮味物質形成的基因表達量之間均呈正相關,這表明3 種酶在調控IMP形成時有協同促進的作用。其中,放牧飼養蘇尼特羊肉AMPD1表達量與ADSL表達量之間呈極顯著正相關(P<0.01),說明AMPD1基因高表達正向調控ADSL基因的表達,使羊肉中的IMP沉積,改善羊肉的鮮味。研究發現,ADSL基因在嘌呤核苷酸的從頭合成中發揮重要功能,能夠維持肌肉組織中ATP含量與AMP含量的比例,為生成IMP提供前體物質[27];而AMPD1基因調控AMPD1直接催化AMP脫氨生成IMP,這兩種酶協同作用促進了IMP的生成,極大地影響了肉質風味[28]。
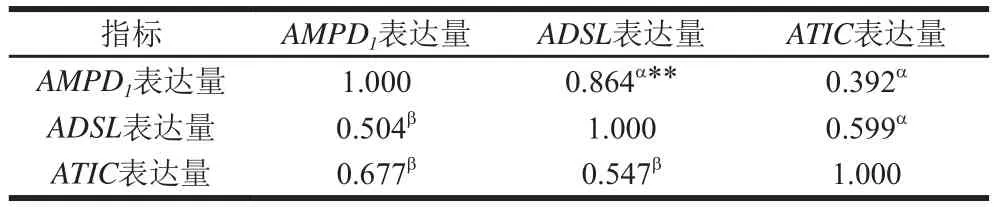
表5 蘇尼特羊肉中調控鮮味物質候選基因表達量的相關性Table 5 Correlations among the expression levels of umami-related genes in meat from Sunit sheep
2.5 IMP含量和調控基因表達量的相關性比較
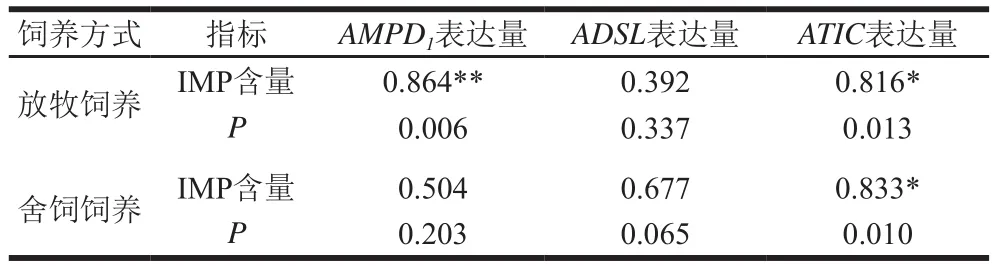
表6 蘇尼特羊肉中調控IMP基因表達量與IMP含量相關性分析Table 6 Correlation analysis between IMP content and the expression of related genes in meat from Sunit sheep
羊肉中IMP含量遠高于其他鮮味成分,其是影響鮮味的主要成分,因此對IMP含量與其調控基因表達量進行相關性分析。由表6可知,放牧飼養蘇尼特羊肉中IMP含量與AMPD1表達量基因之間呈極顯著正相關(P<0.01),IMP含量與ATIC基因表達量之間呈顯著正相關(P<0.05),肉中AMPD1、ATIC基因多態位點的基因型頻率分布與IMP含量具有相關性,是控制羊肉鮮味物質的候選基因,能參與調控肉中IMP等物質的含量[1]。舍飼飼養蘇尼特羊肉中IMP含量與ATIC基因表達量之間呈顯著正相關(P<0.05),與放牧飼養的結果一致,這與羅桂芬等的研究結果[29]一致。這進一步印證了ATIC基因是影響肌肉中IMP含量的主效基因,可調控相關酶的活性,進而改變肉中的IMP含量[30]。整體上,本研究結果表明當IMP調控基因的表達量提高時,肉中的IMP含量也提高。這也印證了IMP與調控基因編碼之間存在著某種作用機制,使得IMP含量和基因表達量的變化趨勢一致。
3 結 論
對蘇尼特羊肉進行味覺評價,發現放牧飼養蘇尼特羊肉鮮味和咸味高于舍飼飼養,苦味和澀味低于舍飼飼養。其中放牧飼養蘇尼特羊肉中的IMP和INO含量高于舍飼飼養;放牧方式對HPY含量沒有顯著影響,但其含量均在背最長肌中最高(P<0.05)。整體上,放牧飼養羊肉的鮮味物質含量高,其肉質更為鮮美。
放牧飼養羊肌肉中AMPD1、ADSL、ATIC基因表達量較舍飼飼養高,其中,放牧飼養羊背最長肌的AMPD1基因表達量顯著高于舍飼飼養(P<0.05),股二頭肌的ADSL和ATIC基因表達量顯著高于舍飼飼養(P<0.05)。這說明通過調控形成鮮味物質的酶可改變羊肉中鮮味物質含量。
鮮味物質調控基因的相關性分析中,3 種基因表達量相互間均呈正相關,其中放牧飼養羊肌肉中AMPD1表達量與ADSL表達量之間呈極顯著性正相關(P<0.01)。IMP含量與其調控基因的相關性分析中,放牧飼養羊肌肉中IMP含量與AMPD1基因表達量之間呈極顯著正相關(P<0.01),IMP含量與ATIC基因表達量之間呈顯著正相關(P<0.05);舍飼飼養羊肌肉中IMP含量與ATIC基因表達量之間呈顯著正相關(P<0.05)。這表明當IMP調控基因的表達量提高時,相關酶的活性提高,肉中的IMP含量也隨之提高。

