脂肪來源干細胞促進糖尿病ED勃起功能恢復的實驗研究
燕 浩 肖冬冬 榮立奪 成 歡 王雅梅 提運榮 張 明 隋曉鋒 盧慕峻*
1.上海交通大學醫學院附屬仁濟醫院泌尿外科(上海 200127);2.東華大學化學化工與生物工程學院(上海 201620)
勃起功能障礙(erectile dysfunction,ED)是指陰莖持續不能達到或維持足夠的勃起,以完成滿意的性生活[1]。ED的病因錯綜復雜,內分泌、血管神經和精神心理等因素均會影響該病的發生和發展[2]。糖尿病是造成ED的常見病因之一,糖尿病患者ED發生率達到35%~90%[3]。目前ED的治療手段,包括磷酸二酯酶抑制劑(PDE5I)、低能量沖擊波治療、經尿道給藥和真空負壓吸引,皆對糖尿病ED患者療效不理想,而陰莖假體植入同樣存在費用高昂、術后感染和機械故障等缺陷[4]。糖尿病ED復雜的發病機制和較差的療效促使人們轉向其他的治療手段。
干細胞因具有自我更新能力和一定條件下的多向分化能力,其中脂肪來源干細胞(Adipose-derived stem cells,ASCs)是近年來從脂肪組織中分離得到的一種多能干細胞[5],其取材方便、來源廣泛、對機體損傷小,并且擁有旁分泌和多向分化功能,被應用于各個組織器官的功能修復。本研究擬采用脂肪來源干細胞治療糖尿病ED大鼠,評價其勃起功能及血管化程度,研究其改善勃起功能的機制。
材料與方法
一、材料
鏈脲佐菌素 (S0130,Sigma, 美國),檸檬酸鈉(1613859,Sigma, 美國), 檸檬酸 (791725,Sigma,美國),胎牛血清(10437028,Gibco,美國)。低糖 DMEM培養基 (21885108,Gibco, 美國), 抗菌 -抗真菌劑(15240062,Gibco,美國),胰蛋白酶(T2600000,Sigma,美國),膠原酶(NB4,SERVA,德國),肝素鈉注射液(國藥集團容制藥有限公司),磷酸緩沖鹽溶液(phosphate buffer saline,PBS)(上海賽戈生物有限公司),DAPI(上海翊圣生物科技有限公司),Masson試劑盒(Solarbio,美國),多聚甲醛(16005,Sigma,美國),雙蒸水(上海交通大學醫學院附屬第九人民醫院),生理鹽水(上海交通大學醫學院附屬第九人民醫院),乙醇(上海交通大學醫學院附屬第九人民醫院),兔抗大鼠CD31抗體(稀釋 1:100,Servicebio);BL420S 多通道生理記錄儀(成都泰盟有限公司)
實驗對象:4只2周齡和30只250g~300g經交配試驗證明勃起功能正常的SD清潔級雄性大鼠,由西普爾-必凱公司提供。
二、方法
(一)大鼠ASCs的分離和提取
按Wang等[6]的方法,取同種異體近交系2周齡SD雄性大鼠,無菌狀態下取大鼠腹股溝處的脂肪組織,放入PBS中洗凈血污,再用抗菌-抗真菌劑清洗一遍后,轉入新的培養皿中。將組織切剪成1mm×1mm的糜狀物,加入消化液(0.075%膠原酶NB4,其余為DMEM),移液器充分打勻,直到組織可以通暢的出入吸嘴。加入含有血清的培養基,混勻并分裝入細胞培養瓶中,放入CO2培養箱中培養。間隔48h換1次液。細胞傳代培養至第三代后,吸去培養瓶中的培養基,用PBS清洗細胞3次,加入0.25%的胰蛋白酶消化,顯微鏡下觀察ASCs聚集成群后終止消化,放入離心管離心,棄去上清液重懸后,取細胞懸液100μL顯微鏡下計數得出細胞密度,按1:1的體積與PBS混勻,終密度調整為106/mL。
(二)實驗分組
選取12周齡性成熟的30只雄性SD大鼠,隨機分成3組(每組10只),A組為正常組(血糖正常的SD大鼠),B組為PBS組 (糖尿病ED大鼠單純注射PBS治療),C組為ASCs組 (糖尿病 ED大鼠海綿體注射ASCs治療)。所有大鼠采用標準飼料喂養,自由采食和飲水,適應環境一周。
(三)糖尿病ED大鼠模型的構建
禁食過夜后,正常組在腹腔注射生理鹽水,另外兩組注射生理鹽水溶解的鏈脲佐菌素(streptozotocin,STZ)60mg/kg,自由采食和飲水。分別在給藥后72h連續測3次隨機血糖,然后每周測一次血糖和身高體質量直到12周實驗結束。血糖連續>16.7mmol/L可視為糖尿病[7]。
(四)陰莖海綿體內注射
建立起糖尿病ED模型并提取ASCs后,進行海綿體內注射(intracavernous injection,ICI)手術干預,將大鼠稱量麻醉,暴露陰莖海綿體,ASCs組用微量注射器將200μL脂肪干細胞懸液從大鼠海綿體中部注射,留置5min確保細胞流入海綿體間隙。正常組和PBS組用微量注射器注射等量的生理鹽水,同樣留置5min確保流入海綿體間隙。注射完畢后放入籠中繼續喂養,待12周后進行后續各項測試。
(五)海綿體內壓(intracorporeal pressure,ICP)與平均動脈壓(mean arterial pressure,MAP)比值測定陰莖勃起功能
各組大鼠在治療后飼養至12周進行勃起功能檢測,將大鼠麻醉固定,腹部作一正中切口,暴露前列腺,在前列腺背側尋找盆神經,然后通過神經剝離器將盆神經及陰莖海綿體神經分離出來。切開陰莖及其上方靠近腹部的皮膚,剪開包皮并剝離至陰莖腳位置,充分暴露陰莖海綿體;于左側陰莖海綿體中部用25G規格的、充滿肝素溶液的靜脈輸液針進行穿刺,進針的角度約為10°到20°,防止角度過大刺入尿道,若輸液針的導管有回血,證明穿刺成功,穿刺完畢后固定輸液針,另一側通過壓力換能器連接B420S生物信號記錄儀輸入信號接口,準備測量陰莖海綿體內壓。隨后切開頸部皮膚,暴露左頸動脈,將左頸動脈與周圍組織及神經分離,結扎遠心端,動脈夾夾閉近心端后,作一楔形切口,并將充滿肝素溶液的P50導管置于動脈中,然后固定導管,另一側通過壓力換能器連接B420S生物信號記錄儀的輸入信號接口,以監測全身的平均動脈壓。準備完畢后開始進行電刺激,將不銹鋼電極連接B420S生物信號記錄儀的輸出信號接口,將刺激參數設置為5V,20Hz,5ms脈沖寬度和50s持續時間,開始刺激大鼠的陰莖海綿體神經,同時記錄ICP和MAP,在每只大鼠中記錄最大ICP與MAP的比率(ICP/MAP)。
(六)Masson染色
取陰莖中段組織,用4%的多聚甲醛固定過夜,然后用乙醇梯度脫水,包埋在石蠟中,切成4μm厚的薄片,按Masson試劑盒說明書進行染色。用image-J進行分析,每個切片隨機選取6個區域。
(七)免疫熒光染色
選取陰莖中段海綿體2mm組織,用4%的多聚甲醛固定4℃過夜,之后轉移到30%蔗糖PBS溶液4℃過夜,儲存在-80℃,切成10μm冰凍切片,3%的牛血清白蛋白PBS溶液(BSA)室溫孵育20min,然后孵育抗CD31抗體抗體。用image-J進行分析,每個切片隨機選取6個區域。
三、統計學處理
使用SPSS 22.0軟件進行統計學分析,數據以均數±標準差表示。各組數據比較采用單因素方差分析,P<0.05為差異有統計學意義。
結 果
一、大鼠的血糖及體質量變化
正常大鼠血糖始終保持穩定,而糖尿病組大鼠的血糖明顯升高,ASCs組則在升高后出現了一定程度的降低,其最終血糖顯著低于PBS組(P<0.05);PBS組最終體質量相較于正常顯著降低,ASCs組體質量也有一定程度的降低,但其最終體質量與PBS組相比明顯升高,差異有統計學意義(P<0.05),表 1。
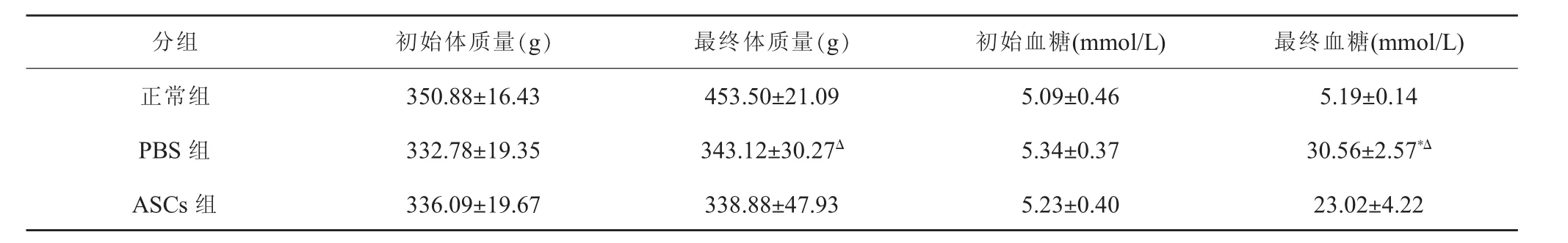
表1 3組大鼠體質量血糖數據
二、大鼠陰莖海綿體組織Masson染色
PBS組的平滑肌/膠原比例顯著低于正常組(P<0.001),ASCs組平滑肌/膠原纖維比例較PBS組增高(P<0.001),差異有統計學意義。
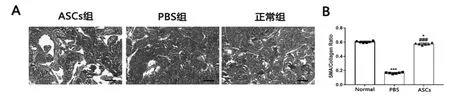
圖1 3組大鼠的Masson染色結果
三、陰莖海綿體壓力測定(ICP/MAP)評價勃起功能恢復
ICP/MAP結果顯示,ASCs組ICP/MAP為(0.6896±0.0260),較 PBS 組(0.3724±0.0137)顯著升高(P<0.001),圖2。
四、免疫熒光
CD31熒光顯示PBS組血管數量(14.50±3.56/mm2)相對正常組(39.33±10.86/mm2)明顯降低(P<0.001),而ASCs組血管數量 (34.00±1.19/mm2) 顯著高于PBS組(P<0.001),圖 3。

圖2 3組大鼠海綿體內壓和平均動脈壓結果
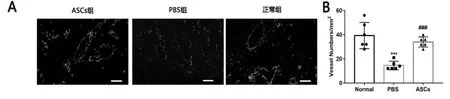
圖3 大鼠陰莖CD31免疫熒光染色結果
討 論
糖尿病是ED常見的病因之一,其發病機制復雜。有學者認為糖尿病損害了陰莖的內皮細胞和平滑肌細胞的結構功能。而陰莖血管內皮細胞的功能和平滑肌細胞數量的穩定對于維持陰莖的勃起功能十分關鍵。陰莖勃起過程本質上是一種神經血管活動,但其受各種心理和生理因素的影響。當人受到一定的性刺激時,下丘腦或骶髓低級中樞會發出沖動,神經沖動傳至陰莖海綿體,在副交感神經神經末梢釋放的神經型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和內皮細胞釋放的內皮型一氧化氮合酶 (endothelial nitric oxide synthase,eNOS)的催化下,一氧化氮(nitric oxide,NO)的合成釋放明顯增多,NO進入平滑肌細胞內,激活鳥苷酸環化酶(guanylyl cyclase,GC),使平滑肌細胞內的環磷酸鳥苷 (cyclic guanosine monophosphate,cGMP)增多,從而導致細胞內鈣離子濃度降低,平滑肌細胞舒張,動脈血流量增加,陰莖海綿體膨大變硬從而產生勃起。由于PDE5I依賴上述過程的完整性,一旦內皮細胞和平滑肌細胞功能受損,PDE5I的作用將會受到限制,因此,學者嘗試采取各種手段對糖尿病引起的陰莖損傷進行修復。
隨著干細胞在組織工程領域研究的深入,目前已有多種干細胞用于各類組織器官修復的研究報道,如骨髓間充質干細胞(BMSCs)、脂肪源性干細胞(ASCs)和肌源性干細胞(MSCs)等[8]。ASCs主要通過旁分泌和多向分化兩種方式進行組織再生修復,其多向分化潛能主要體現在其可以分化成脂肪細胞[9]、骨和軟骨細胞[10]、內皮細胞[11]和上皮細胞[12]等多種細胞。而其旁分泌作用主要體現在其可以分泌多種細胞因子,在促進血管化、趨化作用和調節免疫中發揮了重要作用。其分泌的促血管的細胞因子包括血管活性生長因子(vascular endothelial growth factor,VEGF),腦源性神經營養因子(brain derived neurotrophic factor,BDNF), 成纖維細胞生長因子等[13,14]。由此可見ASCs在治療糖尿病ED方面有著巨大的潛能。
本研究成功建立糖尿病ED大鼠模型,并從大鼠腹股溝脂肪分離脂肪源性干細胞進行陰莖海綿體注射治療。通過大鼠的海綿體測壓,以及對海綿體組織切片進行Masson染色和CD31免疫熒光染色,我們發現ASCs具有促進糖尿病ED大鼠勃起功能恢復的潛力。其中PBS組的ICP/MAP及血管數量較正常組顯著降低,而ASCs組的ICP/MAP顯著高于PBS組,證明糖尿病大鼠經ASCs海綿體內注射治療后,勃起功能得到一定程度的改善。而其海綿體組織的平滑肌數量和血管數量也得到了一定程度的提升,我們推想ASCs能夠促進海綿體組織的血管化,提升糖尿病大鼠海綿體的血管密度,保護海綿體的內皮細胞和平滑肌細胞,從而改善勃起功能。根據我們的前期研究[15],ASCs能通過旁分泌作用促進SDF-1/CXCR4通路改善膀胱組織的血管化,因此,ASCs可能在海綿體組織局部旁分泌某些生長因子,激活通路傳導、促進血管化,延長平滑肌細胞和內皮細胞的存活時間,從而改善勃起功能。Maarten等的[16]研究也表明,干細胞治療ED的相關機制并不是直接分化為血管內皮細胞或平滑肌細胞,而是通過旁分泌的方式,相關機制有待進一步深入研究。
本研究通過大鼠糖尿病ED動物模型建立,以及海綿體注射ASCs治療糖尿病ED,初步發現ASCs能夠通過促進陰莖海綿體血管及平滑肌再生,改善糖尿病大鼠的勃起功能,提示ASCs是潛在的糖尿病ED的治療手段。

