感赤星病煙葉的真菌群落結構分析
劉 暢, 汪漢成, 謝紅煉, 陳乾麗, 余知和, 孫光軍
(1.長江大學 生命科學學院, 湖北 荊州 434025; 2.貴州省煙草科學研究院, 貴州 貴陽 550081; 3.長江大學 農學院, 湖北 荊州 434025; 4.貴州大學 農學院, 貴州 貴陽 550025; 5.貴州省煙草專賣局, 貴州 貴陽 550003)
煙草是我國重要的經濟作物,但其病原菌較多,如由煙草白粉病菌(ErysiphecichoracearumDC.)引起的煙草白粉病[1]、由鏈格孢病菌(Alternaraiaalternata)引起的煙草赤星病[2]、由莖點霉病菌(Phomasp.)引起的莖點霉葉斑病[3]、由灰葡萄孢病菌(BotrytiscinereaPer. et Fries)引起的煙草灰霉病[4]、由多主棒孢霉病菌(Corynesporacassiicola)引起的棒孢霉葉斑病[5]、由煙草野火病菌(Pseudomonastabaci)引起的煙草野火病[6]等。在煙草進入成熟采烤期后,煙草葉片通常較易感病,且條件適宜時多種病害常混合發生,未采取藥劑防治的情況下,病害造成的損失可達50%以上[7]。病害的準確診斷是病害科學防治的關鍵,傳統的診斷方法通常基于病害的危害癥狀。然而,煙草葉片成熟后期,多種病害常混合發生,引起的病癥通常難以辨認;且葉片被侵染后,環境中的腐生菌也易在葉片上定植與危害,進而形成復雜的危害癥狀。此外,局部特殊的氣候環境也會引起復雜的危害癥狀。
近年來,貴州烤煙主產區銅仁市和黔東南煙區,煙草赤星病嚴重發生,且造成嚴重的經濟損失。在煙草染感赤星病的過程中,有哪些病原菌及腐生病菌會共同侵染,以及在共同侵染過程中的菌群組成情況鮮有報道。擴增子測序的分析技術可以準確了解環境樣品的群落結構,已被用于土壤及葉際微生物多樣性的分析[8-10]。然而,將其用于煙草赤星病的葉際微生物多樣性分析還未見報道。為此,以貴州黔東南感赤星病的煙葉為研究對象,分析該地區田間感赤星病煙葉的葉際真菌群落結構,為指導該地區煙草赤星病的防治提供科學依據。
1 材料與方法
1.1 樣品采集
2018年8月29日,在貴州省黔東南州煙區煙草赤星病發生嚴重的煙田進行樣品采集。在田間隨機選取3株嚴重感赤星病的煙葉,編號分別為YBBqdL1、YBBqdL2、YBBqdL3,剪刀經酒精消毒后剪取發病葉片,置于無菌取樣袋并分別編號。將樣品放入低溫保藏箱,并迅速帶回實驗室,置于―80℃的冰箱保存、備用。
1.2 試劑盒及測序系統
GeneJET 膠回收試劑盒和Ion Plus Fragment Library Kit 48 rxns 建庫試劑盒,均購自Thermo fisher公司。IonS5XL測序系統由北京諾禾致源科技股份有限公司提供。
1.3 樣品DNA提取、擴增及測序
采用CTAB法對煙葉樣品進行DNA提取,具體方法參照李淵等[11]的研究。吸取1000 μL CTAB裂解液至2.0 mL EP管里,加入溶菌酶,將適量的樣品加入裂解液中,65℃水浴,期間顛倒混勻數次使樣品充分裂解。樣品總DNA提取完畢后,濃度和純度使用NanoDrop測定,純度A260/A280值要求在1.8~2.0。
1.4 ITS文庫構建及高通量測序
以樣品DNA為模板,采用引物ITS5-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC-3′)對樣品的ITS區進行PCR擴增。PCR擴增體系為30 μL:2×Phusion High-Fidelity PCR Master Mix with GC Buffer 15 μL,引物(2 μmol/L)3 μL,gDNA(1 ng/μL)2 μL,最后用滅菌的ddH2O將反應體系補至30 μL。PCR反應程序參數:98℃預變性1 min;98℃變性10 s,50℃退火30 s,72℃延伸30 s,30個循環;最后72℃延伸5 min。PCR擴增產物用2%的瓊脂糖凝膠進行電泳檢測其擴增質量,使用GeneJET膠回收試劑盒純化產物。將合格的純化樣品送至北京諾禾致源科技股份有限公司,使用Ion Plus Fragment Library Kit 48 rxns建庫試劑盒進行文庫的構建,構建好的文庫經過Qubit定量和文庫檢測合格后,使用Thermofisher的IonS5XL進行測序。
1.5 測序數據處理與統計分析
將IonS5XL下機數據導出fastq文件,即為測序得到的原始數據(Raw Reads)。根據barcode序列區分各個樣本的數據,barcode允許的錯配數為0,最大引物錯配數為2。質控使用Cutadapt軟件(V1.9.1,http://cutadapt.readthedocs.io/en/stable/)進行。使用UCHIME(UCHIME Algorithm,http://www.drive5.com/usearch/manual/uchime_algo.html)進行嵌合體過濾,得到用于后續分析的有效數據。使用Uparse(version v7.0.1001)對所有樣本的Effective Tags以97%的一致性(Identity)進行OTUs(Operational Taxonomic Units)聚類,用Mothur方法與SILVA(http://www.arb-silva.de)的SSUrRNA數據庫對OTUs的代表序列進行物種注釋分析(設定閾值為0.8~1),研究各樣本的物種組成,得到每個樣品的OTUs和分類譜系的基本分析結果。再使用Qiime軟件(Version 1.9.1)對OTUs進行豐度、Alpha多樣性指數等分析,同時對物種注釋在各個分類水平上進行群落結構的統計分析。最后在以上分析的基礎上,進行一系列的基于OTUs、物種組成的聚類分析等統計比較分析。以上分析均在北京諾禾致源科技股份有限公司完成。
2 結果與分析
2.1 ITS序列測序深度及數據質控
稀釋曲線(Rarefaction curve)展示了不同樣品間多樣性的差異。樣本曲線的延伸終點的橫坐標位置為該樣本的測序數量。從圖1看出,3個樣品的稀釋曲線在測序深度為20 000 reads時趨于平緩,表明測序已趨于飽和,增加測序數據無法再找到更多的OTU,因此,測序深度已經覆蓋到樣品中所有的物種,測序數據量足以反映樣品中的物種多樣性。
感赤星病的3煙株葉部樣品(YBBqdL1、YBBqdL2、YBBqdL3)原始序列經優化處理后,共得到240 311條高質量序列片段,56 761 121個堿基,單一樣本序列數在80 054~80 161條,序列平均長度為236 bp,共檢測到172個OTUs。
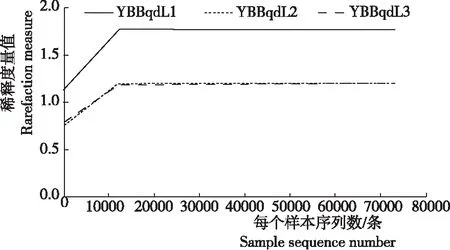
圖1樣品測序稀釋曲線(OTU水平shannon指數)
Fig.1 Rarefaction curve for sequencing samples(Shannon index of OTU level)
2.2 OTU聚類
從表1看出,在97%的相似度水平對樣品序列進行OTU聚類,3個不同葉片樣品共鑒定得出真菌5個門,13個綱,23個目,32個科,37個屬,28個種,172個OTU。
從圖2看出,在OTU水平下,3個樣本之間真菌種類較為接近,共有的OTU種類遠高于單個樣本中獨有的種類。
2.3 微生物多樣性指數
從表2看出,YBBqdL1樣本檢測到的真菌OTU數量略高于YBBqdL2與YBBqdL3。3個樣品的覆蓋度指數均到達到1,表明測序結果合理。豐富度指數Chao1、Ace均為YBBqdL3樣本真菌群落豐富度高于YBBqdL1與YBBqdL2。多樣性指數Shannon、Simpson中,YBBqdL1樣本多樣性均高于YBBqdL2與YBBqdL3。譜系多樣性指數中,YBBqdL3樣本高于YBBqdL1與YBBqdL2。
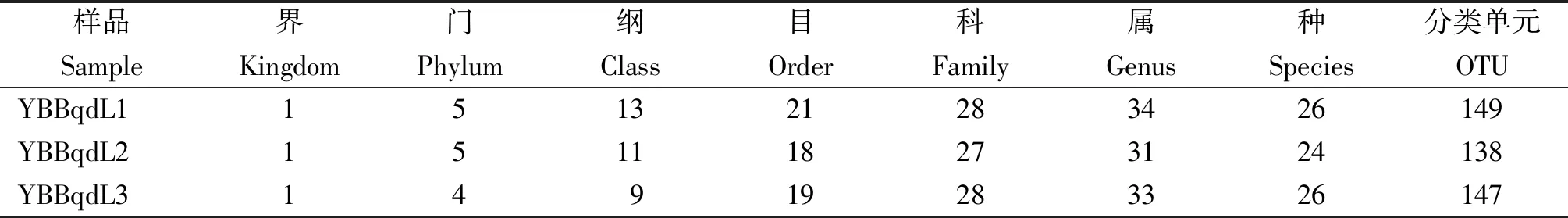
表1 感赤星病煙株葉片真菌群落不同分類水平總量

圖2赤星病真菌群落Venn圖分析結果
Fig.2 Venn diagram illustrating with brown spot disease of mycoflora
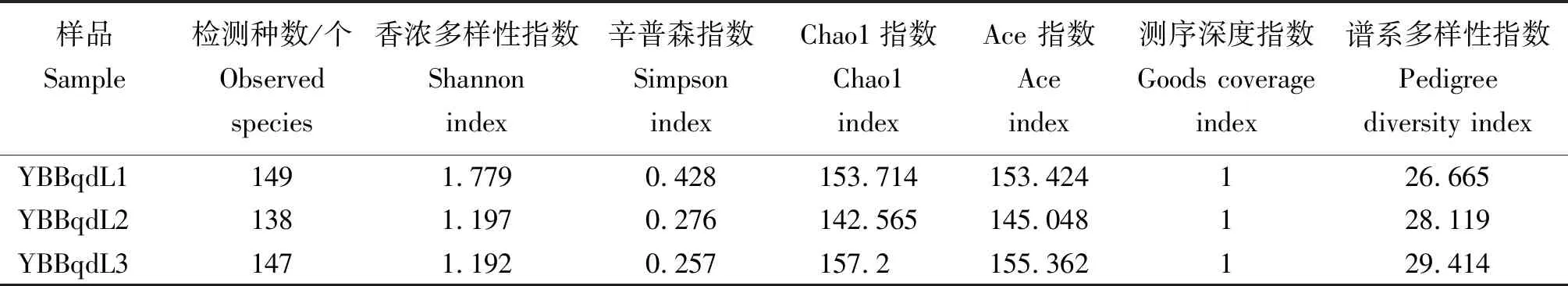
表2 不同樣本真菌群落Alpha多樣性指數
注:Ace和Chao指數用于表示樣品中細菌群落豐富度;Shannon和Simpson指數用于表示樣品中細菌群落多樣性;Goods coverage指數用于表示樣品測序的覆蓋度,指數值越大,其相應的群落豐富度、均勻度和多樣性越高〔Simpson指數采用Simpson's Index of Diversity(1-D),其計算結果和反映的趨勢與Shannon指數同步〕;譜系多樣性指數反應樣品中物種對進化歷史保存的差異,指數值越大說明物種對進化歷史保存的差異越大。
2.4 真菌群落組成和結構
從圖3看出,門水平上,YBBqdL1的優勢菌為子囊菌門(Ascomycota 79.46%)、擔子菌門(Basidiomycota 1.57%)、壺菌門(Chytridiomycota 0.01%);YBBqdL2的優勢菌為子囊菌門(Ascomycota 86.93%)、擔子菌門(Basidiomycota 0.20%)、壺菌門(Chytridiomycota 0.01%);YBBqdL3的優勢菌為子囊菌門(Ascomycota 93.08%)、擔子菌門(Basidiomycota 0.07%)。屬水平上,YBBqdL1的優勢菌為鏈格孢屬(Alternaria76.04%)、莖點霉屬(Phoma1.88%)、鐮刀霉屬(Fusarium0.43%)、Symmetrospora1.21%)、赤霉菌屬(Gibberella0.29%)、Hannaell0.30%)、粉紅螺旋聚孢霉(Clonostachys0.03%)、枝孢霉屬(Cladosporium0.15%)、Stagonosporopsis0.05%);YBBqdL2的優勢菌為鏈格孢屬(Alternaria85.73%)、莖點霉屬(Phoma0.08%)、鐮刀霉屬(Fusarium0.14%)、Symmetrospora0.13%)、赤霉菌屬(Gibberella0.30%、Hannaell0.01%)、粉紅螺旋聚孢霉(Clonostachys0.01%)、枝孢霉屬(Cladosporium0.19%);YBBqdL3的優勢菌為鏈格孢屬(Alternaria87.23%)、莖點霉屬(Phoma2.34%)、鐮刀霉屬(Fusarium1.81% 、Symmetrospora0.02%)、赤霉菌屬(Gibberella0.40%)、粉紅螺旋聚孢霉(Clonostachys0.24%、Plectosphaerella0.20%)、枝孢霉屬(Cladosporium) 0.12% 、Stagonosporopsis0.17%)。
屬水平下的相對豐度熱圖通過顏色的變化直觀顯示出各樣品豐度前30屬的含量情況(圖4)。使用UPGMA(Unweighted PairGroup Method with Arithmetic mean)算術平均的非加權配對群聚類方法,輸入Bray Curtis距離矩陣,將樣品聚類結果與 各樣品在門水平上的物種相對豐度一同展示。通過顏色變化直觀顯示各樣品豐度前10的門的含量情況(圖5)。熱圖左側的UPGMA聚類樹表明,3個樣本真群落結構存在差異,因而聚集為兩大類。其中YBBqdL2和YBBqdL3樣品群落結構較相似聚集為一類,YBBqdL1樣品聚為一類,但3個樣本總體差異不大。
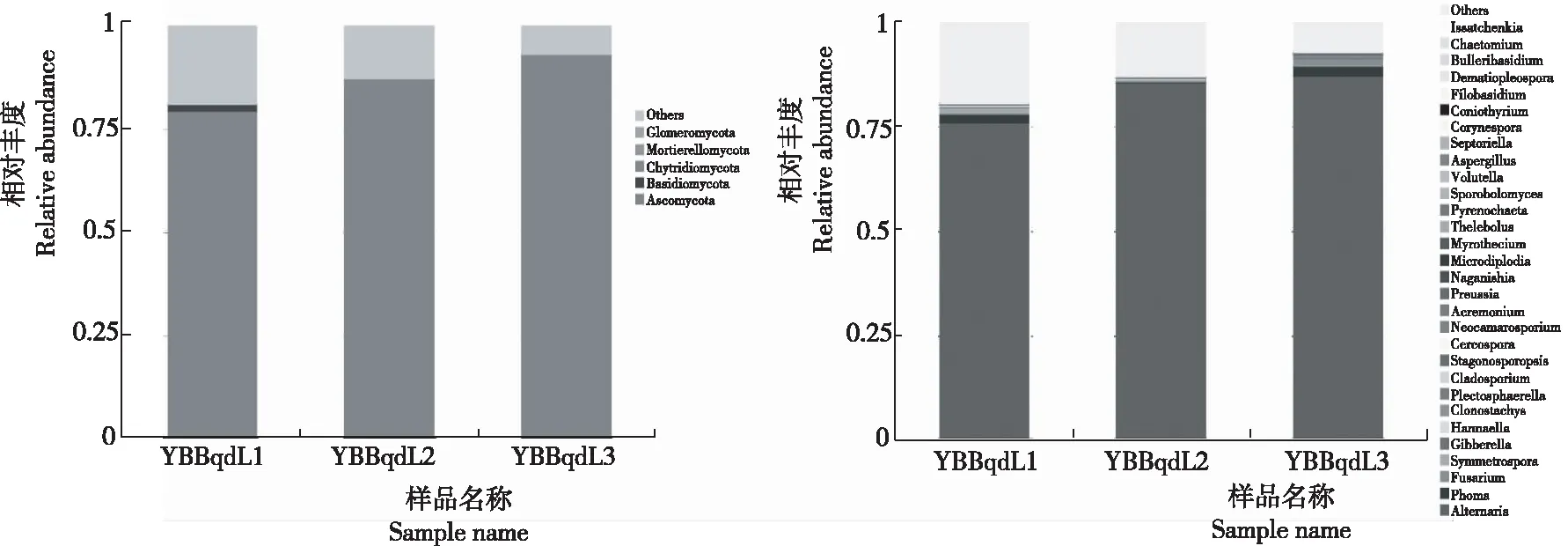
圖3 不同樣品門水平(左)和屬水平(右)的相對豐度
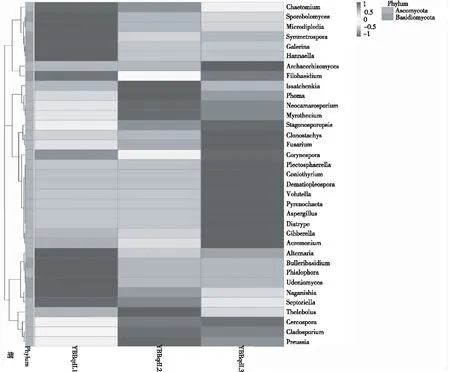
圖4 屬水平各個樣品的相對豐度熱圖

圖5 基于Unweighted Unifrac距離的UPGMA聚類樹
3 結論與討論
植物葉片上含有大量提供植物營養和抗病相關的微生物。近年來,葉際微生物逐漸被人們所關注,并被應用于病害防治研究[12-13]。研究運用高通量測序技術對煙草葉際真菌群落結構進行研究,3個樣品測序的稀釋曲線在測序深度為20 000序列數時就趨于平緩,而作者測序深度為30 000序列數。因此,可以認為測序深度已經覆蓋到樣品中所有的物種,測序數據量足以反映樣品中的物種多樣性。原始序列經優化處理后,3個樣本共得到240 311條高質量序列片段,共檢測到172個OTUs。研究結果證實了高通量測序技術在煙草赤星病葉際真菌群落結構和多樣性上的可行性。
多年生產經驗和諸多研究均證實,煙草赤星病為煙草生產中后期的主要病害,煙葉上的病斑以赤星病為主[14]。高通量測序結果發現,感病煙葉的優勢病原菌為鏈格孢屬,研究結果與烤煙生產實際一致。根據屬水平上的相對豐度圖還發現,煙草葉際的其他真菌如引起煙草莖點病的莖點霉屬(1.43%)[3]、引起煙草枯萎病的鐮刀霉屬(0.79%)等,這些病原菌是否同樣導致煙草中后期葉部病害以及其與優勢病原菌鏈格孢屬之間的關系還有待進一步研究。植物病原菌如枝孢霉屬(Cladosporium0.15%)、赤霉菌屬(Gibberella0.29%、Stagonosporopsis)[15]等是否也會引起煙草葉部病害還需相關致病力試驗驗證;植物內生真菌粉紅螺旋聚孢霉Clonostachys(0.01%)是多種植物病原真菌重寄生真菌,被認為是已發現的拮抗微生物中最具潛力的植病生防因子之一[16],其在煙草中后期葉部病害的防控中或具有一定作用。
Ion S5XL高通量測序技術已用于煙草赤星病的葉際微生物測序分析[17],現階段的結果有利于了解煙草赤星病的葉際真菌群落結構及多樣性,為進一步研究煙草赤星病的防控奠定了基礎。但測序樣本數量有限,且只局限于貴州省黔東南州一個地區,今后的研究中有待進一步增加樣本數量,擴大采樣范圍,從而使結果更具普遍性。考慮到煙草赤星病為真菌型病害,對葉際真菌群落結構及多樣性的影響較大,所以僅分析了真菌群落結構及多樣性,并未分析感病煙株葉際細菌群落結構與多樣性,相關研究有待在下一步陸續開展。

