免疫共沉淀法測定14-3-3ε蛋白與Cdc25B的相互作用
李瑞林,孟 峻,劉 儒
(內蒙古醫科大學第一臨床醫學院,內蒙古醫科大學附屬醫院檢驗科,呼和浩特 010050;*通訊作者,E-mail:nmfrank@163.com)
小鼠卵母細胞減數分裂是一特殊的阻滯過程,因卵母細胞發育需要,減數分裂會停滯在生發泡期(germinal vesicle,GV),即G2期末。由生發泡期到生發泡破裂期(germinal vesicle breakdown,GVBD)是卵母細胞第一次減數分裂恢復的過程,相當于有絲分裂G2/M期的過渡[1,2]。關于小鼠卵母細胞減數分裂G2期阻滯的機制研究已成為當前國內外的研究重點。目前一些研究者認為蛋白激酶A(protein kinase A,PKA)/14-3-3ε/細胞分裂周期蛋白25B(cell division cycle 25B,Cdc25B)/成熟促進因子(maturation promoting factor,MPF)通路在卵母細胞減數分裂過程及G2期阻滯中具有調節作用,但關于Cdc25B蛋白和14-3-3ε蛋白是否存在相互作用及其作用位點尚不清楚。而免疫共沉淀利用抗原抗體結合的高特異性,已成為研究蛋白與蛋白相互作用的經典方法[3],本研究采用免疫共沉淀法研究Cdc25B蛋白和14-3-3ε蛋白的相互作用及其具體的作用位點,為小鼠卵母細胞減數分裂G2期阻滯的機制研究提供實驗依據。
1 材料與方法
1.1 細胞株及組織
HEK293細胞購自中國科學院細胞庫。小鼠肝組織經昆明雄性6-8周小鼠解剖后獲得,由內蒙古大學提供。
1.2 主要試劑
克隆載體pGEM-T vector(Promega公司,美國),表達載體pcDNA3.1-ZEO(Invitrogen公司,美國),pEGFP C3載體由復旦大學劉喻博士惠贈,pBSK-CDC25B-WT、pBSK-CDC25B-S321A、pBSK-CDC25B-S321D由內蒙古醫科大學微免研究室保存,DH5α感受態菌株(上海澤生生物技術有限公司),質粒DNA純化試劑盒(Promega,美國),DNA快速純化/回收試劑盒(上海澤生生物技術有限公司),牛血清白蛋白(BSA,Fraction V,鹽城賽寶生物科技有限公司),fuGENG6轉染試劑(Roche Molecular Biochemicals,德國),免疫共沉淀試劑盒(上海生工生物有限公司)。
1.3 主要儀器
基因擴增儀(Biometra,德國),凝膠自動成像儀(GDS8000BIO-RAD,美國),紫外分光光度儀(PⅥ UNIcAM SPECTRONIC,英國),CO2培養箱CBll5(WTB-binder,德國)。
1.4 pcDNA3.1-ZEO-HA-14-3-3ε表達載體的構建
用Trizol提取小鼠肝組織(30 mg)RNA,設計14-3-3epsilon引物(NM-009536.4):5′-GACCGTGCCTGCAGGTTGC-3′和5′-CTTGCCAGTGTGGCCGGAGA-3′,預計產物長度545 bp,RT-PCR擴增,PCR產物經回收純化,將回收純化的HA-14-3-3ε克隆到pGEM-T載體上,將正確的HA-14-3-3ε陽性克隆與pcDNA3.1-ZEO(+)載體用EcoR Ⅰ酶切后連接,構建成pcDNA3.1-ZEO-HA-14-3-3ε表達載體,經凝膠電泳鑒定此重組載體是否插入正確。
1.5 pEGFP-Cdc25B表達載體的構建
將pBSK-CDC25B-WT、pBSK-CDC25B-S321D、pBSK-CDC25B-S321A三種重組質粒和載體pEGFP-C3分別用BamH Ⅰ和XhoⅠ雙酶切,反應體系在37 ℃水浴環境中反應3 h。酶切反應后,用1.5%瓊脂糖凝膠電泳檢測酶切產物,回收CDC25B-WT、CDC25B-S321D、CDC25B-S321A、pEGFP-C3的cDNA片段,通過OD260 nm判斷其回收產量,用于載體重組。將回收片段進行連接反應,取2 μl連接產物轉化感受態細胞E.coliJM109,按常規轉化方法進行,涂板過夜。挑取單菌落在含Kana(+)的培養基上培養12 h,后用質粒提取試劑盒提取質粒,取2 μl質粒用XhoⅠ和BamH雙酶切鑒定。選擇酶切片段為1 800 bp的陽性克隆保存,并行序列測定,構建成pEGFP-Cdc25B-WT,pEGFP-Cdc25B-Ser321A,pEGFP-Cdc25B-Ser321D表達載體。
1.6 HEK293細胞培養和轉染
HEK293細胞培養于DMEM培養液(含100 U/ml青霉素,10% FBS,10 μg/ml鏈霉素),于37 ℃、5%CO2、98%飽和濕度培養箱。用fuGENG6轉染劑轉染HEK293細胞,轉染過程嚴格按照fuGENG6轉染說明書進行。轉染組分為四組,分別為5μg pEGFP-Cdc25B-WT和5 μg pcDNA3.1-ZEO-HA-14-3-3ε(Cdc25B-WT+14-3-3ε組);5 μg pEGFP-Cdc25B-Ser321A和5 μg pcDNA3.1-ZEO-HA-14-3-3ε(Cdc25B-Ser321A+14-3-3ε組);5 μg pEGFP-Cdc25B-Ser321D和5 μg pcDNA3.1-ZEO-HA-14-3-3ε(Cdc25B-Ser321D+14-3-3ε組);5 μg pEGFP-Cdc25B-Vector和5 μg pcDNA3.1-ZEO-HA-14-3-3ε(Cdc25B-vector+14-3-3ε組)。
1.7 免疫共沉淀法測定14-3-3ε蛋白與Cdc25B S321位點的結合
加Protein G-瓊脂糖到含過濾片的柱子中,PBS洗滌瓊脂糖,低速離心洗四次。HEK293細胞轉染48 h后,4 ℃ 800 r/min離心3 min,收集細胞。吸棄上清并用預冷的PBS洗滌細胞兩次,完全去除PBS并保留細胞沉淀,用玻璃勻漿器勻漿30-50次,間隔1 min,重復3次。然后12 000 r/min離心5 min,收集上清液作為細胞裂解液。在新的微量離心管中加入細胞裂解物,PMSF和鼠單克隆抗HA抗體,4 ℃孵育1 h至過夜,將細胞裂解液轉移到裝有洗滌過Protein G-瓊脂糖柱中,孵育2 h至過夜。將每個柱子中插入轉移到2 ml的新微量離心管中。離心去掉上清,用IP緩沖液洗滌沉淀瓊脂糖珠子5-6次,加入上樣緩沖液,輕輕混合珠子,密封柱子。在95 ℃加熱5 min,用薄紙或濾紙吸干蓋子周圍的水。將柱子插入到新的微量離心管中,以12 000g離心30 s,獲得免疫沉淀物。
用Western blotting分別檢測細胞裂解液和免疫沉淀物中Cdc25B和14-3-3ε蛋白的表達,經細胞裂解、提取蛋白、制膠、電泳、轉膜、封閉及抗體孵育,通過化學發光及成像獲得免疫印跡結果圖,如免疫沉淀物中抗HA抗體和抗GFP抗體均存在(2條帶均顯影,判定為二者結合),表明Cdc25B和14-3-3ε相互結合,此實驗中使用鼠單克隆抗HA抗體1 ∶800用于檢測外源性表達的14-3-3ε蛋白,抗-GFP抗體1 ∶8 000用于檢測外源性表達的Cdc25B蛋白。
2 結果
2.1 重組質粒pcDNA3.1-ZEO-HA-14-3-3ε
使pcDNA3.1-ZEO-HA-14-3-3εcDNA片段亞克隆至pmax-FP-Red-C表達載體中,用EcoR Ⅰ酶切重組質粒,經凝膠電泳鑒定可見4 800 bp的載體帶及800 bp的目的帶(見圖1),說明亞克隆成功。
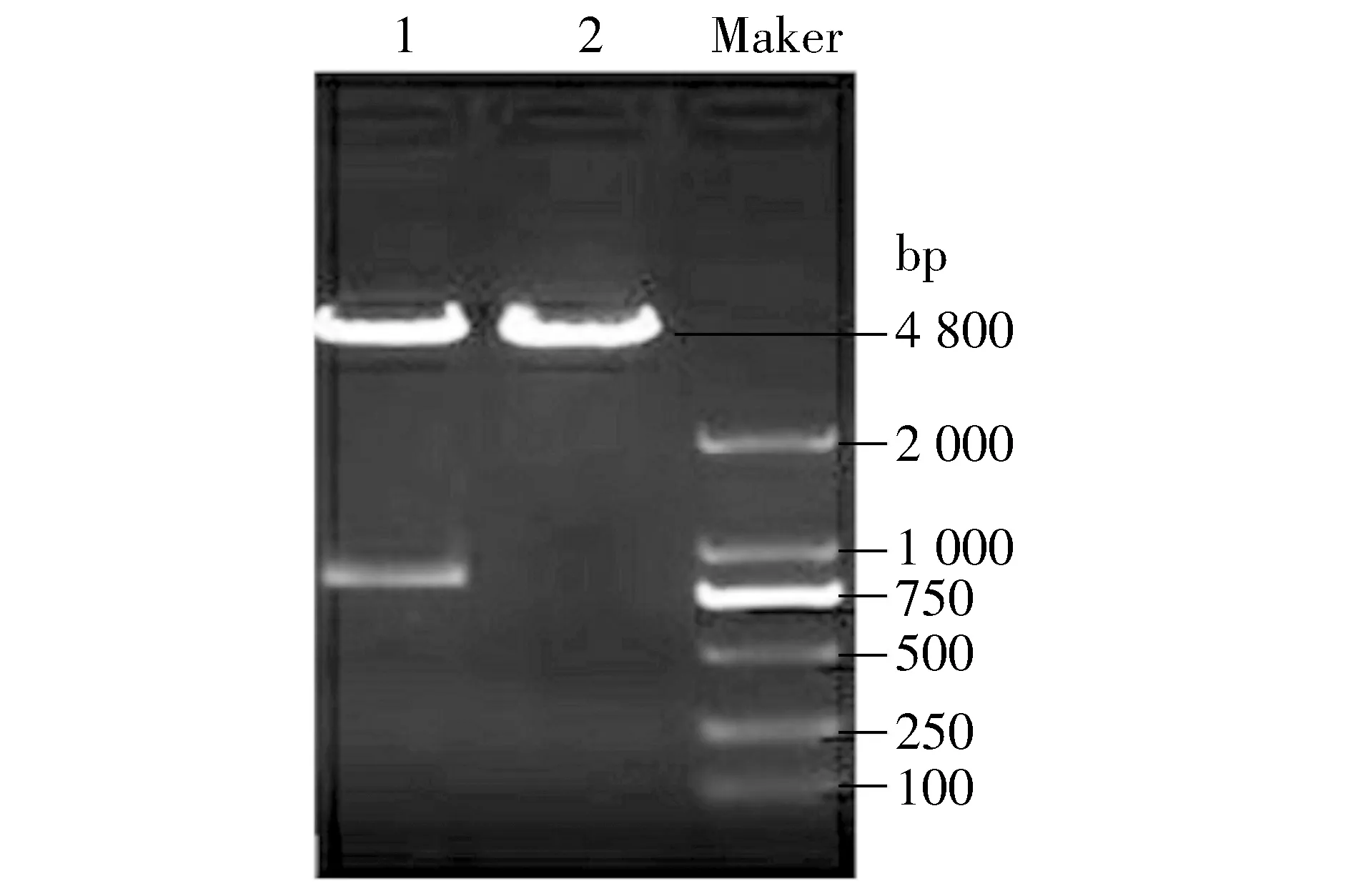
Marker.DL2000 DNA;1.pmax-FP-Red-HA-14-3-3ε;2.pmax-FP-Red-C圖1 重組質粒EcoR Ⅰ單酶切鑒定結果Figure 1 Identification of pmax-FP-Red-HA-14-3-3ε plasmid after digested by EcoR Ⅰ
2.2 三種重組質粒的測序及鑒定
雙酶切pEGFP-Cdc25B-Ser321A、pEGFP-Cdc25B-WT、pEGFP-Cdc25B-Ser321D三種重組表達載體,經瓊脂糖凝膠電泳后可見約5 000 bp的載體條帶及1 800 bp的目的條帶(見圖2),與預期結果一致,經上海澤生測序證明重組體構建成功。
2.3 14-3-3ε和Cdc25B的免疫共沉淀結果
在各組細胞裂解中,除了Cdc25B-Vector組外,Cdc25B和14-3-3ε蛋白均有表達(見圖3);而在免疫沉淀物中,Cdc25B-WT和Cdc25B-S321D均與14-3-3ε蛋白有共沉淀(見圖3),表明兩者結合;而Cdc25BS321A與14-3-3ε無共沉淀(見圖3),表明兩者未結合。

Marker.DL15000 DNA;1.pEGFP-Cdc25B-WT;2.pEGFP-Cdc25B-Ser321A;3.pEGFP-Cdc25B-Ser321D圖2 重組質粒雙酶切鑒定結果Figure 2 Double enzyme digestion of recombinant pEGFP-Cdc25B plasmids

圖3 免疫共沉淀測定14-3-3ε和Cdc25B的相互作用Figure 3 Determination of the interaction of 14-3-3ε and Cdc25B by co-immunoprecipitation
3 討論
Cdc25B是一種絲氨酸/蘇氨酸雙特異性磷酸化酶,是細胞分裂的啟動者,在細胞周期中具有重要的調控作用[4,5]。而14-3-3ε是一高度保守的酸性蛋白,廣泛表達于真核生物體內,以穿梭胞核與胞質的方式調節與之結合的靶蛋白的功能[6,7]。目前諸多研究表明,此蛋白可調節Cdc25B蛋白的活性和亞細胞定位,兩蛋白的結合對細胞分裂進程有重要的調控作用[8]。早期的研究顯示,卵母細胞G2/M期的轉換需要激活Cdc2/cyclinB復合物(MPF),Wee1B/Myt1激酶能磷酸化Cdc2的Thr14和Tyr15,使MPF失活,卵母細胞停滯于G2期。而Cdc25B能使Cdc2的Thr14和Tyr15位點去磷酸化,激活MPF,啟動減數分裂的恢復[9,10]。Yang等[11]的研究發現在爪蟾卵母細胞中,PKA磷酸化Cdc25B的287位絲氨酸(S287),14-3-3ε與磷酸化的Cdc25B S287的結合使得Cdc25B隔離于細胞質不能進入細胞核,不能激活核內的MPF,從而使卵母細胞不能繼續分裂,停滯于第一次減數分裂的G2期。
Astuti等[12]研究表明,PKA可磷酸化Cdc25B的321位絲氨酸,引起GV期阻滯,而突變體S321A能完全解除PKA引起的GV期阻滯,而突變體S149不能解除GV期阻滯,因此Cdc25B的321位絲氨酸在卵母細胞減數分裂中有重要作用。Cui等[13]的研究表明,14-3-3ε通過與Cdc25B結合的方式阻滯小鼠受精卵G2/M期的轉換。Uchida等[14]研究表明:在HEK293細胞中,14-3-3ε通過與Cdc25B的309位絲氨酸結合的方式控制Cdc25B的細胞內定位。那么小鼠卵母細胞是否也存在14-3-3ε,且與Cdc25B在減數分裂恢復過程中是否有相互作用。
本課題組之前對鼠卵母細胞的研究證明了14-3-3ε的存在,且在GV和GVBD期14-3-3ε蛋白的表達量沒有變化[15]。14-3-3ε siRNA使GV到GVBD的發生率為36%,而非小干擾RNA的GV到GVBD的發生率為0,說明14-3-3ε siRNA可促進小鼠卵母細胞的G2/M轉換[16]。為證明14-3-3ε和Cdc25B在調控卵母細胞減數分裂中是否存在聯系,本課題組之前的研究實驗初次證明小鼠卵母細胞的GV期,Cdc25B蛋白和14-3-3ε蛋白共定位于細胞質;在GVBD前,一部分Cdc25B從細胞質進入細胞核;而在GVBD后,Cdc25B和14-3-3ε均勻地分布于整個細胞[17]。此結果表明在GV期Cdc25B和14-3-3ε兩蛋白可能具有相互作用,可能是因Cdc25B蛋白和14-3-3ε蛋白的結合使有絲分裂的Cdc25B隔離于胞質而不能入核,不能繼續進行減數分裂,使卵母細胞發生GV期阻滯。
為了驗證14-3-3ε與Cdc25B確實能結合或有相互作用,本課題組進行了免疫共沉淀實驗。此實驗證明了14-3-3ε與Cdc25B確實能結合,野生型Cdc25B能和14-3-3ε結合;而當Cdc25B的321位絲氨酸突變為丙氨酸時,Cdc25B與14-3-3ε不再結合;當Cdc25B的321位絲氨酸突變為天冬氨酸時,Cdc25B仍然能結合14-3-3ε,說明S321D具有模擬磷酸化的作用。提示14-3-3ε只能與磷酸化的S321結合,而不與未被磷酸化的S321A結合,Cdc25B的321位絲氨酸是14-3-3ε和Cdc25B結合的特異性位點。14-3-3ε和Cdc25B的321位磷酸化的絲氨酸結合,使Cdc25B隔離于胞漿,卵母細胞停滯于G2期,當14-3-3ε和Cdc25B的結合取消時,Cdc25B又可入核,激活MPF,啟動減數分裂。
關于14-3-3ε和Cdc25B的結合取消的分子機制將是以后的研究方向。此次研究初次證明在鼠卵母細胞中,S321是14-3-3ε和Cdc25B結合的特異性位點,PKA磷酸化Cdc25B的321位絲氨酸,磷酸化的321位絲氨酸與14-3-3ε結合引起G2期阻滯,S321是一重要的細胞周期調控靶點。我們可以通過使S321位點的磷酸化和去磷酸化來人為地調控細胞周期進程。通過此位點對細胞周期調控的研究成果可應用于農牧業,提高動物的繁殖數量,滿足人類肉食的需求;也可應用于腫瘤的治療,使腫瘤細胞停滯在G2期,抑制腫瘤的生長;還可用于人類體外輔助生殖技術,縮短受精卵的體外培育時間,盡早植入人體子宮,減少外界因素對受精卵的影響。近年來,不孕不育的患者逐漸增多,人類生殖輔助技術水平雖有很大的進展,然而,這些新技術的實施都需要有受精能力及發育潛力極好的卵母細胞。因此,深入研究卵母細胞成熟調控的機制至關重要。

