紫杉醇納米復合物體內體外抗宮頸癌活性評價
朱彩英 陳武煉 杜 明 徐叢劍,3
(1 復旦大學附屬婦產科醫院宮頸疾病診療中心 上海 200011;2 復旦大學聚合物分子工程國家重點實驗室-高分子科學系 上海 200433;3 上海女性生殖內分泌相關疾病重點實驗室 上海 200011)
宮頸癌是一種常見的女性惡性腫瘤,晚期和復發性宮頸癌是致命的,常常需要化療和放療。紫杉醇(paclitaxel,PTX)是一種被廣泛使用的化療藥,用于治療各種不同類型的惡性腫瘤,包括晚期卵巢癌、宮頸癌、肺癌和其他惡性腫瘤[1-2]。因為缺乏特異的腫瘤靶向性,紫杉醇不僅作用于腫瘤細胞,同時也作用于正常細胞。因此,伴隨著PTX的使用,其毒性作用及不良反應也總是一并出現,如心血管毒性、過敏和神經毒性等。另外,PTX還有個很重要的缺點,即低水溶性。為改善其水溶性,PTX復合溶液中添加了某些助溶劑,但這又進一步增加了助溶劑本身帶來的不良反應。
為減少PTX的不良反應、拓廣PTX的應用,科學家們研究了許多更為安全的藥物載體[1,3]。介孔二氧化硅納米粒(mesoporous silica nanoparticles,MSN)于20世紀90年代[4]被首次提出,與傳統載體相比,具有高度有序、高比表面積、良好生物相容性、易修飾性、無生理毒性等優勢,其作為藥物釋放系統的潛能相繼得到特殊關注[5-8]。然而,如果單純將PTX包裹于MSNs內,不增加“釋藥閥門”,一旦進入體內,攜帶的藥物尚未到達病灶部位,就會被快速釋放和清除,致其不能發揮改善藥物生物利用度的作用[9-10]。
我們先前的研究已經構建了一個以二硫鍵共價鏈接PTX的MSN[11-13],并對其釋藥性能做了初步評估。從材料學分類來講,二硫鍵復合納米粒屬于刺激響應型聚合物,即能識別體內微環境,對刺激進行動態反應。二硫鍵在谷胱甘肽(glutathione,GSH)作用下,發生氧化還原反應,能快速裂解,從而獲得氧化還原刺激響應。研究表明,腫瘤細胞內谷胱甘肽的濃度異常高于血漿(1~10 mmol/Lvs.1~2 μmol/L[14]),因此二硫鍵在輕微氧化環境如細胞外環境和血漿中十分穩定。利用二硫鍵負載藥物的方式,可以選擇性地將藥物釋放于細胞內,而不是血漿中,以此增強藥物作用的靶向性,并減小非靶向部位的毒性作用及不良反應。為對其載藥性能及抗腫瘤效果做全面評估,本文進行了一系列體內和體外研究。
材 料 和 方 法
主要試劑與材料PTX購自北京中化科技有限公司,純度≥98%。青霉素/鏈霉素雙抗溶液和細胞培養基購于美國海克隆實驗室。胎牛血清(Fetal bovine serum,FBS)購自美國Gibico公司。異硫氰酸熒光素(Fluorescein isothiocyanate,FITC)購自日本東京仁成工業株式會社。原硅酸四乙酯(Tetraethyl orthosilicate,TEOS)、3-氨丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,APS)、N-溴化十六烷基三甲銨(N-cetyltrimethylammonium bromide,CTAB)和三甲基苯(mesitylene,TMB)購自美國Sigma-Aldrich公司。Tunel檢測試劑購于瑞士羅氏公司。蘇木精-伊紅染色試劑購于珠海貝索(Baso)生物技術有限公司。負載紫杉醇的熒光介孔二氧化硅納米粒(Paclitaxel-loaded fluorescent mesoporous silica nanoparticles,PTX-FMSN)合成過程詳見于本課題組之前的文獻報導[11-12]。
細胞培養人宮頸癌HeLa細胞由中國科學院(上海)細胞庫贈送。細胞放入培養基中培育,同時加入10%的胎牛血清、100 U/mL的青霉素和100 mg/mL的鏈霉素。細胞培養箱在充分濕化的5% CO2空氣中維持37 ℃恒溫。用于實驗的細胞均處于對數生長期。
體外抗腫瘤實驗將HeLa細胞接種于48孔培養皿中,每孔細胞密度2.4×105,37 ℃孵育24 h,接著放入不同濃度的PTX-FMSN (分別為0.01、0.1、1和5 μg/mL),利用Cell-IQ活細胞工作站連續觀察60 h,分析總細胞數,穩定態細胞數,分裂態細胞數及死亡細胞數,自動計數計算得到細胞的生長曲線。 PTX(濃度分別為0.01、0.1、1和5 μg/mL)和未帶藥FMSN均相同處理。另取3組處于對數生長期的HeLa細胞,分別加入0.1 μg/mL的PTX和相同濃度的PTX-FMSN,以空白FMSN作為對照,37 ℃恒溫孵育,分別于第8、16、24、32、40 h收集細胞,制成1×106/mL細胞懸液,PBS液洗2遍。加入5 mL Annexin V-FITC和碘化丙啶(propidium iodide,PI)混勻,室溫、避光反應15 min,上流式細胞儀觀察和檢測細胞,各組重復3次。
宮頸癌動物模型實驗用4~6周大雌性裸鼠(北京維通利華實驗動物技術有限公司),飼養于南方模式生物SPF動物房,動物飼養環境、模型構建和取材過程均符合《關于善待實驗動物的指導性意見》(科技部2006年9月13日)。0.2 mL內含有1×107個HeLa細胞的溶液經皮下注入裸鼠右側腋下。3天后,可見瘤體形成。
體內抗腫瘤實驗實驗方案經復旦大學附屬婦產科醫院動物倫理委員會審核批準。裸鼠按實驗方案分為4組,每組4只(表1)。成瘤方法如上所述。瘤體長到約100 mm3時,裸鼠按組分別經尾靜脈注入生理鹽水、PTX溶液、未帶藥FMSNs、PTX-FMSNs,每3天重復給藥1次,藥物濃度分別為4、8、12 mg/kg,同時用電子游標卡尺測量腫瘤直徑,按照以下公式測算腫瘤大小:腫瘤體積=1/2×腫瘤長徑×腫瘤短徑。注入腫瘤細胞后21天,經全身生物發光成像后,以水合氯醛(濃度4%,劑量0.20 mL/20 g)鎮靜,1.5%異氟烷吸入麻醉,自裸鼠腹部正中線向上剖開,自下向上剪至劍突,沿兩側肋弓V字型打開胸廓,血管鉗夾持左側胸壁翻轉,暴露心臟,以康德萊1 mL注射器刺入右心室,取靜脈血,注入EDTA抗凝管中。自裸鼠體內取出瘤體、肺、肝、小腸、胃、心臟和腎,經4%甲醛溶液固定,制成石蠟塊。
全身生物發光成像本實驗采用全身生物發光成像監測藥物分布。經尾靜脈注入藥物后15 min,裸鼠經1.5%異氟烷麻醉后成像。
組織染色用TUNEL法進行腫瘤組織染色[15]。肺、肝、小腸、胃、心臟和腎組織切片HE染色后,由病理學專家作出診斷。
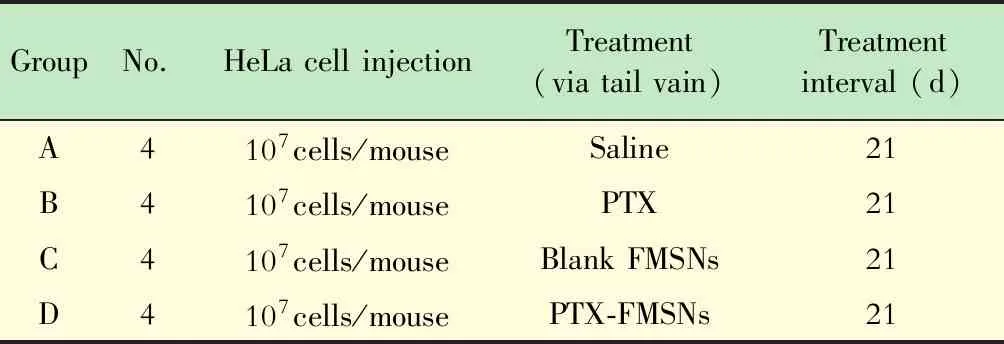
表1 體內實驗給藥方案Tab 1 Drug delivery protocol in vivo experiment
統計學方法使用STATA12.0軟件對數據進行分析。多組間比較用單因素方差分析,兩組間比較用Bonferroni 校正。P<0.05為差異有統計學意義。
結 果
藥物投遞系統的制備PTX-FMSN合成過程詳見于之前本課題組發表的論文[11-13]。最終我們得到的FMSNs外觀為規則的離散球形,平均直徑約147 nm,其內部為有序的中空多孔狀結構,載藥效率為12%。
體外抗腫瘤評價圖1顯示的是在不同濃度藥物和培育時間下的HeLa細胞活性。從圖1A和1B可知,細胞活性與藥物濃度密切相關,PTX溶液抑制細胞活性的作用稍強于PTX-FMSN。當藥物濃度在0.1 μg/mL時,PTX-FMSN和PTX在抑制HeLa細胞生長及促進細胞死亡上無差異,提示PTX-FMSN能很好地釋放藥物。當藥物濃度為0.01 μg/mL時,PTX-FMSN對HeLa細胞生長抑制和殺傷作用較PTX稍弱,可能是因為藥物濃度低,釋放量較少。
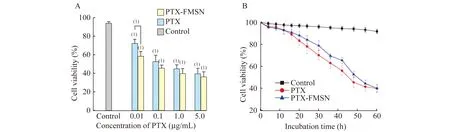
A:Cell viability of HeLa cells incubated with PTX and PTX-FMSN at different concentrations of drugs for 60 h.B:Cell viability of HeLa cells with different incubation time at 0.1 μg/mL of drug concentration.The cells treated with blank FMSN were used as a control.(1)vs.Control,P<0.05.
圖1 經PTX和PTX-FMSN處理的HeLa細胞活性
Fig 1 Cell viability of HeLa cells with PTX and PTX-FMSN
為了進一步評估PTX-FMSN的抗腫瘤效應,我們通過Annexin V-FITC/PI試劑,用流式細胞儀分析細胞凋亡和壞死率。圖2顯示PTX和PTX-FMSN不同作用時間下,HeLa細胞的凋亡和壞死情況。結果表明,雖然細胞死亡率在PTX-FMSN組相對稍低,但差異無統計學意義,PTX和PTX-FMSN作用下的HeLa細胞凋亡和壞死率趨勢一致。根據體外實驗的結果,PTX-FMSN與PTX對HeLa細胞有相似的抑制作用。

A:HeLa cells counts at 16 h,24 h,32 h and 40 h.B:Apoptosis rate (left) and necrosis rate (right) of HeLa cells.The cells treated with blank FMSN were used as a control.The concentration of drug was 0.1 μg/mL.(1)vs.Control,P<0.05.
圖2 經PTX和PTX-FMSN處理的HeLa細胞凋亡壞死情況
Fig 2 The apoptosis and necrosis of HeLa cells treated with PTX and PTX-FMS
體內抗腫瘤評價因為納米復合物在合成過程中添加了熒光分子FITC,可以通過發光成像觀察PTX-FMSN在體內的分布。從圖3A可以看出,裸鼠注射空白FMSN作為對照組,在其身上未發現集中的熒光信號。而PTX-FMSNs通過尾靜脈注入裸鼠4 h后,腫瘤部位即顯示強烈熒光,表明PTX-FMSN能高效富集于腫瘤部位。
在裸鼠成瘤給藥后21天,所有的實驗裸鼠在麻醉下處死。腫瘤的生長曲線顯示(圖3B),未帶藥的FMSNs組與生理鹽水組相似,對腫瘤的生長無抑制作用。PTX溶液組和PTX-FMSN組顯示明顯的腫瘤生長抑制效果,其效果隨著藥物濃度增加而增強,在腫瘤生長抑制效果上,PTX-FMSN和PTX兩組差異無統計學意義。
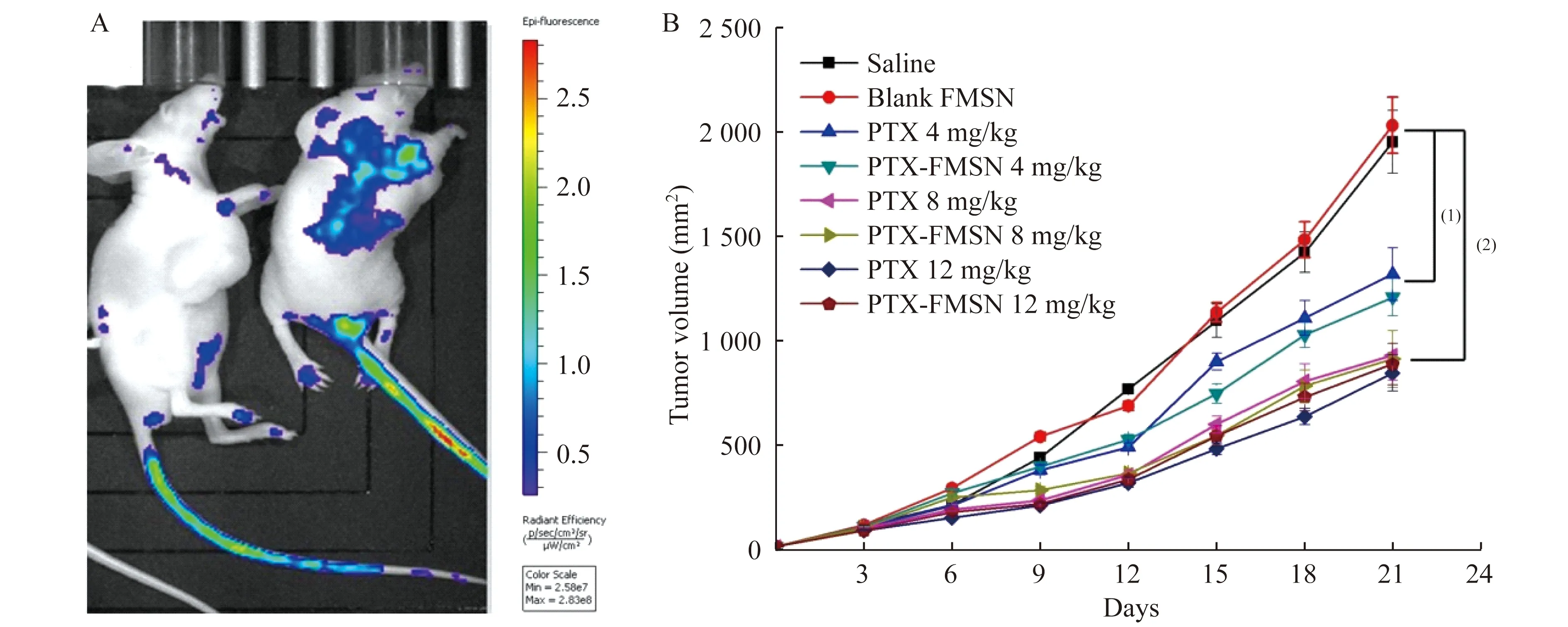
A:The whole-body bioluminescence imaging of tumor-bearing mice after blank FMSN (left) and PTX-FMSN (right) administration for 4 h.B:The growth curves of tumors treated with different drug doses.(1)P<0.05,(2)P<0.01.
圖3 裸鼠熒光成像和腫瘤生長曲線
Fig 3 Bioluminescence imaging and the growth curves of tumors in nude mice
為了進一步研究納米復合物對腫瘤生長的抑制作用,本研究將腫瘤組織制成病理切片。TUNEL染色后,腫瘤中的壞死組織在光學顯微鏡下顯示為淺棕色。從圖4A-H中可以看出,不考慮藥物濃度因素,PTX和PTX-FMSN兩組之間差異無統計學意義。在低濃度藥物作用下,PTX和PTX-FMSN組和對照組(生理鹽水和未帶藥FMSN)差異無統計學意義。當藥物濃度增加(8和12 mg/kg),PTX和PTX-FMSN組有大量的癌細胞凋亡。這些結果也與圖3 B的結果一致,充分表明PTX-FMSN能在腫瘤部位充分釋放PTX,發揮出與同等劑量游離PTX相同的抗腫瘤效果。

Tumor tissue necrosis stained by TUNEL (×200).A:Untreated mice (saline);B:Untreated mice (blank FMSNs);C:PTX treated mice at 4 mg/mL concentration;D:PTX-FMSN treated mice at 4 mg/mL concentration;E:PTX treated mice at 8 mg/mL concentration;F:PTX-FMSN treated mice at 8 mg/mL concentration;G:PTX treated mice at 12 mg/mL concentration;H:PTX-FMSN treated mice at 12 mg/mL concentration;I:Comparison of tumor tissue necrosis rates.(1)P<0.05,(2)P<0.01.
圖4 裸鼠宮頸癌標本病理切片(TUNEL染色)
Fig 4 Pathological section of cervical cancer speciments in nude mice (stained by TUNEL)
體內藥物不良反應首先,本研究檢查了4個血常規指標,包括白細胞計數、中性粒細胞計數、紅細胞計數和血小板計數,兩個對照組4個血指標均在正常范圍內(圖5)。當藥物濃度為8 mg/kg時,所有指數均是正常的。當藥物濃度為12 mg/mL時,PTX組血白細胞和中性粒細胞的數量顯著下降,而PTX-FMSN組血白細胞和中性粒細胞僅略有下降,這表明隨著藥物濃度升高,PTX-FMSN對血液毒性低于PTX。
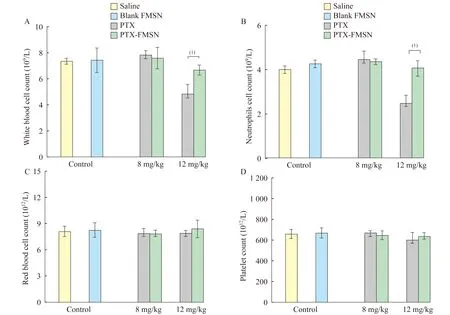
A:White blood cell count;B:Neutrophils count;C:Red blood cell count;D:Platelet count.(1)P<0.05.
圖5 不同藥物處理的小鼠血細胞計數
Fig 5 Blood cells counts in mice treated by different drugs
隨后,本研究將裸鼠的臟器制成切片,通過組織學檢查觀察有無病理變化。結果如圖6及表2所示,PTX和PTX-FMSN兩組在低藥物濃度時,對肝、肺和小腸組織損傷程度的差異不顯著,但隨著藥物濃度的增加,PTX組對上述臟器組織的損傷程度明顯大于PTX-FMSN組。
討 論
MSNs是具有均勻可調節孔徑的中空立體載物體,可在2~50 nm范圍內任意調整孔徑大小,具有穩定的骨骼結構、較高的表面積和載藥率,并且微粒本身無生理毒性,非常適合攜帶藥物。此外,MSNs的內部和外部表面有大量的活性硅氧基,可以被不同的功能基團或功能聚合物改性。納米技術有望能改善藥物的生物利用率,減小藥物毒性作用及不良反應,并提高藥物水溶性。因此,在藥物載體的研發中,MSNs受到了越來越多的關注。
YU等[16]報道的PTX納米復合物結構穩定,因減少了從腎小管的濾除,從而增加了血循環留存時間,并利用納米顆粒的高滲透長滯留效應,在腫瘤部位有較好的聚集性,PTX納米復合物聯合放療與單純PTX或單純放療相比,對宮頸癌具有更好的抗腫瘤效果,其抑制腫瘤增生的機制可能是通過調節Ki-67,降低微血管密度、CD31和血管內皮生長因子實現的,一定程度上增加了放化療敏感性。

A:Lung;B:Liver;C:Small intestinal villi.HE stain (×200).
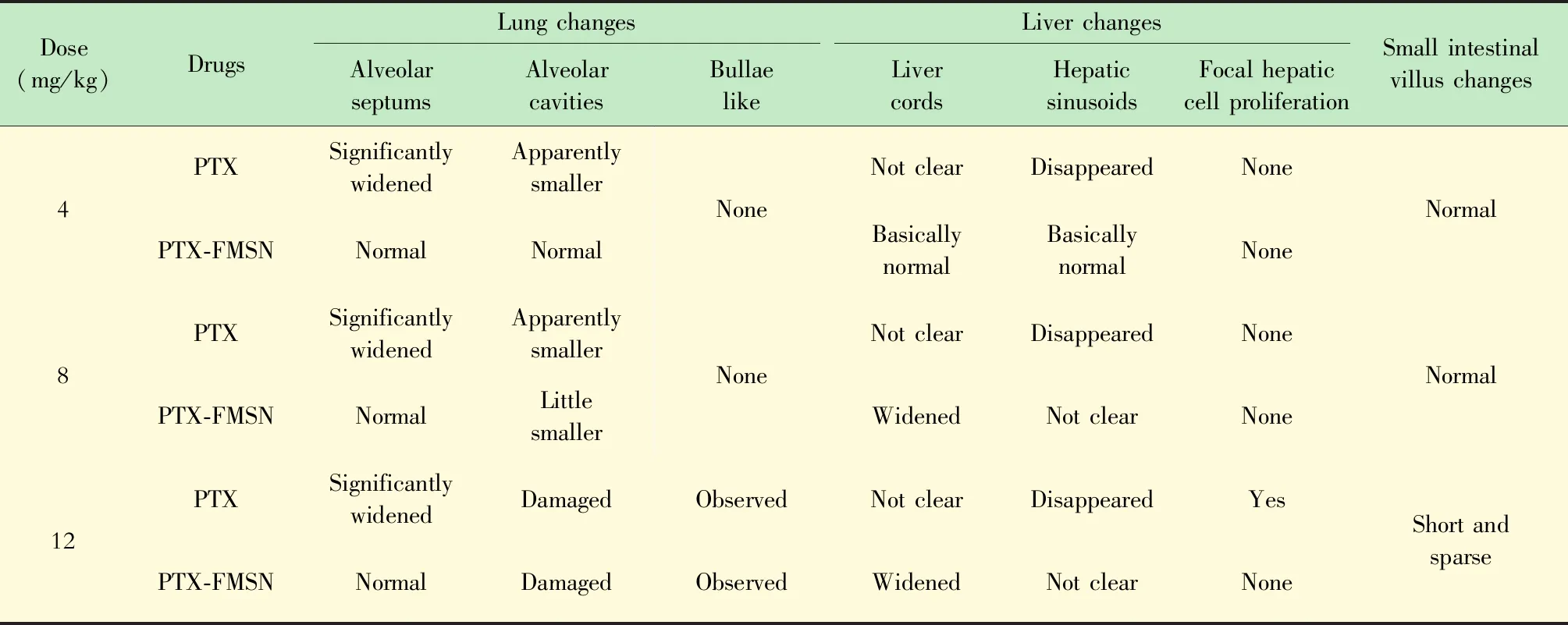
圖6 各組小鼠肺、肝和小腸組織改變的染色結果Fig 6 Histology stain of lung,liver and small intestinal villi changes in different mice groups
根據腫瘤組織中表達的特殊抗原或配體,可以制作相匹配的MSNs藥物靶向復合體,以提高抗腫瘤藥物作用的靶向性。實驗結果表明,抗腫瘤藥物納米復合物在腫瘤組織中具有良好的聚集性,從而發揮了更高效的抗腫瘤作用[17-19]。研究報道[17,20],因腫瘤細胞具有高速代謝特點,其表面較正常細胞配備更多葉酸受體,故含有葉酸配體的納米復合物可用于腫瘤靶向治療,實驗結果證實此類納米復合物發揮了良好的抗腫瘤效果,且減小了藥物的毒性作用及不良反應。
另有研究表明,在腫瘤細胞中谷胱甘肽的濃度遠遠高于正常[21],二硫鍵可以在谷胱甘肽的作用下分離,通過二硫鍵共價聯合抗腫瘤藥物和納米顆粒的應用已有報道[22]。Luo等[23]通過二硫鍵將PTX鏈接于納米顆粒上,然后對荷瘤小鼠(人表皮癌)給予相當于8 mg/kg劑量的PTX治療,結果提示PTX納米復合物與單純PTX相比,前者的腫瘤聚集性更加明顯,在其他臟器的積聚更少。在觀察終末,經PTX納米復合物治療的負荷小鼠,腫瘤完全消退。但此類納米復合物用于治療宮頸癌的相關報道甚少,尤其是體內實驗的資料匱乏。
在本研究中,課題組通過二硫鍵共價鏈接合成PTX-FMSN復合物。體外細胞實驗表明,PTX-FMSN顯示出與PTX相似的對HeLa細胞增殖抑制和促凋亡作用。空白FMSN作為細胞試驗對照組,結果顯示對細胞活性基本無影響,這也說明FMSN作為藥物載體是安全的。
通過全身生物熒光成像,表明PTX-FMSN具有較好的腫瘤靶向性。體內抗腫瘤實驗表明,經PTX溶液和PTX-FMSN處理的裸鼠,其腫瘤生長曲線無顯著差異,兩組的細胞壞死率也無顯著差異。血液檢測結果表明,PTX-FMSN組中血白細胞和中性粒細胞計數顯著高于PTX組。通過病理評估,可以看到PTX和PTX-FMSN治療組裸鼠肺、肝、小腸有組織學變化,但同劑量下的PTX組病變較PTX-FMSN組更為嚴重。
本研究通過上述一系列體內體外實驗,提示PTX-FMSN對宮頸癌有抑制作用,其效果與單純PTX相當;通過二硫鍵共價鏈接,使PTX充分釋放在腫瘤組織內,同時減小了藥物對其他臟器的毒性作用及不良反應。這些結果與Luo等[23]的實驗結果相吻合,進一步驗證了二硫鍵這一閥門在控制藥物釋放中是安全有效的,其對于宮頸癌的治療前景值得肯定。當然,我們的實驗尚不完善,需進一步改進實驗設計,比如增加藥代學方面的研究。對PTX復合物的設計也可進一步完善,如增加其他抗腫瘤藥物研究聯合抗癌效應,增加靶向標記讓其更具腫瘤靶向性等。我們也可以嘗試在其他腫瘤中做相應的抗癌評價實驗,這些都有待進一步實驗去考證。

