液基薄層細胞檢查聯合HPV-DNA分型檢測在宮頸癌篩查中的價值對比
林兵英 羅曉燕 方周賓 朱 巖
1.南方醫科大學附屬深圳市婦幼保健院檢驗科,廣東深圳 518028;2.深圳市第二人民醫院檢驗科,廣東深圳 518035
目前我國宮頸癌篩查尚處于較低水平,2010年全國城市宮頸癌平均篩查率僅為29.1%,東部發達地區為31.3%,宮頸癌的防治形勢較為嚴峻[1-2]。已經證實[3],人乳頭狀瘤病毒(human papilloma virus,HPV)感染與宮頸癌的發病具有直接關系,其中以高危型HPV16/HPV18 型居多。HPV-DNA 檢測已逐漸成為宮頸癌篩查的一項重要手段,但受到檢查方式、取材純凈度、檢測儀器等多種因素制約,臨床上假陽性、假陰性率居高不下。近年來薄層液基細胞學(thinprep cytologic test,TCT)檢查獲得了臨床醫生的認可,也是國際上一種較為先進的宮頸癌篩查細胞學檢查技術[4-5];但也有報道指出[6],TCT 檢測容易出現診斷不足或過度診斷的情況。本研究通過分析我院2017 年6 ~12 月進行宮頸癌篩查的130 例患者情況,現報道如下。
1 資料與方法
1.1 一般資料
納入2017 年6 ~12 月在我院進行宮頸癌篩查的患者130 例,年齡24 ~45 歲,平均(31.3±6.7)歲,納入標準:均存在宮頸癌高危因素(早婚早育65 例,既往流產史37 例,存在性病或不潔性生活史18 例,宮頸癌家族史10 例);其中已婚93 例,未婚37 例;患者自愿參與本研究并簽署知情同意書;排除標準:患者近3 個月服用激素或非甾體類抗炎藥者;患有子宮肌瘤、卵巢囊腫者;月經不規律者。本研究上報醫院倫理委員會并獲得批準。
1.2 研究方法
1.2.1 TCT 檢測 所有患者均于月經干凈后第3 天進行TCT 檢測,將細胞刷置于宮頸管內,到達宮頸外口上方1cm 左右,旋轉細胞刷1 周后取出,立即刮取細胞洗脫于細胞保存液中,2 ~8℃待檢;采用液基薄層細胞制片機制直徑2cm 薄層細胞涂片,經95%乙醇固定,巴氏染色,風干后在OlympusCX-31 顯微鏡下閱片。
1.2.2 HPV-DNA 檢測 用無菌棉拭子在患者宮頸口內用力旋轉3 ~5 周后將脫落細胞置于保存液中,取混勻的待測樣品2000r/min 后棄上層液后加入陽性質控品200μL,加入緩沖液,搖勻后置于100℃水中15min,離心后取5μL 作為PCR 擴增模板,擴增后在預熱好的Lumin200 多功能流式點陣儀上檢測。人乳頭狀瘤病毒核酸檢測試劑盒由上海天景生命科技有限公司提供。
1.2.3 陰道鏡活檢 患者取截石位,消毒后于宮頸涂體積分數3%的冰醋酸及體積分數1%的碘溶液,采用電子陰道鏡(深圳金科威電子科技設備有限公司)成像系統在醋酸白上皮區及碘試驗不染色區取材;若無明顯病變則在宮頸3、6、9、12 點取宮頸組織活檢;取材后用體積分數10%的甲醛溶液固定后進行病理檢查。
1.3 判定標準
1.3.1 TCT 判定標準 TCT 細胞學判定標準采用國際癌癥協會推薦的2001TBS 分級標準作為診斷標準[7],分為正常或炎癥反應、意義不明的不典型鱗狀細胞(atypical squamous cells,ASCUS)、低度鱗狀上皮內病變(low-grade squamous intraepithelial lesions,LSIL)、高 度 鱗 狀 上 皮 內 病 變(height of squamous intraepithelial lesion,HSIL)、鱗狀細胞癌(squamous cell carcinoma,SCC);將細胞學檢查結果為ASCUS、LSIL、HSIL、SCC 作為陽性結果。
1.3.2 HPV-DNA 判定標準 嚴格按照說明書檢測HPV-DNA 含 量,將HPV-DNA ≥1pg/mL 作 為陽性結果;將HPV16/18/26/31/33/35/39/45/51/52/53/56/58/59/66/68/73/82 亞型作為HPV 高危型,將HPV6/11/42/43/44/84 亞型作為低危型。
1.3.3 病理診斷分型 根據WTO 制定的《乳腺與生殖系統腫瘤病理與遺傳學》2006 版標準[8],將病理檢查結果分為無上皮內瘤變和惡性變(NILM)、輕度不典型增生(CIN Ⅰ級)、中度不典型增生(CIN Ⅱ級)、重度不典型增生和原位癌(CIN Ⅲ級)、宮頸鱗狀細胞癌(SCC),將CIN ≥Ⅰ級定義為陽性。
1.4 統計學處理
采用SPSS19.0 軟件進行數據分析,計數資料以百分數表示,采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 TCT、HPV-DNA檢測與病理檢查結果比較
以病理檢查為金標準,TCT 檢測符合率為61.54%(80/130),HPV-DNA 檢 測 符 合 率為69.23%(90/130)比較,差異無統計學意義(χ2=1.699,P=0.192),見表1 ~3。
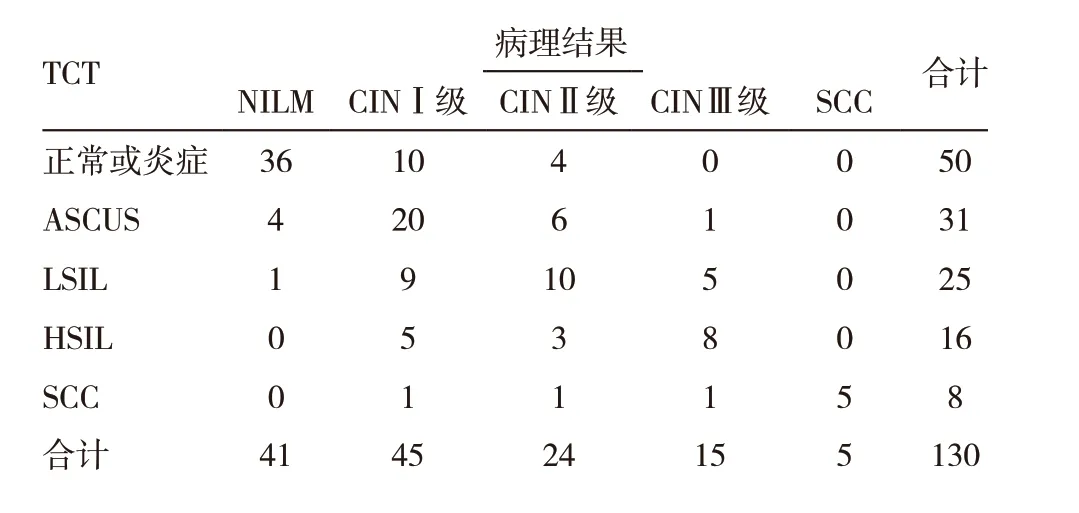
表1 TCT檢測與病理結果比較
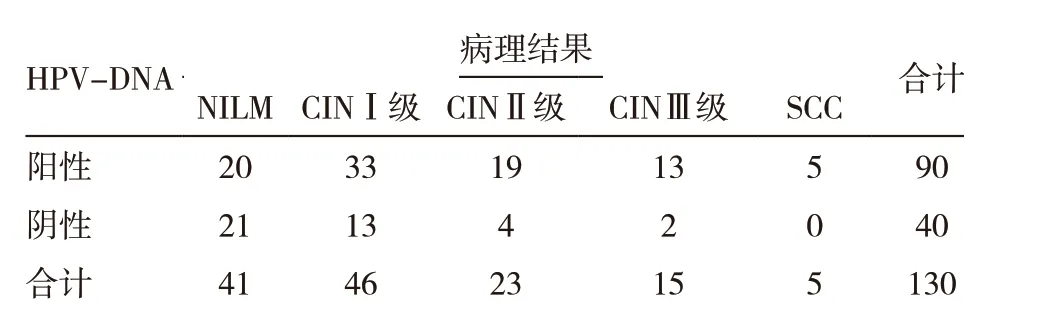
表2 HPV-DNA檢測與病理結果比較

表3 HPV-DNA檢測與TCT檢測符合率比較[%(n/n)]
2.2 TCT分級與HPV分型比較
隨著TCT 級別升高,高危型HPV 表達率逐漸升高,在SCC 中高危型HPV 表達率達100%,差異有統計學意義(P <0.05)。見表4。
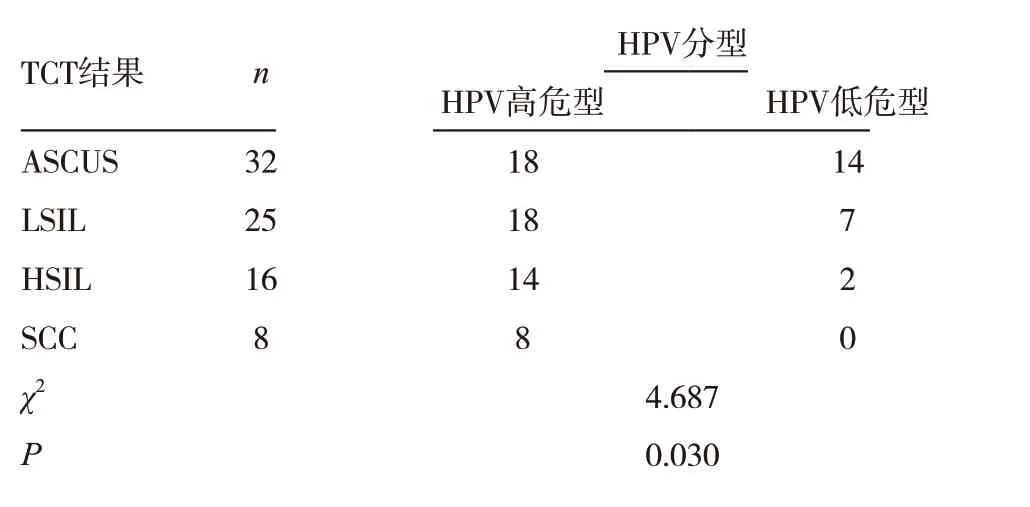
表4 TCT分級與HPV分型比較
2.3 TCT聯合HPV-DNA在宮頸癌篩查中的診斷效能
TCT 聯合HPV-DNA 在診斷靈敏度、特異度、準確度方面均高于單一TCT、HPV-DNA 檢測,差異有統計學意義(P <0.05)。見表5。
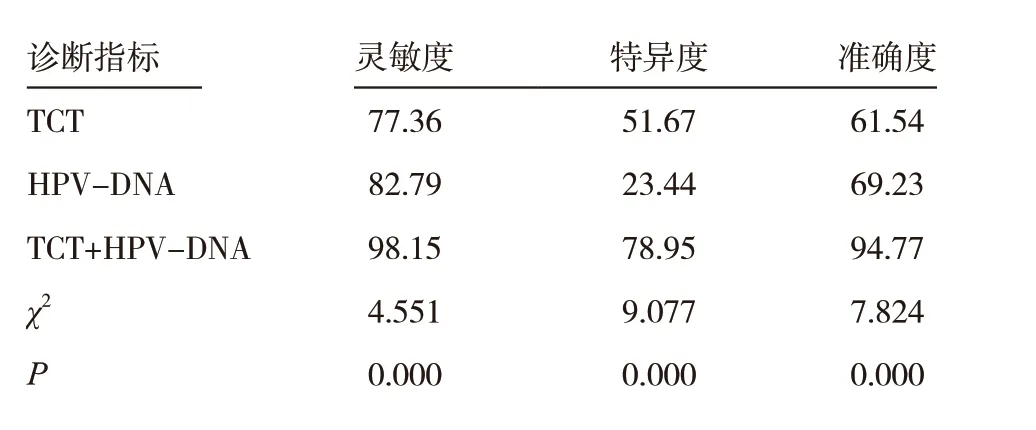
表5 TCT聯合HPV-DNA在宮頸癌篩查中的診斷效能(%)
3 討論
宮頸癌的發病是一個漫長的過程,研究表明[9-10],從不典型增生發展到浸潤癌大約需要8 ~12 年過程;在整個過程中患者多無明顯癥狀體征,待出現陰道異常流血或接觸性出血時,病變往往已經達到中晚期,失去最佳治療時機。臨床研究證實[11-12],對于CIN Ⅱ級及CIN Ⅲ級的患者約5%~30%可發展為浸潤癌,但約10%~40%經早期干預后可發生逆轉。因此,宮頸癌的早期篩查工作刻不容緩。目前,HPV 感染已經作為引起宮頸癌的獨立危險因素寫入各大指南中;另外,宮頸細胞學檢查在臨床上也得以廣泛應用。HPV-DNA 檢測和液基薄層細胞檢查(TCT)是臨床上常用的早期宮頸癌篩查手段,能夠及時發現高危因素和癌前病變,但這兩種方式受多種因素制約,假陽性和假陰性率均較高,特別是TCT 檢查容易出現過度診斷的情況,因此不能作為確診的唯一手段。病理檢查作為一種有創性檢查手段,容易導致患者宮頸出血、宮頸糜爛等并發癥,在大樣本篩查的應用中受到一定限制[13]。因此,聯合檢測在早期篩查中不失為一種提高確診率的手段。
本研究中,以病理檢查結果為金標準,TCT 檢測的診斷符合率為61.54%,在CIN 陽性患者中,HPV-DNA 陽性率為69.23%,與國內其他學者研究相近似[14-15];國外學者研究指出[16],在連續兩次HPV 檢測均呈陽性的患者中,10 年內出現CIN Ⅲ級或浸潤癌的發生率為21%,而HPV 陰性的患者中,10 年內出現CIN Ⅲ級或浸潤癌的發生率僅為2.3%,差異巨大。本研究還顯示,隨著CIN 分級增加,HPV 陽性率逐漸升高,進一步證實了HPV 在宮頸癌篩查中的作用,同時這也提示筆者團隊在病理檢查呈高危病變的患者中多數存在HPV 陽性,治療上也應同時行根治性HPV 治療。TCT 分級與CIN 分級存在相似之處,一般業內醫生將無意義的不典型鱗狀細胞與CIN Ⅰ級相對應,低度鱗狀上皮內病變與CIN Ⅱ級相對應,高度鱗狀上皮內瘤變與CIN Ⅱ~Ⅲ級相對應[17],本研究中根據這種相關性得出TCT 分級與CIN 分級呈正相關,給臨床醫生提供了可靠的參考依據,分析認為:TCT 檢查作為一種創傷較小的檢查手段,能夠簡便的獲取有效的標本,得到較為理想的薄層圖片,準確率和安全性均較高,隨著檢測技術的不斷改進,在大樣本篩查中具有廣闊的應用前景。
HPV 有多種分型,其中HPV16/18 是兩種最常見的引起宮頸癌的類型,臨床上也根據不同分型導致宮頸癌發生的危險因素高低將不同分型分為HPV 高危型和HPV 低危型[18];本研究結果顯示,隨著TCT 分級的增加,HPV 高危型的檢測陽性率逐漸升高,特別是在SCC 的患者中,HPV 高危型陽性率達100%;在診斷效能方面,聯合檢測診斷靈敏度、特異度、準確度方面均高于單一TCT、HPVDNA 檢測,說明TCT 檢測與HPV-DNA 檢測在一定程度上具有同步性,也能夠相互彌補之間的不足,與其他學者報道相符合[19-20]。
綜上所述,TCT 聯合HPV-DNA 分型檢測能夠提高早期宮頸癌篩查準確率,且減少因假陽性和假陰性引起的過度治療和誤診,值得在早期大樣本篩查中推廣應用。

