腹膜假黏液瘤人源異種移植模型的研究進展
林育林,張 玨,楊智冉,李鑫寶,姬忠賀,許洪斌,彭 正,李 雁※
(1.首都醫科大學附屬北京世紀壇醫院腹膜腫瘤外科 北京市腫瘤深部熱療和全身熱療技術培訓基地,北京 100038;2.北京大學航天中心醫院黏液瘤科,北京 100049; 3.解放軍總醫院普外科,北京 100853)
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是一種以黏液性腹水、腹膜多發種植灶、網膜餅及卵巢受累為典型特征的惡性腫瘤綜合征,多由闌尾黏液性腫瘤破裂穿孔、瘤細胞及黏液腹腔再分布導致,少部分來源于卵巢、胃、結腸、臍尿管、胰腺等腹盆腔臟器的原發黏液性腫瘤[1-3]。腹膜表面腫瘤國際聯盟將PMP定義為惡性腫瘤綜合征,病理學將其分為無細胞性黏液、腹膜低級別黏液癌或播散性腹膜黏液腺瘤病(disseminated peritoneal adenomucinosis,DPAM)、腹膜高級別黏液癌或腹膜黏液癌(peritoneal mucinous carcinomatosis,PMCA)、腹膜高級別黏液癌伴印戒細胞或腹膜黏液癌伴印戒細胞(peritoneal mucinous carcinomatosis with signet ring cells,PMCA-S)4類[1]。目前,國際上推薦行腫瘤細胞減滅術+腹腔熱灌注化療治療PMP,可顯著延長PMP患者的總生存期[4-5]。黏液進行性聚積導致的腸梗阻、腫瘤侵襲以及持續性硬化導致的腹盆腔臟器粘連仍是PMP臨床治療亟待解決的難題。
研究PMP核心病理機制、進展規律及影響因素需要有適宜的實驗動物模型,尤其是與臨床病理過程完全相似的原位人源異種移植模型(patient derived xenograft model,PDX模型)。現就已構建PMP PDX模型的建立方法、主要特征及使用該模型開展的PMP致病機制和干預研究予以綜述。
1 模型建立方法
最常用的PMP模型動物有BALB/c-nu/nu裸小鼠[4-5]、Ncr-Foxn1nu裸小鼠[6-7]、無胸腺瑞士裸小鼠[8]、CBH/rnu/rnu大鼠[9]和WAG/Rija大鼠[10]。常用模型建立方法包括開腹瘤塊包埋法及瘤細胞懸液腹腔注射法。接種腫瘤多來源于術中獲取的患者標本,使用針頭等物理切割方法將標本剪切成27~500 mm3瘤塊,動物全身麻醉后通過腹正中線切口將瘤塊包埋于動物腹腔,之后用可吸收縫線逐層縫合切口[6-11]。亦有少數文獻報道,采用MKN45、LS174T、CC531細胞系的瘤細胞懸液接種建立PMP動物模型[6,12]。另有研究采用瘤細胞懸液腹腔注射法用于動物模型的傳代[7-8]。
此外,凍存腫瘤組織復蘇接種法也有應用。Mavanur等[8]將約3 mL第4代PMP模型,加入等體積杜氏改良Eagle培養基、20%胎牛血清和10%二甲基亞砜中,制成瘤細胞懸液,以0.5 ℃/min的速率降溫至-20 ℃,再以1 ℃/min的速率降溫至-80 ℃凍存,6個月后解凍加入等體積磷酸鹽緩沖液重懸,以每只裸小鼠1 mL的劑量腹腔注射建立模型,觀察至第60天,模型黏液性腹水的發生率為40%(2/5)。Flatmark等[7]則將腫瘤組織在-196 ℃存放3~6個月,采用腹腔注射法成功建立PMP PDX模型,說明了腫瘤組織凍存再復蘇接種建立PMP PDX模型的可行性。但是Mavanur等[8]不建議采用凍存腫瘤組織建立PMP動物模型進行干預治療實驗。各種PMP PDX模型的構建方法不同,見表1。
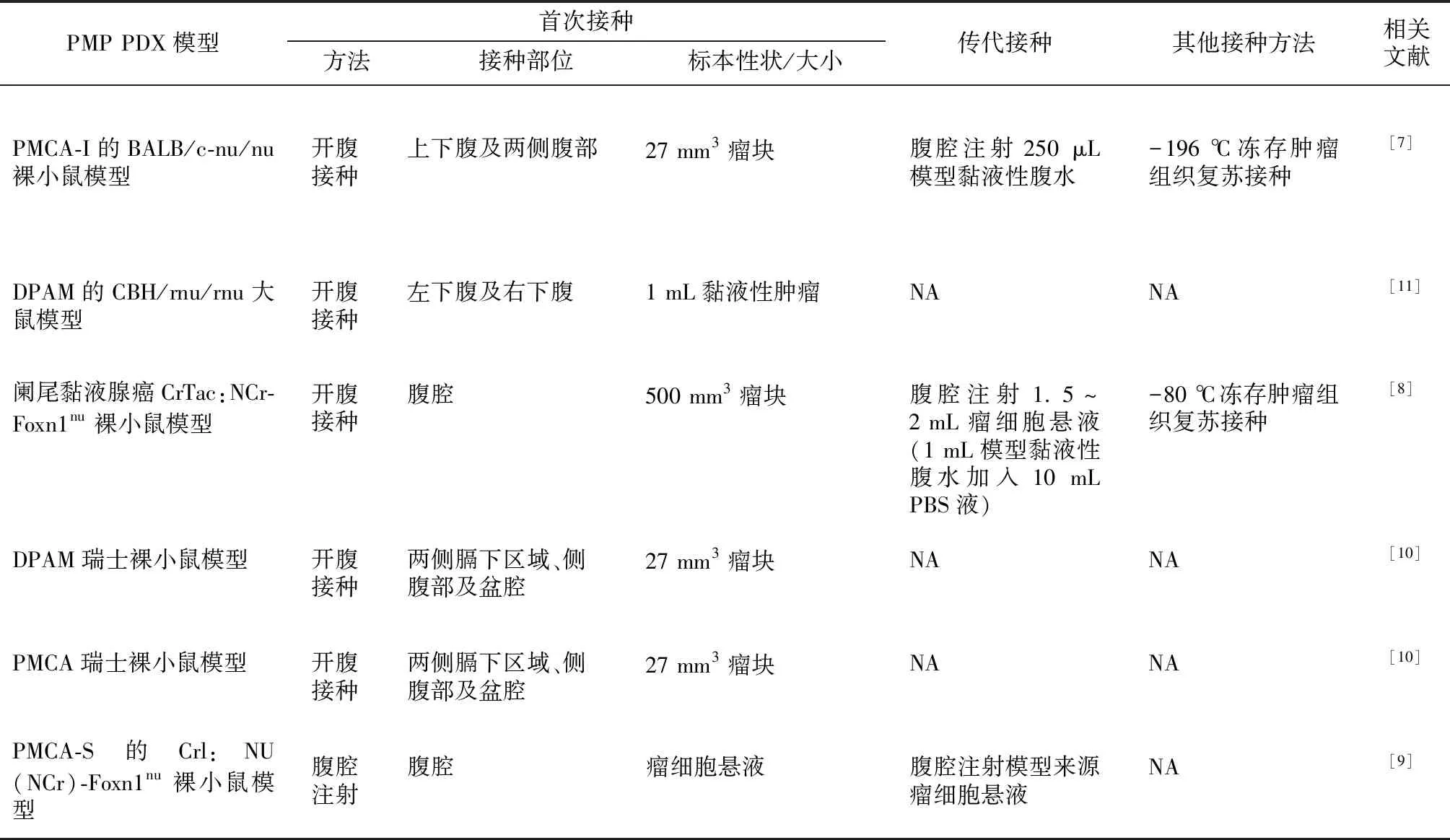
表1 PMP PDX模型的構建方法
PMP:腹膜假黏液瘤;PDX:人源異種移植模型;PMCA-I:腹膜黏液癌中間組織學特征;DPAM:播散性腹膜黏液腺瘤病;PMCA-S:腹膜黏液癌伴印戒細胞;NA:無資料;PBS:磷酸鹽緩沖液
2 日常監測指標
實驗動物的體重變化是監測動物一般狀態的良好指標,也是觀察腫瘤生長情況的客觀參數。Mavanur等[8]認為,聯合動態觀察PMP動物模型的體重和腹圍變化能間接反映動物腫瘤的負荷。當模型動物體重明顯下降和(或)腹圍明顯增加時,腫瘤負荷高,動物進入與腫瘤患者臨床晚期相似的階段,可據此決定干預時機,并判斷療效。成瘤率及成瘤時間也是后續利用模型進行干預治療的重要觀察指標,測量體重的頻率多為每周1次[8,13-14]。
3 PMP模型的腫瘤生物學特點
3.1成瘤周期及種植成功率 PMP PDX模型接種后成瘤周期較長、成瘤率較低。Mavanur等[8]建立了人闌尾黏液腺癌來源的PMP動物模型,種瘤后第8周觀察到種瘤成功,成瘤率為12%(2/17),其中低級別黏液性腫瘤種植成功率較低,實驗技術及低級別黏液性腫瘤本身的生物學特征是導致成功率較低的可能因素。初代PDX模型構建成功的觀察期可多達8個月,8周無法觀察到大部分荷瘤動物的大體形態學變化。Chua等[11]建立了DPAM大鼠模型,接種腫瘤后3個月成瘤率為100%。Dohan等[10]建立了DPAM和PMCA動物模型,模型傳代間隔時間由第1次的19.4周縮短到第5次的11.1周,DPAM模型成瘤率為40%~90%,PMCA模型成瘤率為80%~100%。上述PMP動物模型腫瘤生長緩慢的特點符合PMP的惰性發展病程,容易受到各種環境條件的影響,該特點是導致較難構建人源PMP動物模型的重要原因。
3.2大體形態學特點
3.2.1腹腔腫瘤播散程度評估 根據小動物解剖特點,將人腹膜癌指數評分優化形成實驗性腹膜癌指數評分(experimental peritoneal cancer index score,ePCI)體系。ePCI是評估腫瘤腹腔播散的最常用指標,將動物腹部分為4個象限,每個象限可評0~5分:0分(無可見腫瘤),1分(腫瘤直徑≤0.5 cm),2分(0.5 cm<腫瘤直徑≤1.0 cm),3分(1.0 cm<腫瘤直徑≤2.0 cm),4分(2.0 cm<腫瘤直徑≤3.0 cm),5分(腫瘤直徑>3.0 cm);4個象限分數的總和即為ePCI(0~20分),ePCI結合腫瘤結節總數可用于評估腫瘤的播散程度[15-17]。
Shao等[18]在以上評分系統的基礎上改進了每個區域的評分分級,使其更適于描述小鼠腹腔內腫瘤播散程度,將腹盆腔分為Ⅰ:左右橫膈、劍突;Ⅱ: 肝、脾、胃、腎及附屬韌帶;Ⅲ:小腸、結腸、腸系膜及壁腹膜;Ⅳ:盆腔、泌尿生殖系統、直腸4個區域,見圖1。每個區域病損大小(leisure size,LS )評分細則為,LS-0:無肉眼可見腫瘤結節;LS-1:腫瘤結節直徑≤0.2 cm;LS-2:0.2 cm<腫瘤結節直徑≤0.5 cm;LS-3:腫瘤結節直徑>0.5 cm;并引入腹水評分:1分,總分:0~13分,見圖1。
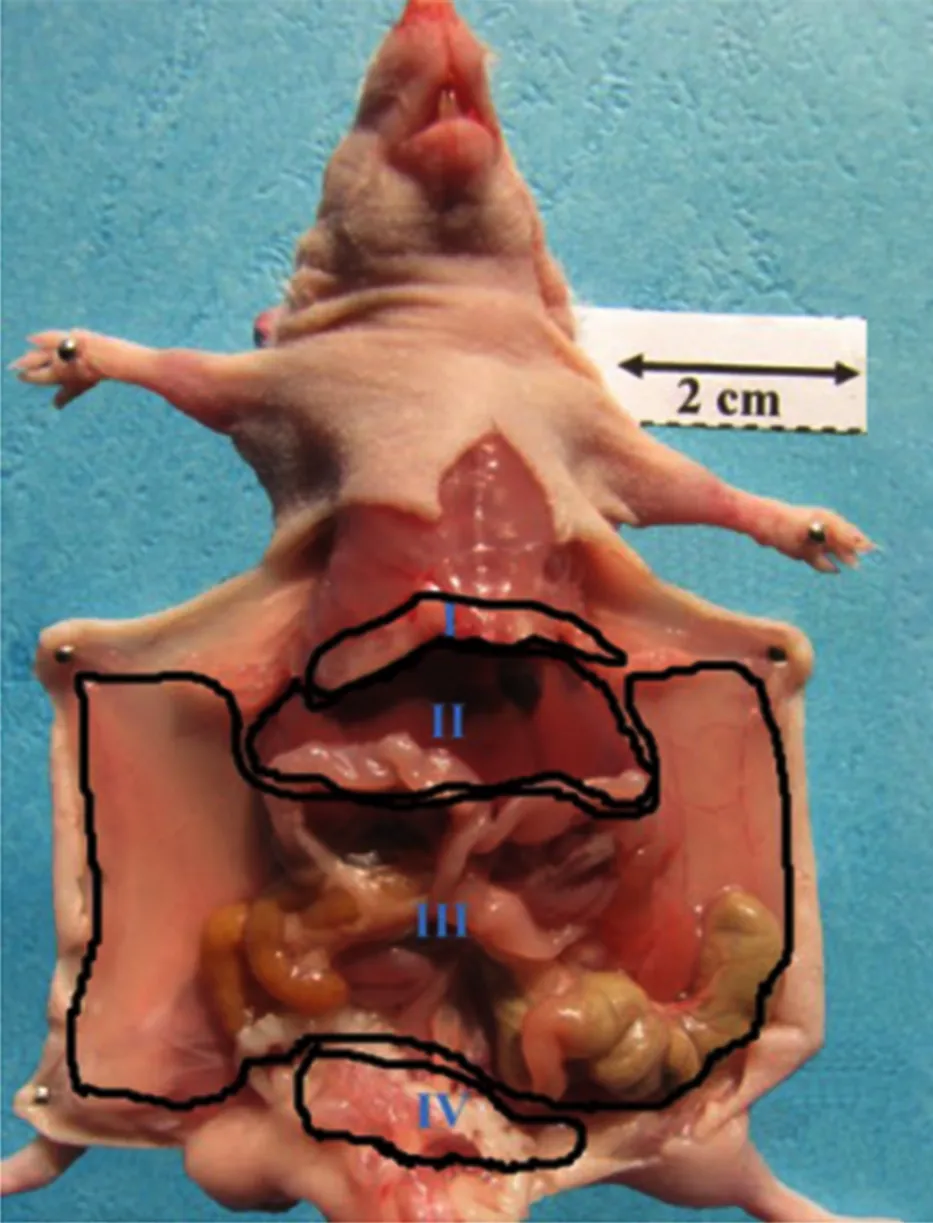
Ⅰ:左右橫膈、劍突;Ⅱ:肝、脾、胃、腎及附屬韌帶;Ⅲ:小腸、結腸、腸系膜及壁腹膜;Ⅳ:盆腔、泌尿生殖系統、直腸;ePCI:實驗性腹膜癌指數評分;LS:病損大小
圖1 ePCI評分分區示意圖
3.2.2腫瘤播散特點 PMP PDX模型大體病理學特點與人類PMP相似,均表現出腹腔腫瘤廣泛播散及黏液性腹水。Flatmark等[7]采用開腹種植法建立了PMCA-Ⅰ病理類型的PMP裸小鼠模型,大體病理學表現為大小不一的固體黏液性腫瘤,黏附于腹膜及腹腔臟器漿膜層,腫瘤未侵犯臟器實質,未發現膈肌外廣泛轉移,見圖2中A1、A2。Dohan等[10]建立的DPAM亞型無胸腺瑞士裸小鼠模型的腹腔種植特點與Flatmark等[7]結果相似。經數次傳代,Flatmark等[7]發現,模型腹腔黏液性腹水比例逐漸升高而固體腫瘤逐漸減少,而Dohan等[10]的PMCA模型傳代過程中未觀察到類似現象。此外,從第6代開始,Flartmark等[7]通過腹腔注射黏液性腹水進行傳代,該方法縮短了傳代間隔時間和腹脹出現時間,且同代模型間腫瘤生長情況更均一。
Chua等[11]建立的DPAM病理分型的CBH/rnu/rnu大鼠模型的大體病理學表現為黏液性腫瘤廣泛播散累及壁層和臟層腹膜,大量黏液性腫瘤聚積壓迫小腸,導致部分性腸梗阻,見圖2中B1、B2。
Mavanur等[8]對建立的PMCA病理分型CrTac:NCr-Foxn1nu裸小鼠模型的研究顯示,腹腔注射法接種60 d后,不同模型間解剖結果較一致,均表現出明顯腹圍增加,大量黏液性腫瘤包繞腹腔臟器,腫瘤組織疏松粘連于臟器漿膜層,局部可見固體腫瘤組織侵犯臟器漿膜層,但未侵及臟器實質,無腫瘤突破膈肌及血行轉移,見圖2中C1、C2、C3。Kuracha等[9]建立了迄今唯一的PMCA-S分型的Crl:NU(NCr)-Foxn1nu裸小鼠模型,該病理分型是PMP病理分型分化及預后均最差的類型,但該模型同樣無腫瘤侵犯臟器實質及膈肌外遠處轉移,見圖2中D1、D2、D3[19]。
3.3組織病理學和分子病理學特點
3.3.1組織病理學特點 目前已建立的PMP動物模型涵蓋腹膜表面腫瘤國際聯盟提出的DPAM、PMCA和PMCA-S三種主要病理類型[1]。DPAM鏡下可見大量黏液池中散在分布條索狀或柱狀黏液性上皮,細胞異型性不顯著,核分裂不活躍,伴纖維組織間隔和輕微炎癥反應[10-11]。PMCA分類中同樣有大量黏液池,但黏液性上皮更豐富,瘤細胞輕度堆疊分層,核分裂活躍,細胞異型性顯著高于DPAM。PMCA-S分型表現為黏液池中出現散在分布的印戒細胞,其余鏡下表現與PMCA一致。PMP PDX模型的組織病理學表現與人類一致,但是也存在部分差異,Flatmark等[7]和Mavanur等[8]均觀察到人類腫瘤組織黏液池間常見的纖維間隔在模型腫瘤組織中顯著減少,而上皮性腫瘤組織相對人腫瘤組織更豐富。Mavanur等[8]認為,上述現象可能與荷瘤無胸腺裸小鼠T細胞調節纖維化功能缺失有關。
免疫組織化學檢測模型腫瘤組織及人源腫瘤組織的蛋白表達情況表明,PDX模型的免疫組織化學結果與相應人源腫瘤的組織病理學特點一致,可認為構建的模型是PMP PDX模型。PMP PDX模型常用免疫組織化學指標及結果,見表2。
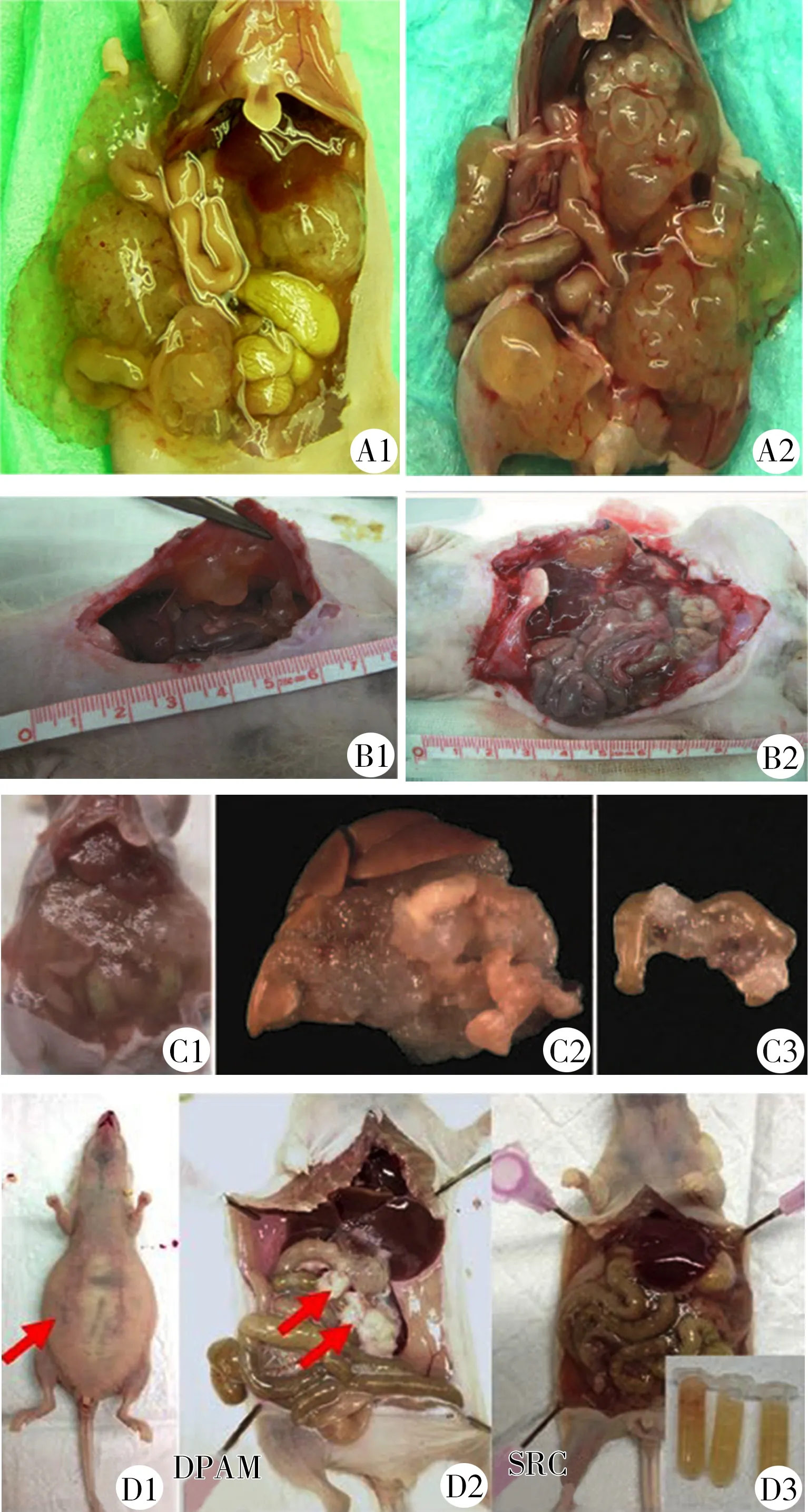
A1:腹腔非粘連性黏液性腹水,固體腫瘤為主,累及膀胱、肝門及小腸系膜(第4代);A2:PMP模型腹腔大量固體腫瘤,黏附于肝門、后腹膜、膀胱(第0代);B1、B2:黏液性腫瘤累及壁層和臟層腹膜,大量黏液性腫瘤聚積壓迫小腸;C1:腹腔大量黏液性腹水(第58天);C2:腫瘤粘連于肝臟、膽囊、胰腺、胃、十二指腸及脾臟形成團塊(第58天);C3:小腸及腸系膜表面腫瘤組織;D1:大量黏液性腹水致腹圍明顯增加;D2:腫瘤種植于臟器漿膜層;D3:PMCA-S模型腹腔播散與DPAM、PMCA類似,無腫瘤組織浸潤臟器實質
圖2 各PMP模型大體形態學表現[3,5-7]
3.3.2分子病理學特點 近年來,利用PMP模型進行的基因表達研究逐漸增多。Mavanur等[8]發現,闌尾黏液腺癌CrTac:NCr-Foxn1nu裸小鼠模型的10p23染色體D10S1173位點發生雜合性缺失,而人源腫瘤標本未發現;模型更豐富的腺上皮導致腫瘤DNA/正常DNA比值增高,因此模型更易檢測到突變,但該研究未發現Kras基因突變。Dohan等[10]報道了DPAM瑞士裸小鼠模型與人源腫瘤均發生Kras基因p.G12V突變,p53基因功能完好。人類PMP最常見的突變基因是KRAS和GNAS,突變率分別為57%~100%和40%~77%[20-25]。
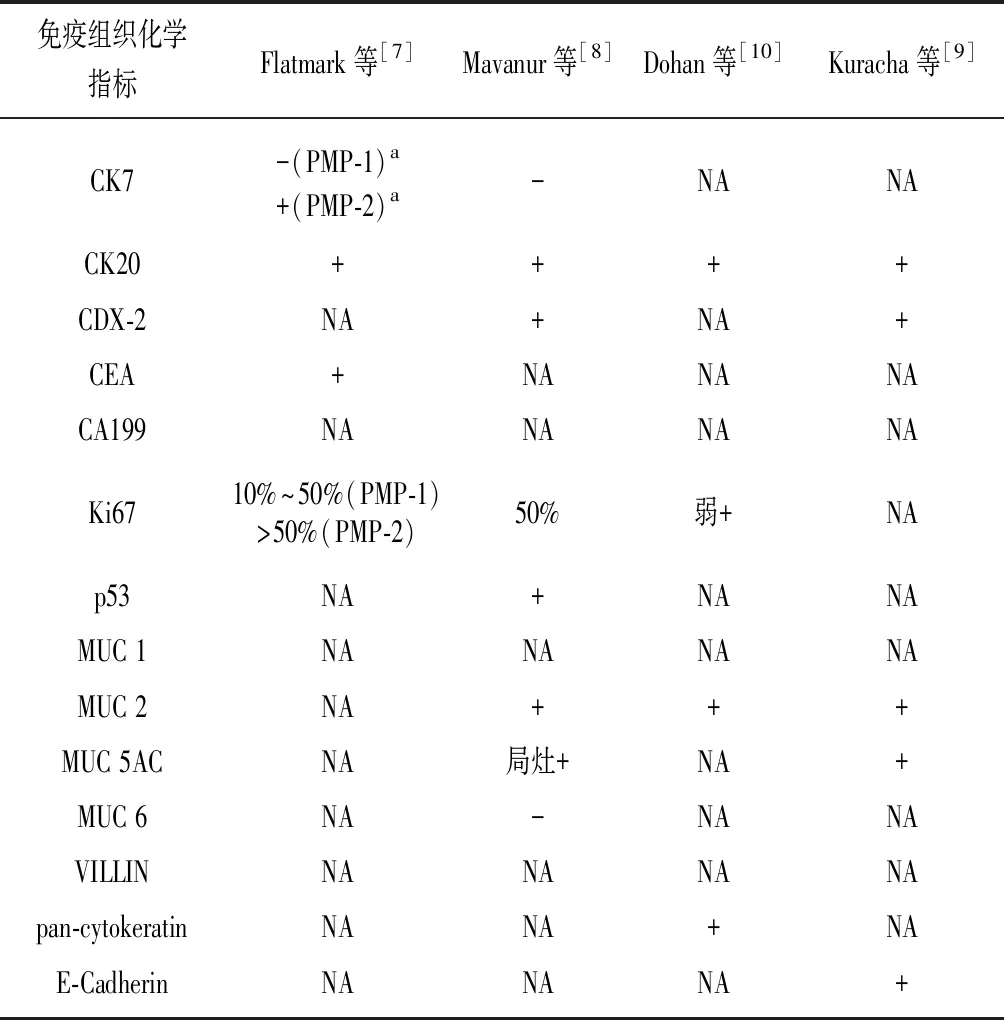
表2 PMP PDX模型常用免疫組織化學指標
PMP:腹膜假黏液瘤;PDX:人源異種移植模型;CK:細胞角質蛋白;CDX-2:尾型同源框轉錄因子2;CEA:癌胚抗原;CA199:糖類抗原199;MUC:黏蛋白;VILLIN:絨毛蛋白;pan-cytokeratin:廣譜角蛋白;E-Cadherin:上皮鈣黏素;+:陽性;-:陰性;a:兩模型病理診斷均為PMCA-I;NA:無資料
4 PMP發病機制的研究
目前,PMP的發生發展機制尚不明確。PMP PDX模型的大體病理學、組織病理學、分子病理學表現與人類PMP相似,是研究PMP發病機制的理想平臺。腹腔腫瘤新生血管形成有利于PMP的發生發展。Dohan等[10]通過主動脈內注射硫酸鋇懸液(1 g/mL)及同工凝集素B4行血管造影,檢測血管內皮細胞特定抗原,測量腸系膜上動脈血流速度,以觀察腹腔臟器血管及腫瘤新生血管,直觀展示PMP新生血管生成情況;血管造影顯示,腸系膜上動脈下游形成大量曲折的新生血管,分布于腹腔內腫瘤周圍。血管生成分析結果顯示CD31、血管內皮鈣黏素及結蛋白染色均陽性。多普勒超聲動脈血流速度測量顯示,荷瘤組裸小鼠腸系膜上動脈血流速度為控制對照組的2倍,腹主動脈血流速度仍保持穩定。該研究通過影像學、組織病理學和血流動力學檢查,在動物水平展示了腹腔腫瘤周圍大量源自腸系膜上動脈的新生血管,提示血管靶向藥物可能為患者帶來生存獲益。
“腹膜-血漿屏障”與PMP腫瘤及基質細胞共同作用,形成特定的腫瘤微環境,目前對腹腔腫瘤微環境的相關研究較少。腹水中的趨化因子/細胞因子水平可在一定程度上反映腹腔特定的腫瘤微環境,臨床上難以區分患者腹水腫瘤細胞及基質細胞對趨化因子/細胞因子水平的貢獻比例。動物模型中,腫瘤細胞源自人體,而基質細胞源自小鼠,為趨化因子/細胞因子來源的研究提供了理想模型。Kuracha等[9]使用抗人細胞因子抗體分別檢測PMP患者和PDX模型腹水中17種趨化因子/細胞因子水平,對人類和動物模型PMP微環境差異的研究均顯示,除白細胞介素(interleukin,IL)-6、團粒蛋白、IL-8外,其余14種趨化因子/細胞因子水平的差異均無統計學意義,說明動物模型腹腔腫瘤微環境與人體類似。抗鼠細胞因子抗體再次檢測顯示,差異有統計學意義,但兩者IL-6水平差異由897倍降至6.4倍,團粒蛋白和IL-8水平差異亦發生類似變化;不同抗體(抗人細胞因子抗體或抗鼠細胞因子抗體)檢測細胞因子水平不同,可能由于上述細胞因子由人類和小鼠基質細胞共同產生,因此對不同來源抗體的反應不同;人類和小鼠血漿細胞因子水平均無異常提高,產生該現象的可能原因是腹腔內腫瘤微環境與循環系統之間存在未知的“間隔物”(腹膜-血漿屏障),故推測腹腔內腫瘤微環境中趨化因子/細胞因子水平的升高可能與調節腫瘤-基質細胞間信息交流相關,但未對上述推測進行驗證,腫瘤微環境與循環系統間趨化因子/細胞因子及其他小分子物質含量的區別是未來解釋PMP發生發展的可能研究方向,“間隔物”提示PMP治療應采取腹腔內治療聯合全身治療的綜合策略。
5 PMP模型的干預研究
PMP模型的大體病理學、組織病理學、免疫組織化學與瘤源患者的一致性較強,可較好地呈現疾病的臨床病理特征,成為研究PMP的理想模型,常用于干預治療研究包括黏液溶液研究、靶向治療研究和抗炎藥物應用研究等。
5.1黏液溶解研究 細胞外黏液大量聚積導致腸梗阻、腹腔臟器粘連及營養不良是PMP患者死亡的主要原因,也是PMP最重要的特征[26]。PMP腫瘤組織鏡下常表現為大量黏液池及散布其中的黏液性上皮組織,黏蛋白/細胞比例可高達1 000 ∶1,黏液池成為腫瘤細胞的天然屏障,阻礙化療藥物及生物藥物殺傷癌細胞。由此可見,有效溶解黏液既可緩解腸梗阻、降低手術難度,還可進一步暴露腫瘤細胞,提高對藥物的敏感性。
應用不同黏液溶解藥物溶解腹腔內黏蛋白,但均出現不同程度的不良事件。腹腔灌注7%碳酸氫鈉溶液1 000 mL后出現臨界堿中毒;減瘤術后用10%右旋葡萄糖溶液500 mL灌洗,出現高糖血癥[血清葡萄糖>500 mg/dL(1 mg/dL=0.055 5 mmol/L)],提示7%碳酸氫鈉溶液和10%右旋葡萄糖溶液雖具備一定的黏液溶解作用,但確切療效有待進一步實驗證實[27-28]。Pillai等[29]對PMP黏液溶解的長期研究發現,糖苷鍵和二硫鍵是PMP黏蛋白分子內的主要連接結構,菠蘿蛋白酶(Bromelain)可水解糖苷鍵,廣泛用于水解大分子殼聚糖,而N-乙酰半胱氨酸可水解二硫鍵,用于溶解呼吸系統疾病黏液,據此成功在PMP裸大鼠模型上證實,治療組接受300 mg/mL菠蘿蛋白酶+4%N-乙酰半胱氨酸的最佳劑量方案(pH=7.0)治療72 h后,腹腔黏液完全溶解,而TRIS緩沖液對照組黏液未發生降解,黏液質量因水和作用較接種前增加,此方案有望廣泛應用于臨床使患者獲益。
5.2靶向治療研究 當前,國際上認為PMP是一種區域進展性疾病,腹腔內特定的腫瘤微環境可能有助于PMP發生發展。因此,針對腹腔腫瘤微環境的各個要素研制靶向制劑是治療PMP的可能方向。Dohan等[10]使用抗血管生成藥貝伐珠單抗治療PMP模型,單純貝伐珠單抗治療組的中位生存期較對照組顯著延長(PMCA1:79.8 d比58.4 d,P<0.001;PMCA2:81.6 d比58.2 d),血清血管內皮生長因子、胎盤生長因子、轉化生長因子-β水平明顯低于對照組;貝伐珠單抗聯合腫瘤細胞減滅術組的療效同樣優于對照組,表現為血流速度較對照組和術前水平顯著降低;血管造影顯示,治療后的裸小鼠腫瘤周圍新生血管較治療前規則分支減少;實驗從動物體重、腹圍、腫瘤新生血管情況、血清血管生成相關細胞因子水平多方面驗證了抗血管生成類藥物貝伐珠單抗治療PMP的療效,但未闡述貝伐珠單抗對腫瘤體積和質量的影響。
Dilly等[14]研究發現,PMP患者黏蛋白(mucin,MUC)2啟動子活性調節相關的促分裂原活化的蛋白激酶表達上調,使用特異性促分裂原活化的胞外信號調節激酶1/2抑制劑RDEA119 50 mg/kg治療PMP PDX模型顯示,RDEA119治療組腹腔內黏液性腫瘤重量顯著低于磷酸鹽緩沖液對照組(6.2 g比13.8 g,P<0.01),腫瘤生長與藥物劑量成反比;隨后LS174T細胞系的研究表明,RDEA119通過減少胞外信號調節激酶1/2和p38蛋白質的磷酸化而發揮抑制MUC 2分泌作用。
缺氧誘導因子-1α是缺氧過程細胞應答或腫瘤發展的重要轉錄因子,腫瘤耗氧增加及血管異常造成缺氧微環境,可誘導支氣管黏膜上皮缺氧誘導因子轉錄,進而結合于缺氧反應元件,激活MUC5AC基因表達。MUC2基因位于第11號染色體,鄰近呼吸道黏液主要成分MUC5AC基因,Dilly等[30]認為,缺氧誘導因子可通過相同途徑調控MUC2基因表達,并證實PMP腫瘤組織缺氧誘導因子-2α在缺氧微環境中的表達水平高于正常腸道組織;針對缺氧/缺氧誘導因子-1α通路,在PMP裸小鼠模型上采用缺氧誘導因子-2α抑制劑BAY 87-2243行長期治療,治療第28天取腫瘤組織行逆轉錄-聚合酶鏈反應結果顯示,MUC2信使RNA及MUC 2表達量顯著降低,MUC 2表達量與缺氧誘導因子-1α表達量呈正相關,且BAY 87-2243治療組裸小鼠治療后整體狀態較磷酸鹽緩沖液對照組體重更輕、腹圍更小、腹腔腫瘤總重量更輕,治療效果顯著。
腫瘤細胞不僅與基質細胞相互作用,還與細胞外基質成分相作用。近年來,腫瘤學家逐漸認識到腫瘤微環境對腫瘤細胞生長和侵襲的重要性,并對腫瘤微環境相關靶向藥物進行了研究,但腫瘤微環境對腫瘤生長、侵襲和轉移的調節作用尚不清楚。
5.3抗炎藥物應用研究 促炎細胞因子(如IL-1β、IL-6、腫瘤壞死因子-α)、多效性細胞因子(如IL-4、IL-13、IL-9)、細菌胞外產物(如脂多糖)、脂質介質(如血小板活化因子)等炎癥介質可通過作用于炎癥相關轉錄因子結合位點促進黏蛋白分泌[31]。常見的炎癥相關轉錄因子結合位點包括激動蛋白結合位點(激活子蛋白-1、激活子蛋白-2)、核因子κB結合位點、糖皮質激素應答元件結合位點和cAMP結合位點。Choudry等[13]將PMP模型分為地塞米松組(2 mg/kg)和磷酸鹽緩沖液對照組的研究發現,治療36 d后,地塞米松治療組裸小鼠腹腔腫瘤重量明顯低于對照組[(6.72±0.17) g比(13.02±0.96) g,P=0.002];地塞米松組腹圍小于對照組[(23.4±0.63) cm比(30.1±1.2) cm,P=0.003]。由此可見,地塞米松可抑制MUC 2分泌;糖皮質激素直接作用于糖皮質激素應答元件結合位點,從而抑制MUC 2黏蛋白分泌,或通過抑制核因子κB或激活子蛋白-1轉錄,間接減少MUC 2分泌,是地塞米松抑制MUC 2分泌的可能機制。
6 小 結
PMP是侵襲性較低的惡性腫瘤,常浸潤腹腔臟器漿膜層,實質浸潤少見,腹腔內大量黏液性腹水聚積是最主要的治療難題,黏液性腹水包裹腫瘤細胞,阻礙化療藥物對腫瘤細胞的直接殺傷作用;黏液逐漸硬化,壓迫并粘連腹腔臟器,給實施完全腫瘤細胞減滅術帶來困難。有效溶解腹腔內黏液后行腫瘤細胞減滅術+腹腔熱灌注化療,輔以化療及抑制黏蛋白分泌的特定靶向藥物,可殺傷腫瘤細胞、減少黏液分泌,同時改造腹腔內腫瘤微環境以控制腫瘤生長是針對PMP最有效的手術綜合治療策略。近年來,PMP PDX模型在溶解和抑制黏液分泌方面的研究進展揭示了PMP PDX模型腹腔內特定的腫瘤微環境,其大體病理學特征、組織病理學特征、分子病理學特征及臨床特征均與臨床PMP患者一致,性狀穩定的PDX模型將有助于PMP發生、發展機制以及發展新型綜合治療策略的研究。

