高考化學計算題的解題方法探究
方 針
(湖北省天門中學 431700)
通常情況下,在化學計算題的題干中往往所給的文字、符號和表達式比較多,從而營造“難理解、難解答”等一些假象使學生看到該問題往往會眉頭緊鎖.但該題型并不是無堅不摧的盾,想要能很好解答此類問題一方面要克服對該類題型的畏難情緒,敢于分析,另一方面要了解并掌握一些解題方法.
一、等量法
等量法是處理化學計算題最常用的方法,運用此方法的關(guān)鍵就是找出物質(zhì)反應前后量的變化.但運用此方法需要注意的是:
(1)所選用的差值要與物質(zhì)的數(shù)值有比例關(guān)系;
(2)在填寫數(shù)據(jù)和計算的過程中要正確使用單位,其原則為“上下要相同,左右要相當”.
例1白色固體PCl5受熱揮發(fā)并發(fā)生分解:

現(xiàn)將5.85 g PCl5裝入2.05 L的容器中,在277℃達到平衡,容器壓強為1.01×105Pa,混合氣體的物質(zhì)的量為0.05mol,求平衡時PCl5的分解率.
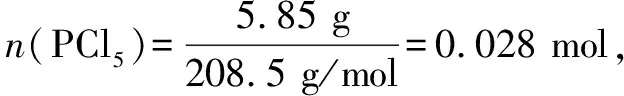

1 1 1 1
x
0.05 mol-0.028 mol=0.022 mol
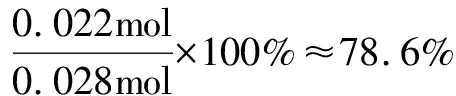
點撥此外本題還可以運用三段式進行解題,即通過設(shè)參加反應的PCl5、PCl3和量Cl2,然后根據(jù)混合氣體的物質(zhì)的量為0.05 mol,即可求出參加反應的PCl5,從而算出分解率.但是該方法受條件(可逆反應)所限制,即只能在可逆反應中才能使用,需要特別注意的.
二、極值法
在有些化學題目中經(jīng)常會遇到模糊、籠統(tǒng)的問題,解答此類問題最基本的方法為極值法,即將題目極限化處理,然后運用基本的化學知識進行分析判斷.而運用該方法解題的關(guān)鍵就要按照題干的條件,確定符合條件的極限假設(shè).
例2將總物質(zhì)的量為nmol的Na、Al(其中Na的物質(zhì)的量分數(shù)為x),放入一定量的H2O中,充分反應,Na、Al全部反應掉,一共生成了VL(標準狀況下)的氣體,下列說法中正確的是( ).
C.V=33.6n(1-x) D.11.2n 點撥本題最重要的是運用極值思想確定x的范圍,而其最容易出現(xiàn)錯誤的就是將x的范圍確定為0 學生之所以比較害怕計算題,其主要原因在于比較難分析其中復雜的反應關(guān)系.此時運用整體思維法解題就可以很好的避開這樣的攔路虎.所謂整體思維法,就是從整體上把握物質(zhì)的變化規(guī)律,從而達到快速解題的目的. 例3在15 g的Fe和Fe2O3中加入150 mL H2SO4(稀),生成1.68 L H2,此時Fe和Fe2O3全部反應,向反應的溶液中加入KSCN,未見顏色變化.為了中和過量的H2SO4且使Fe2+全部轉(zhuǎn)化為Fe(OH)2,一共反應掉了3 mol·L-1NaOH溶液200 mL,則原H2SO4的物質(zhì)的量濃度是( ). A. 1.5 mol·L-1B. 2mol·L-1 C. 2.5mol·L-1D. 3mol·L-1 點撥從本題的解析過程發(fā)現(xiàn),解答此題時并不需要寫出比較復雜的化學反應方程式,也不需要具體了解各個反應的反應情況.而是運用整體思維法,了解整體的反應情況,并且把握各物質(zhì)聯(lián)系的規(guī)律(離子守恒),從而實現(xiàn)高效的解題. 綜上所述,雖然化學計算題比較“難”,但是掌握解答該類題型必要的解題方法,無疑是獲得了一把能正確打開計算題大門的金鑰匙.因此學生要在平時的學習中加深對此類題型解題方法的了解和認識,并且建立牢固的化學基礎(chǔ)知識框架,相信一定能打倒化學計算題這只“紙老虎”.
三、整體思維法


