55例生長受限胎兒染色體微陣列分析
馬玉紅,韓 瑾,陸軍燕,陸 萍,陳基強,楊濟敏,彭擁花,劉玉娟
(1.東莞康華醫院產前診斷中心,廣東 東莞 523080;2.廣州市婦女兒童醫療中心產前診斷中心,廣東 廣州 510623)
胎兒生長受限(fetal growth restriction,FGR)又稱宮內生長受限,是指胎兒體重低于其孕齡平均體重的第10百分位數或低于其平均體重的2個標準差,是產科最常見也是最復雜的病癥之一[1]。FGR可增加胎兒窘迫、新生兒窒息等圍產期并發癥發病率和圍產兒死亡率,可導致出生后發育及智力發育落后,成年后代謝綜合征易感性增加。FGR病因復雜,孕婦、胎兒、胎盤和臍帶的異常因素均是其危險因素,其中胎兒染色體異常是導致FGR的重要原因之一。染色體微陣列分析(chromosome microarray analysis,CMA)技術可以檢測全基因組水平染色體拷貝數變異(copy number variation,CNV),還可檢測嵌合體(嵌合比例>20%)、雜合性缺失(loss of heterozygosity,LOH)及單親二倍體(uniparental disomy,UPD)等,目前已被廣泛應用于胎兒結構畸形、原發性智力低下、生長發育遲緩、自閉癥、多發畸形等異常的診斷及腫瘤遺傳學診斷等領域[2]。本研究應用全基因組CMA技術對55例產前超聲診斷的FGR胎兒進行檢測,探討FGR胎兒的基因組學病因及CMA技術在該類胎兒中的診斷應用價值。
1資料與方法
1.1研究對象
選擇2015年1月至2018年6月在東莞康華醫院產前診斷中心和產科診斷為FGR病例55例,孕婦年齡為28~42歲,孕周為22~34周。將FGR胎兒分為單純性FGR組(33例)和FGR合并其他超聲異常組(22例)。
1.2方法
產前診斷孕婦均填寫基本信息登記表,包括年齡、體重、末次月經、種族、生育史、疾病史、家族遺傳病史,孕婦在本次妊娠期間是否接觸過病毒及明顯致畸物質。所有病例需排除由明確母體因素引起的FGR,如妊娠期高血壓疾病及母體營養因素異常等。所有研究對象均簽署知情同意書,取得本院倫理委員會批準。
1.3儀器的選擇
CMA的檢測按照美國Affymetrix公司生產的CytoScan HD芯片檢測標準流程進行操作,應用配套的ChAS軟件及生物信息學方法進行數據分析。參照人類細胞遺傳學國際命名體制(ISCN2009)標準進行染色體核型分析診斷,CytoScan HD芯片同時具備195萬個CNV探針和75萬個SNP探針。
1.4產前診斷
在孕婦及家屬知情同意下,自愿選擇超聲引導下羊膜腔穿刺術(16~24周)或臍帶血穿刺術(>24周),獲得胎兒羊水或臍血樣本。孕婦取仰臥位,常規腹壁消毒,超聲引導下行羊膜腔穿刺或臍帶血穿刺術,獲取胎兒標本(羊水20mL或臍帶血1.5mL)。同時抽取其家系成員外周血2mL注入EDTA抗凝管中,顛倒混勻后置于4℃冰箱中保存,剩余標本置-80℃保存。
1.5 CMA數據分析
采用ChAS 2.0軟件,選取長度≥100kb缺失/重復片段(可信度≥90%)進行分析,數據為CEL文件格式。根據CNVs的性質不同,將其分為致病性CNVs、不明確意義CNVs(variants of unknown significance,VOUS)及良性CNVs三類。數據分析包括實驗室內部數據庫及在線公共數據庫,如OMIM(http://www.omim.org)、DGV(http://www.projects.tcag.ca/variation)、DECIPHER(http://www.sanger.ac.uk/PostGenomics/decipher)、USCS(http://genome.ucsc.edu)及PubMed(http://www.ncbi.nlm.nih.gov/pubmed)。
1.6統計學方法
采用SPSS 16.0軟件進行統計學分析。計數資料用例數和百分數表示,應用校正χ2檢驗進行組間比較,以P<0.05為差異有統計學意義。
2結果
2.1 CMA的研究情況
在55例FGR樣本中,致病性CNVs檢出8例,檢出率為14.5%(8/55),病理性CNV病例見表1;其中單純性FGR組致病性CNVs檢出率為9.1%(3/33),FGR合并其他超聲異常組致病性CNVs檢出率為22.7%(5/22),片段小于5Mb致病性CNVs占5.4%(3/55),檢出VOUS占3.6%(2/55)。
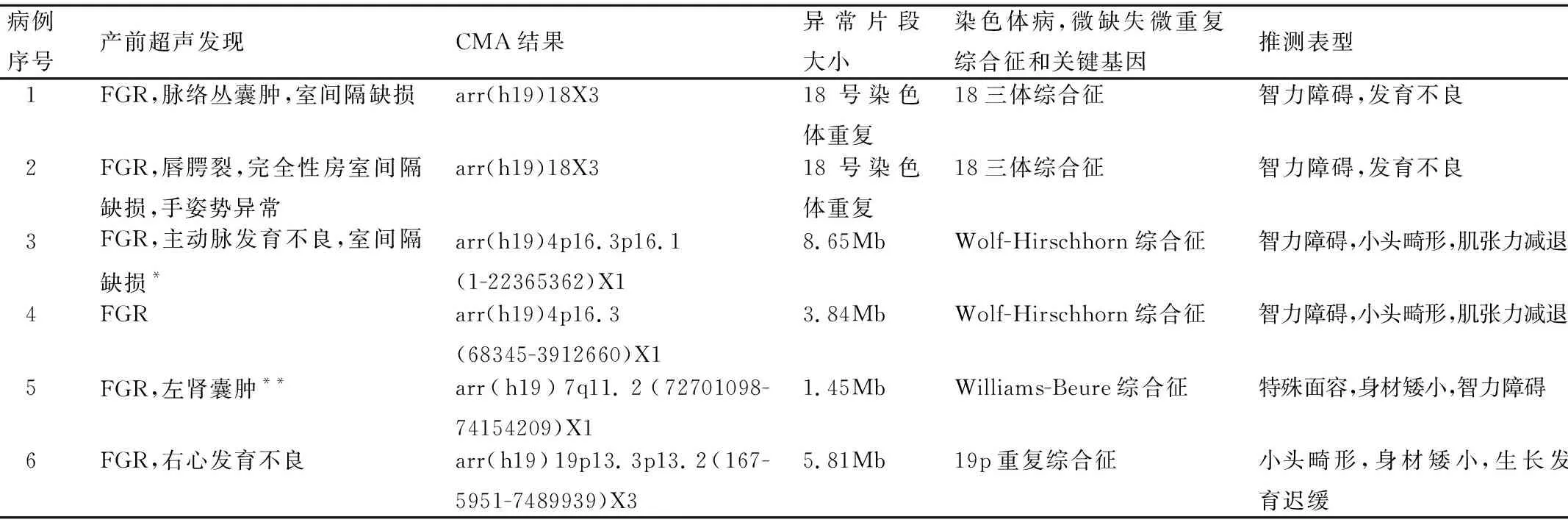
表1 8例病理性CNV產前超聲和CMA結果
(轉下表)
(續上表)
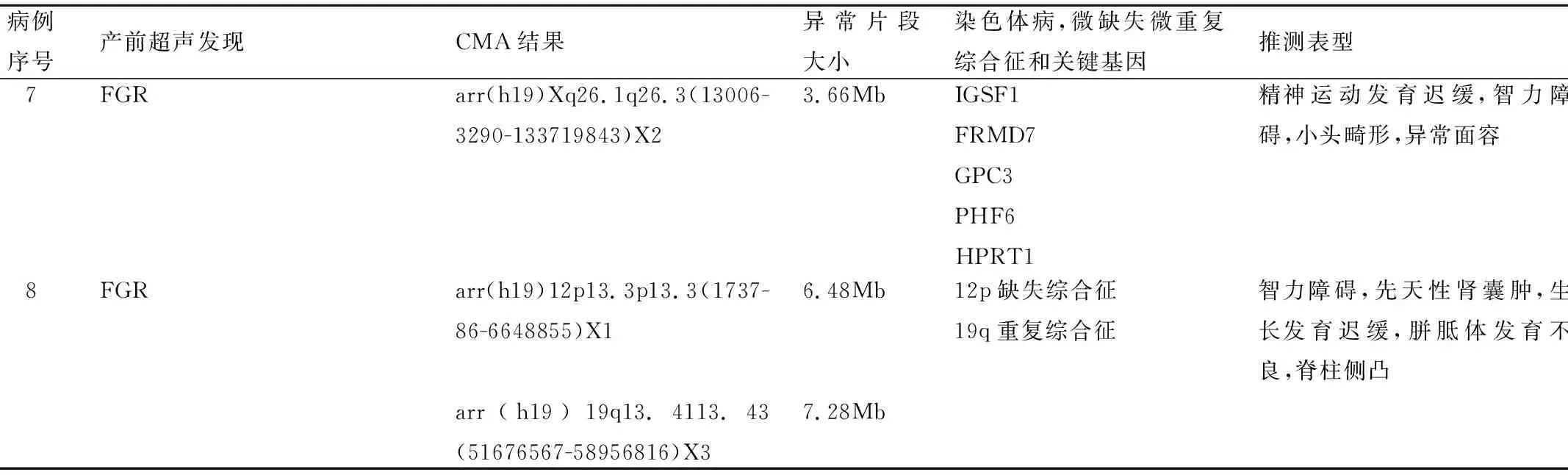
病例序號產前超聲發現CMA結果異常片段大小染色體病,微缺失微重復綜合征和關鍵基因推測表型7FGRarr(h19)Xq26.1q26.3(13006-3290-133719843)X23.66MbIGSF1FRMD7GPC3PHF6HPRT1精神運動發育遲緩,智力障礙,小頭畸形,異常面容8FGRarr(h19)12p13.3p13.3(1737-86-6648855)X1arr(h19)19q13.4113.43(51676567-58956816)X36.48Mb7.28Mb12p缺失綜合征19q重復綜合征智力障礙,先天性腎囊腫,生長發育遲緩,胼胝體發育不良,脊柱側凸
注:*見圖1,**見圖2。
2.2產后隨訪情況
對全部病例進行了電話隨訪及產后超聲復查,了解患者妊娠結局,其中12例選擇引產,40例分娩,3例失訪;在40例分娩的病例中,除1例出現精神運動發育遲緩外,其余生長發育評估基本正常。
2.3單純性FGR組與FGR合并其他超聲異常組CNVs檢出情況
單純性FGR組、FGR合并其他超聲異常組CNVs檢出率分別為9.1%(3/33)和22.7%(5/22),兩組比較差異無統計學意義(χ2=0.843,P=0.358)。不同性質CNVs的檢出率見表2。

表2 55例FGR病例不同性質CNVs的檢出比較結果[n(%)]

圖1 Wolf-Hirschhorn綜合征(WHS)典型病例3的CMA圖

圖2 Williams-Beure綜合征(WBS)典型病例5的CMA圖
3討論
3.1 FGR發病原因及機制
FGR發病原因及機制較為復雜,母體因素、多胎、胎兒感染和遺傳因素等均可能導致FGR。在遺傳因素中,染色體異常是導致FGR的重要原因之一,其中最常見的是染色體三體,如18三體和13三體綜合征,還有染色體結構異常等病因[3]。隨著現代分子生物學技術的不斷發展、基因研究方法的不斷涌出及基因組序列改變引發胚胎發育異常相關研究的深入,越來越多的基因組異常疾病被發現與FGR有關。本研究所使用的CNVs檢測技術具有高分辨識別基因組不平衡CNV、UPD及較低水平嵌合體的CMA技術,在快速識別和鑒定疾病相關基因方面具有較高的優勢。2014年8月,國內亦達成了“CMA技術在產前診斷中的應用專家共識”,進一步明確了CMA在產前診斷中的應用價值[4]。
3.2 CMA檢測結果分析
本研究采用Affymetrix公司的CytoScan HD芯片平臺共計對55例FGR病例進行了檢測,對臨床實踐具有較好的指導意義。本研究顯示,FGR合并其他超聲異常組的CNVs檢出率為22.7%(5/22),顯著高于單純性FGR組的9.1%(3/33),兩組比較差異無統計學意義(P>0.05),合并的畸形主要為心血管畸形和神經系統異常。吳星等[5]的研究中提出單純性FGR和合并其他結構畸形的檢出率分別為11.1%和18.4%,與本研究結果類似。
3.3核型分析與CMA技術優缺點的比較
染色體核型分析作為傳統的檢測方法用于產前診斷多年,可檢測全基因組水平染色體數目或較大的結構異常。本研究中有2例為常見的18三體病例。常規的G顯帶核型分析只能檢測到10Mb以上的染色體片段異常,即使高分辨G顯帶核型分析也較難檢出小于5Mb的染色體變異,而且對細胞培養要求較高,臨床實施困難。在本研究8例CMA異常病例中,有3例CNVs片段小于5Mb,更說明應用CMA的臨床價值;采用CMA技術不僅可以檢測出常規染色體核型異常,還可額外檢出5.4%(3/55)染色體組的異常。另外在本研究的病例中,致病性片段染色體的分布分別為4p16.3、7q11.2、12p13.3、19p13.3、19q13.4和Xq26.1,分布在不同的染色體,且無明確的規律性,進一步證實了FGR的遺傳學病因除了與染色體結構異常或非整倍體有關,還與不同染色體亞顯微結構異常有關。因此說明高分辨全基因組水平檢測技術對FGR的病因學檢測具有一定的優勢[6]。無論是單純性還是合并其他結構畸形的FGR患者,首先推薦CMA進行遺傳學病因的檢測。
3.4特殊病例的分析
本研究發現病例3和病例4診斷為Wolf-Hirschhorn綜合征(WHS),該病新生兒的發病率為1/50 000,關鍵區域在染色體4p16.3的165kb范圍內,為開始形成受精卵的早期發育過程中隨機出現的染色體缺失,也可為4號環狀染色體或父母一方為4號染色體短臂的平衡異位攜帶者等原因所造成,由于其患兒臨床特征性的外貌,即寬鼻梁、前額突出、眼距寬、大而突出的眼睛、小下頜、嘴角下垂等表現,也稱為“希臘武士頭盔”的面容,該類患兒出生后有生長發育障礙、智力低下、肌張力減退、癲癇、先心病、骨骼畸形等各種異常。WHS的典型體征和癥狀與4號染色體短臂末端多種基因的丟失有關,丟失片段的大小決定了個體體征異常的程度,丟失片段大的較片段小的有更嚴重的智力障礙。本研究2例的缺失片段大小分別為8.65Mb和3.84Mb,屬于較為常見的類型[7],可在出生后很大程度上表現出WHS的表型特征。
本研究中還發現病例5為Williams-Beure綜合征(WBS),超聲顯示除生長發育遲緩,還存在腎臟發育異常,產前診斷為7號染色體長臂1.45Mb缺失,包括25~30個基因,7q11.23區域低拷貝重復序列(low copy repeats,LCR)重排是WBS患者發病的原因,大約95%的WBS患兒存在的1.5~1.8Mb缺失,即典型缺失,這些缺失中2/3是因減數分裂過程中7號染色體同源重排所致,1/3是由染色體內的重排所致,此類父母的WBS區域發生了7號染色體臂內倒位是重要原因之一。WBS患兒出生后的臨床表現為特殊面容,表現為“精靈面容”,張嘴突唇、牙齒稀疏、咬合不正、心血管主動脈瓣上狹窄是最常見的臨床表現,患兒有智力發育遲緩,語言能力和聽覺機械記憶能力很強,視覺空間的構建能力很差,15%有特征性地先天性高鈣血癥[8]。
病例6為羊水CMA發現為19p重復綜合征[9]。病例7是男性胎兒,為IGSF1、FRMD7、GPC3、PHF6、HPRT1缺失,主要臨床表現為精神運動發育遲緩、智力障礙、小頭畸形、共濟失調等[10]。病例8為12p6.48Mb缺失和19q7.28Mb的重復,12p13.33微缺失綜合與19q13.4重復相互協同,也主要表現為智力障礙,生長發育遲緩,腦發育異常和器官的異常,建議對父母行染色體的檢查,排除其中一方患有染色體的平衡易位[11]。但由于本研究中的病例絕大多數來自外院轉診,在獲知胎兒存在病理性CNV后,多選擇終止妊娠,因而缺乏對CMA結果和相應病例遠期預后的隨訪評估結果。
CMA技術也有一定的局限性,在臨床實踐中可能會發現大量的臨床意義不明確的VOUS,這將會給遺傳咨詢與臨床處理帶來困難,VOUS的檢出率取決于微陣列芯片的類型和研究的群體,因此建議對病例的父母進行基因組DNA的檢測。CMA檢測前與檢測后的遺傳咨詢非常重要,檢測前需要孕婦及其家屬簽署知情同意書,內容包括CMA技術的優勢、局限性和可能的結果,檢測后也應具備對不同的臨床報告結果解讀的能力,并能夠提供與之相對應的具體的臨床處理方式和流程。

