SIRT1與肝細胞癌病理及預后的研究進展及靶向治療展望
林治華,王俊偉,鄧雅庭,李 靜,王 娟
(1.重慶理工大學 藥學與生物工程學院, 重慶 400054; 2.靶向藥物篩選與活性評價重慶市高校重點實驗室, 重慶 400054; 3.重慶大學 化學化工學院, 重慶 400044)
肝細胞癌(HCC)為全球第五大常見惡性腫瘤,2016年,全球1 090萬例癌癥新增病例中,肝癌就有78.2萬例[1]。中國肝癌的患病、死亡率占亞洲近70%。在過去幾十年中,HCC的診斷和治療已經取得了較大發展。然而,HCC仍然與高死亡率相關,即使治療被認為具有潛在治愈性,該腫瘤的預后還是很差[2]。此外,調控HCC發展和進展的分子變化和機制尚不清楚。肝病尤其是肝癌由于早期癥狀不明顯所以不易被人發現,在診斷出時癌細胞已大多發展到中晚期,錯過了良好的治療時機。因此,HCC在目前的治療手段主要是以手術結合放化療為主,預后效果很差,死亡率也極高。人們通常認為CD8+T細胞在抗腫瘤免疫應答中起重要作用,并且耗盡的CD8+T細胞有助于肝細胞癌(HCC)進展。NK細胞是肝臟中主要的淋巴細胞亞群和防御感染腫瘤的第1道防線,對其在HCC患者腫瘤進展中的特殊作用已有深入研究。NKG2A在NK細胞和NKG2A配體HLA-E在瘤內肝癌組織中的表達增加。這些NK細胞,尤其是CD56dimNK細胞,NKG2A表達較高,表現為功能衰竭,預后較差[3]。因此,探求出新的HCC診斷標識物和治療靶點是當前研究的熱點。
沉默信息調節因子2同系物1(SIRT1)是一種依賴煙酰胺腺嘌呤二核苷酸(NAD+)的去乙酰化酶,它在正常的胚胎發育、分化及維持自身平衡中是不可或缺的。SIRT1在從酵母到人類的進化過程中,是細胞代謝、長壽、衰老、凋亡、分化、應激反應、能量代謝之間的關鍵環節。SIRT1在細胞存活中的作用是通過關鍵細胞周期分子和凋亡調節蛋白[4](包括Foxo家族蛋白、Ku70、NF-Κb和p53)的脫乙酰化來實現的。
近年來,大量文獻表明,SIRT1在腫瘤發生和發展中起著重要的作用[5-10],因此SIRT1與腫瘤之間的關系也成為了腫瘤研究領域的一個熱點。
1 SIRT1與腫瘤的發生發展
大量研究表明,在許多腫瘤組織中SIRT1的表達水平顯著增加,如白血病[5]、皮膚癌[6]、前列腺癌[7]、大腸癌[8],并且其在控制細胞衰老和衰老中的功能可能與腫瘤發展和腫瘤細胞對SIRT1過表達的依賴性有關。SIRT1在腫瘤發生發展中有著兩種截然不同的作用:一方面,作為促進細胞存活的基因,SIRT1可能具有致癌功能。例如,SIRT1脫乙酰化和下調p53,這可以延長細胞類型如神經元和肌肉細胞的壽命,但是在具有分裂細胞的組織中會引起癌癥[9]。另一方面,作為促進生物存活的基因,SIRT1可能有腫瘤抑制功能[10],這些在研究中一直存在爭議。如今,一些SIRT1抑制劑也被學者用于腫瘤相關研究,如表1所示。值得一提的是,僅僅只有3-TYP這種SIRT1抑制劑針對的腫瘤是肝細胞癌,并且該抑制劑還是SIRT3抑制劑,特異性不夠強。研究者發現 SIRT1 在HCC組織及HCC系中的表達異常,增高數倍,SIRT1 的基因沉默可以顯著抑制HCC的生長并誘導其老化,這與SIRT1 在維持HCC的增殖及端粒末端的穩定性上具有重要作用有關[3],此外,SIRT1已被報道在HCC中起腫瘤啟動子的作用[11],提示了SIRT1可能作為肝癌的一個新的標識物以及治療靶點。
表1 SIRT1抑制劑
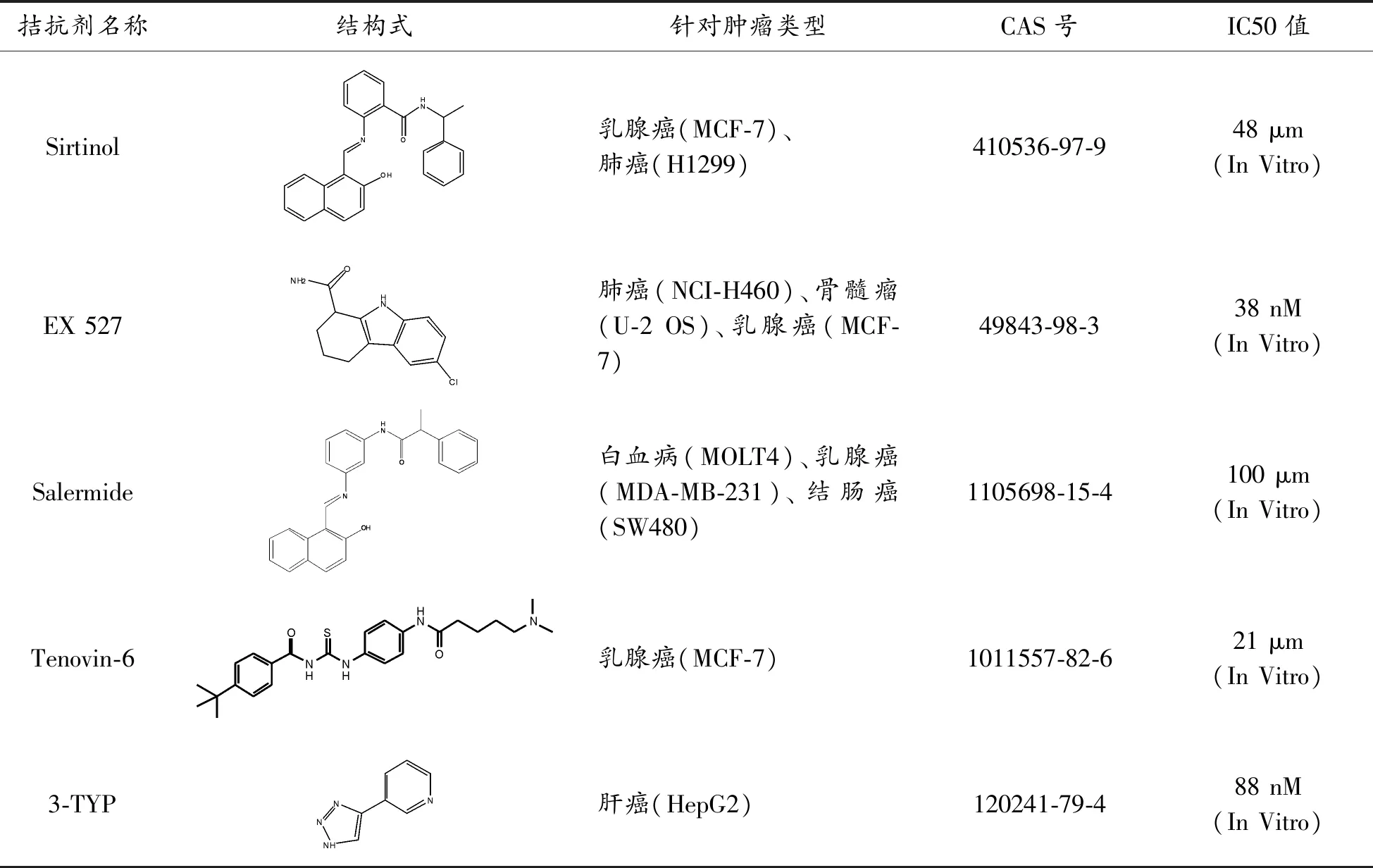
拮抗劑名稱結構式針對腫瘤類型CAS號IC50值Sirtinol乳腺癌(MCF-7)、肺癌(H1299)410536-97-948 μm(In Vitro)EX 527肺癌(NCI-H460)、骨髓瘤(U-2 OS)、乳腺癌(MCF-7)49843-98-338 nM(In Vitro)Salermide白血病(MOLT4)、乳腺癌(MDA-MB-231)、結腸癌(SW480)1105698-15-4100 μm(In Vitro)Tenovin-6乳腺癌(MCF-7)1011557-82-621 μm(In Vitro)3-TYP肝癌(HepG2)120241-79-488 nM(In Vitro)
2 SIRT1在肝細胞癌中的臨床病理意義及預后
Jiang等[11]的研究表明,SIRT1是HCC的致癌蛋白,并且是肝癌手術切除后惡化結果的預測因子。他們的研究結果表明:SIRT1在HCC中過表達,發現SIRT1表達升高與肝癌患者預后不良相關。SIRT1的去乙酰化酶活性是肝細胞癌中SIRT1致癌作用的關鍵。當SIRT1的去乙酰化區域發生突變時,HCC細胞增殖和集落形成受到抑制[12]。例如,SIRT1可以使LC3去乙酰化,在HepG2細胞中誘導自噬[13]。此外,p53是SIRT1研究最廣泛的靶點,SIRT1可以抑制細胞衰老和凋亡,從而刺激HCC中的腫瘤發生[14]。失活的SIRT1 (Ser 47上無磷酸化)可與突變的p53結合,從而激活AMPK/mTOR通路,在HCC中發揮致癌作用。Jiang等[11]的臨床病理分析顯示,SIRT1的表達增加與高表達的p53在HCC中相關(OR(odds ratio)=2.71,95%CI(confidence interval):1.39-5.29,P=0.003)。乙型肝炎病毒(HBV)是引起HCC的主要原因之一,SIRT1在hbv感染細胞中上調,其轉錄和復制可以在HCC中上調[15]。在他們的臨床病理分析中可以發現:SIRT1表達增加在hbv感染的HCC中更為常見(OR=1.63,95%CI:1.04-2.57,P=0.03)。到目前為止,沒有有效的治療可用于HCC。基于SIRT1在癌細胞生長和存活中的功能作用,阻斷SIRT1活性可能有益于HCC患者,所以應進一步研究以檢測這些抑制劑對HCC的影響。
3 SIRT1與c-Myc協同治療HCC的進展及預后
c-Myc基因是Myc基因家族的重要成員之一,具有可易位、調節多種物質、無限增殖、促進細胞分裂等作用,c-Myc基因參于細胞凋亡并且與多種腫瘤發生發展有關。
SIRT1在腫瘤發生中的作用在SIRT1和致癌c-Myc之間的關聯是有爭議的。最近,有報道稱c-Myc與SIRT1在腫瘤發生中呈正相關[16]。在結直腸癌中,c-Myc增加了SIRT1蛋白水平和SIRT1的脫乙酰酶活性[16]。此外,SIRT1還增加了c-Myc的轉錄活性并在成纖維細胞中穩定[16]。SIRT1介導的c-Myc脫乙酰基增加了c-Myc的半衰期,并促進了c-Myc/Max關聯,從而抑制細胞衰老和抑制凋亡[16]。相反,早期的一份研究報告顯示,盡管c-Myc轉錄增加,SIRT1通過脫乙酰作用使c-Myc去穩定化,因此表明SIRT1是Myc靶向性腫瘤發生的負調控因子[17]。在Yuan等[16]的研究中,證明SIRT1和c-Myc的表達呈正相關,并且均促進腫瘤細胞的增殖。在Tet-O-MYC細胞中誘導的c-Myc表達導致SIRT1相應增加了表達,并且SIRT1的過表達也導致增加c-Myc表達。相反,致癌性c-Myc沉默導致SIRT1表達顯著且緊密。有趣的是,致癌c-Myc再激活導致SIRT1表達的迅速逆轉。人類HCC細胞系中SIRT1調節的生物學效應與在小鼠Tet-O-MYC細胞中觀察到的相同。此外,人類HCC中的SIRT1表達與c-Myc和Ki67的表達顯著相關。這些發現一起支持SIRT1和MYC在小鼠和人類肝細胞增殖和存活中的表達一致的作用。當考慮c-Myc作為有效的致癌基因的作用時,這些結果表明SIRT1可以被認為是c-Myc在肝臟腫瘤發生中的重要靶標。
根據c-Myc和SIRT1在Tet-O-MYC肝癌細胞中表達的正相關性[18],Kim等[19]檢測到人類HCC中SIRT1和c-Myc之間存在顯著的免疫組化關系。此外,Sirt 1和c-Myc的表達預示HCC患者的OS(overall survival,總生存)和DFS(disease-free survival,無病生存期)更短。這些發現一起表明SIRT1似乎在肝臟腫瘤發生中具有重要作用。此外,c-Myc的表達與HCC患者已確定的不良臨床病理特征(包括低血清白蛋白和晚期臨床分期)顯著相關。此外,當Yuan等[16]分析c-Myc和SIRT1對HCC患者的預后影響時,表達c-Myc和SIRT1的患者與不表達c-Myc和SIRT1的患者(平均總生存時間分別為48.456 7、115.086 7個月)相比顯示出更短的OS和DFS。因此,這些數據表明 c-Myc和SIRT1在肝腫瘤發生中以及c-Myc和SIRT1在肝臟腫瘤發生中的獨立作用之間存在相關性。類似于上述結果,先前已報道c-Myc表達與HCC的進展和不良預后相關[20]。然而,目前還不清楚SIRT1是否是HCC的真正預后指標。最近的一篇報道提出SIRT1可能是HCC的預后指標[16],但其他報道無法發現SIRT1的預后意義。
值得注意的是,SIRT1表達也與HBV感染顯著相關。SIRT1通過其在HBV感染中誘導的組蛋白脫乙酰酶的活性也有助于肝臟腫瘤發生發展。為了進一步確定SIRT1準確的腫瘤促進機制,有必要進一步研究。
總之,這些研究結果表明:SIRT1與c-Myc在肝癌發生中協同作用,可能是調節肝癌的重要分子靶點。正如其他研究[21]發現抑制SIRT1可能是預防高危患者腫瘤發展的有效策略,或作為已建立腫瘤的治療策略。總之,研究結果表明SIRT1和c-Myc可能參與HCC的進展,并且這兩種分子都可以用作總體HCC預后的臨床指標。
4 SIRT1在肝細胞癌中與P53之間的關系
人體抑癌基因p53的失活對腫瘤形成起重要作用,其野生型使癌細胞凋亡,從而防止癌變,而突變型則會促進癌變。p53腫瘤抑制基因是人類腫瘤中突變最頻繁的基因。
SIRT1在腫瘤發生發展中的作用存在爭議,以前的研究表明:SIRT1的功能取決于腫瘤發生的階段并且可能是腫瘤類型特異性的。在Zhang等[12]的研究中,他們通過體外、體內和19項臨床研究證明了SIRT1、AMPK和p53在HCC中的重要作用。其數據表明SIRT1的作用取決于HCC細胞和腫瘤的p53突變狀態,這支持對HCC患者的預后和治療評估中的生物標志物評估的需求。通常認為SIRT1會破壞細胞周期控制,并通過p53脫乙酰化和失活促進腫瘤發展,表明p53是SIRT1和SIRT1致癌活性之間的重要中間體[22]。 最近,有報道表明AMPK和SIRT1之間通過細胞NAD +動態水平相互作用[23]。
Ganesan等[24]推測SIRT1是誘導AMPK磷酸化和抑制mTOR通路所必需的,事實上,shRNA對SIRT1的抑制通過突變型p53細胞PLC5-sh SIRT1中的磷酸化AMPK降低激活了mTOR(Ser2448)的磷酸化[12]。
個別SIRT1靶標的重要性可能取決于所研究的細胞過程和細胞類型[25]。然而已經表明磷酸化SIRT1可以通過直接與必需因子(即mTOR)相互作用來調節細胞存活[26]。在這種情況下,Zhang等[12]的研究結果表明:磷酸化SIRT1(Ser47)仍然對突變p53 HCC中的應激誘導的激活有響應。此外,磷酸化SIRT1可通過某種腫瘤抑制途徑抑制HCC生長。
5 SIRT1在HCC細胞自噬中的作用
自噬是將自身的細胞質蛋白或細胞器吞噬并包裹成囊泡的過程,從而實現細胞自身的代謝需要。在腫瘤研究中其作用尚未研究透徹。
保護性自噬已被證明是癌細胞化療耐藥的潛在機制[27]。Xiong等[28]研究表明:HULC(highly upregulated in liver cancer)引發的保護性自噬減弱了HCC細胞對化學治療劑的敏感性。另外,他們發現HULC通過上調SIRT1蛋白引起自噬。眾所周知,SIRT1通過調控Atg5、Atg7、Atg8、Beclin I、FoxO1、p53等許多重要的自噬組分誘導自噬[29]。他們的結果顯示HULC通過增強SIRT1介導的Atg5和Atg7的脫乙酰化來促進HCC細胞的自噬。此外,以前的報道將SIRT1在HCC中的高表達歸因于其翻譯后調節,因為SIRT1 mRNA在HCC和相鄰非癌組織之間沒有顯著差異[5]。Xiong等[28]首次證實HULC的上調至少部分是由于HCC中SIRT1蛋白的升高。隨后,USP22被鑒定為參與HULC介導的SIRT1誘導。同時,需要注意的是,在HULC過表達之后,MDM2(mdm2癌基因在多種腫瘤中發現其發生突變與擴增轉移,而且mdm2突變與p53突變不共存)似乎略微減少。最近,據報道,MDM2增強了SIRT1的泛素化并促進其在DNA損傷誘導的細胞死亡過程中的降解[30],這可能提供了HULC調控SIRT1除USP22以外的另一種手段。當然,它需要進一步的研究來闡明MDM2是否參與HULC介導的SIRT1誘導。
USP22是去泛素化酶(DUBs)的成員,可以催化去除靶蛋白中的泛素。USP22參與NAD+依賴性蛋白脫乙酰酶SIRT1[31],以及組蛋白H2A和H2B的去泛素化[32]。最近,有證據表明,USP22參與了包括HCC在內的多種癌癥預后不良相關的癌發生[33]。在Xiong等[28]的研究中,證明了lncRNA HULC可以顯著上調USP22的蛋白質水平,并且USP22在介導HULC誘導的去泛素化和穩定SIRT1在HCC細胞中具有關鍵作用。然而,在之前的報道顯示,USP22在調節SIRT1蛋白中發揮不同的作用。這些研究之間的差異可能歸因于各種細胞的背景或對細胞的不同刺激因素。此外,他們篩選出3種新型miRNA(miR-6825-5p、miR-6845-5p和miR-6886-3p),并證明它們可以直接靶向USP22 3’-UTR。有趣的是,他們發現miR-6886-3p抑制USP22表達,盡管該miRNA未預測靶向USP22 3’-UTR。據報道,在miRNA的5’末端稱為“種子區域”的6到8nt(核苷酸酶)長的片段,并引發靶向mRNA反應(促進mRNA降解或抑制mRNA翻譯)[34]。然而,越來越多的證據表明,存在與miRNA種子序列不完全互補但仍能有效抑制基因表達的“非規范”位點,并且約占種子序列相互作用的60%[35]。因此,miR-6886-3p抑制USP22表達應該在HCC細胞中以非規范的方式進行。
HULC降低了3種miRNA(miR-6825-5p、miR-6845-5p和miR-6886-3p)的表達和活性[28],提高了USP22蛋白質水平,增強了去泛素化SIRT1并穩定它,最終引發HCC細胞的自噬。此外,HULC/SIRT1/自噬途徑在化療藥物存在下被激活,通路的干擾增強了HCC細胞的化療敏感性。總之,這些發現說明了HULC的一個新功能,“HULC/USP22/SIRT1 /保護性自噬”途徑可能成為開發HCC化療敏感策略的新靶點。
6 展望
隨著研究的深入,雖然有少數研究證明SIRT1在HCC的演變發展中起著抑制的作用,但是更多的研究表示,SIRT1促進了HCC的演變,這些觀察結果促使研究人員假設健康肝臟組織中的SIRT1活性可以抑制腫瘤的發生,然而在轉化后,SIRT1表達或其過表達可能為腫瘤細胞提供保護或存活優勢。抑制SIRT1會損害動物模型中的腫瘤細胞生長,并且可能使用小分子抑制劑在體外和體內實現抗腫瘤作用,并共同表明SIRT1可能是一種新型治療癌癥的靶標。本實驗室丁雪壘等[36]的研究中,采用sybyl2.0藥物虛擬篩選軟件,選取 33個噻吩并[3,2-d]嘧啶-6-甲酰胺類SIRT1-3抑制劑,進行三維定量構效關系(3D-QSAR)研究,為篩選高活性 SIRT1-3抑制劑的研究奠定基礎。抑制SIRT1的表達可能會有效地抑制肝癌的發生發展。SIRT1是否作為致癌基因或腫瘤抑制因子尚不清楚,但這些發現提供了有力的論據:SIRT1可能是腫瘤發展的關鍵調節器。SIRT1 的生物學功能多樣,且極為關鍵和重要,與人類的多種腫瘤也密切相關。然而,SIRT1 在HCC中自噬的作用還需要更深入的研究,SIRT1表達與性別、HBV感染、TNM分期、AFP水平、p53表達和腫瘤大小有關,但研究都不夠深入,在本實驗室丁雪壘[37]的研究中,選取SIRT1蛋白與尼克酰胺、EX527,在基于SIRT1受體下,通過高通量虛擬篩選以及分子模擬篩選并且合成出化合物T,通過CCK-8增殖抑制試驗、Annexin V-FITC/PI雙染,流式細胞儀檢測、Western blot法、裸鼠模型等方法,得出該化合物對肝細胞癌HepG2有特異性的抑制作用。本實驗室的劉蒙蒙[38]在此基礎上,將HepG2細胞中的SIRT1進行敲除,采用CCK-8 增殖抑制法檢測化合物T對HepG2及其敲除細胞的增殖抑制率,得出化合物T對SIRT1敲除細胞均有一定的增殖抑制作用,所以小分子化合物T有望作為抗腫瘤藥物,特別是抗HCC的靶向藥物。盡管如此,關于SIRT1靶點針對肝細胞癌的抑制劑研究也不夠深入,如果以此作為切入點,對肝細胞癌的臨床研究與治療將會有一個很大的進展。總之,SIRT1表達可能作為HCC潛在的治療靶點和預后指標,為以后的研究提供了方向和路線。

