大豆凝集素純化及凝集活性測(cè)定的研究
張柏林 劉寧 王雙雙


摘要:通過(guò)建立快速大豆凝集素(SBA)粗提液制備方法,利用N-乙酰-D-半乳糖胺-epoxy-Sepharose 6B親和層析制備體系制備大豆凝集素樣品,采用聚丙烯酰胺(SDS-PAGE)及紅細(xì)胞凝集試驗(yàn)分別對(duì)本試驗(yàn)制備的大豆凝集素進(jìn)行純度及凝集活性的檢測(cè)。結(jié)果表明,試驗(yàn)制備的大豆凝集素的產(chǎn)率為135 mg/100 g;所制得的大豆凝集素樣品的純度較高,與大豆凝集素標(biāo)準(zhǔn)品基本一致;其凝集活性為256。研究成果可為大豆凝集素的量化生產(chǎn)提供技術(shù)參考。
關(guān)鍵詞:大豆凝集素;分離純化;親和層析;凝集活性
中圖分類(lèi)號(hào):S816.4 ??文獻(xiàn)標(biāo)志碼: A ?文章編號(hào):1002-1302(2019)12-0221-03
大豆凝集素粗提液的制備一般采用硫酸銨逐級(jí)沉淀法[5-6],但硫酸銨逐級(jí)沉淀步驟繁瑣,且硫酸銨會(huì)引起小部分蛋白的變性。因此,探索一種高效安全的大豆凝集素粗提液制備方法成為大豆凝集素量化提純的重要前提。Liner利用離子交換和磷酸鈣層析制備大豆凝集素[7]。Liener等在不同pH值條件下采用硫酸銨分步沉淀法進(jìn)行大豆凝集素的分離純化試驗(yàn)[8]。Wade等也建立離子交換纖維素及羥基磷灰石層析法,并成功得到純化的大豆凝集素[9-10]。但上述大豆凝集素純化方法具有純化效率低的缺點(diǎn),探索一種高效制備純化大豆凝集素方法成為研究者關(guān)注的熱點(diǎn)。因此,筆者根據(jù)大豆凝集素能專(zhuān)一性和可逆性地與相應(yīng)的配基或配體發(fā)生特異性結(jié)合,對(duì)大豆凝集素的純化方法進(jìn)行進(jìn)一步的完善。目前主要采用親和層析法進(jìn)行大豆凝集素的制備,根據(jù)所采用凝膠載體和糖配體的不同,主要分為半乳糖胺-CH-Sepherose 4B親和層析體系[5]、N-乙酰基-D-半乳糖胺-epoxy-Sepharose 6B親和層析體系[11-12]和瓜爾膠親和層析體系。研究者發(fā)現(xiàn),無(wú)論從大豆凝集素的純化效率還是所制備的大豆凝集素的純度上看,N-乙酰基-D-半乳糖胺-Sepharose 6B親和層析體系都優(yōu)于半乳糖胺-CH-Sepherose 4B和瓜爾膠親和層析體系[13]。本研究首先針對(duì)大豆凝集素粗提液的制備進(jìn)行了改良,并選用純化效率較優(yōu)的N-乙酰基-D-半乳糖胺-Sepharose 6B大豆凝集素親和層析體系,以貴州省本地大豆品種為材料進(jìn)行大豆凝集素的純化。
1 材料與方法
1.1 主要試劑和儀器
1.1.1 主要材料與試劑 大豆購(gòu)自貴州省農(nóng)業(yè)科學(xué)院油料(香料)研究所;正己烷(沸點(diǎn)68.74 ℃),購(gòu)自國(guó)藥集團(tuán)化學(xué)試劑有限公司、氯化鈉(分析純),購(gòu)自國(guó)藥集團(tuán)化學(xué)試劑有限公司、N-乙酰基-D-半乳糖胺-Sepharose 6B親和層析凝膠,購(gòu)自Sigma公司、聚乙二醇20 000、丙烯酰胺、N,N′-甲叉雙丙烯酰胺、β-巰基乙醇、溴酚藍(lán)、過(guò)硫酸銨、四甲基乙二胺(TEMED),均購(gòu)自北京鼎國(guó)昌盛生物技術(shù)有限責(zé)任公司;甲醇、冰乙酸、標(biāo)準(zhǔn)蛋白質(zhì)Marker,均購(gòu)自北京索萊寶科技有限公司。
1.1.2 主要儀器 低溫高速離心機(jī)(Thermo Fisher Scientific公司,ST16R)、FW100高速萬(wàn)能粉碎機(jī)(天津泰斯特儀器有限公司)、85-2型數(shù)顯磁力攪拌器(江蘇金壇市大地自動(dòng)化儀器廠)、分樣篩(60目,浙江省紹興市上虞華豐五金儀器有限公司)、透析袋(YA1072,北京索萊寶科技有限公司)、層析柱(1.5 cm×15 cm,上海精科實(shí)業(yè)有限公司)、UV2102紫外可見(jiàn)光分光光度計(jì)(上海龍尼柯儀器有限公司)、PHS-3C型酸度計(jì)(上海儀電科學(xué)儀器有限公司)、紅細(xì)胞凝集反應(yīng)板(Costar3590,美國(guó))、DYY-2C型電泳儀(北京六一儀器廠)、“迷你型”凝膠電泳裝置(Boi-Rad中國(guó)公司);微量移液器(200~1 000 mL、50~500 μL、5~50 μL,Thermo Fisher Scientific)微量加樣器(20 μL,上海安亭微量進(jìn)樣器廠)。
1.2 大豆凝集素的分離純化
1.2.1 大豆凝集素粗提取液的制備
1.2.1.1 脫脂 稱(chēng)取生大豆500 g,置于粉碎機(jī)中粉碎30 s后,過(guò)60目篩。按質(zhì)量體積比1 ∶ 10置于一定體積的正己烷內(nèi),利用磁力攪拌器攪拌進(jìn)行10 h脫脂(每隔3 h換1次正己烷溶液),將脫脂完的豆粉放在通風(fēng)櫥中晾干。
1.2.1.2 提取和離心 稱(chēng)取80 g脫脂大豆粉放入2 L燒杯中,加入0.9% NaCl溶液1 L,使其充分地溶解,然后放入 4 ℃ 下浸提蛋白質(zhì),過(guò)夜。溶液分為2層,上層為澄清的黃色液體,含有大豆中的可溶性物質(zhì)。因?yàn)榇蠖鼓貫榭扇苄缘鞍祝蚨嬖谟谏蠈尤芤褐?下層為沉淀層。將上層溶液傾出,下層沉淀在9 000 r/min條件下離心20 min,回收澄清溶液。將所收集到的上清液進(jìn)行過(guò)濾,除去其中的不可溶成分。
1.2.1.3 微濾 將收集到的上清液用濾器進(jìn)行過(guò)濾,含 0.45 μm 的聚砜膜。將過(guò)濾后所得產(chǎn)物用于親和層析柱分析。
1.2.2 大豆凝集素的純化 將N-乙酰基-D-半乳糖 胺-epoxy-sepharose 6B裝入層析柱(1.5 cm×15 cm)[14],膠的結(jié)合能力為6~8 mg/mL膠。將柱子放在4 ℃層析柜中,將柱子用0.9%生理鹽水進(jìn)行平衡,以在280 nm下檢測(cè)到的吸光度等于0作為平衡終點(diǎn)判定的依據(jù)。然后將試驗(yàn)制備的大豆凝集素粗提液進(jìn)行純化。待大豆凝集素粗提液全部進(jìn)入膠體(白色)后,用鹽溶液沖洗未結(jié)合雜蛋白,以在280 nm下檢測(cè)到的吸光度等于0為沖洗終點(diǎn)。最后換用含 0.15 mol/L D-半乳糖的鹽溶液進(jìn)行洗脫。將收集到的 280 nm 條件下的吸光度大于0.1的洗脫峰管進(jìn)行合并,記錄總體積。將所收集的純化大豆凝集素溶液置于透析袋中,在4 ℃下于蒸餾水中透析過(guò)夜,然后用聚乙二醇20 000進(jìn)行濃縮,得到純化的大豆凝集素[15]。利用紫外分光光度計(jì)在280 nm和260 nm條件下測(cè)定所制備大豆凝集素的吸光度,記錄D280 nm和D260 nm值。根據(jù)公式:蛋白質(zhì)濃度(mg/mL)=1.45×D280 nm-0.74×D260 nm計(jì)算所收集到的大豆凝集素?cái)?shù)量[16]。
1.3 大豆凝集素純度的鑒定
采用聚丙烯酰胺凝膠電泳(SDS-PAGE)鑒定經(jīng)N-乙酰-D-半乳糖胺-epoxy-sepharose 6B純化的大豆凝集素的亞基組成及其分子量,并與標(biāo)準(zhǔn)品作比較。SDS-PAGE操作方法參照郭堯君的方法[17]進(jìn)行,具體如下:首先灌注12%分離膠及5%濃縮膠。然后將所純化的大豆凝集素與電流樣品緩沖液按適當(dāng)比例混合后,在100 ℃條件下煮沸3~5 min,使蛋白發(fā)生變性。在每個(gè)樣品孔中加入10~15 μL處理過(guò)的樣品,濃縮膠段采用80 V恒壓,分離膠段采用200 V恒壓進(jìn)行電泳。將凝膠剝下,置于盛有考馬斯亮藍(lán)染色液的平皿中進(jìn)行染色過(guò)夜,然后將凝膠取出,放入盛有冰乙酸的脫色液中,于恒溫水浴振蕩器上進(jìn)行振蕩脫色。
1.4 大豆凝集素生物活性的測(cè)定
采用兔紅細(xì)胞凝集法進(jìn)行大豆凝集素活性鑒定。操作步驟按照Franco-Feaguas等的方法[6]進(jìn)行,并做了部分修正,具體如下:在96孔“V”型血凝板中每孔加入50 μL 5%紅細(xì)胞懸液,接著每孔中分別加入50 μL倍比稀釋的大豆提取液,混合均勻后置于室溫下反應(yīng)2 h,觀察反應(yīng)結(jié)果。判定標(biāo)準(zhǔn)如下:(1)全部凝集(+ + + +):紅細(xì)胞呈一層薄膜片狀,均勻地分布在整個(gè)孔中;(2)大部分凝集(+ + +):小部分未凝集的紅細(xì)胞呈紅色小圓點(diǎn)狀沉淀于孔底,且數(shù)量較少;(3)半凝集(+ +):約有50%的紅細(xì)胞沉淀于孔底,成紅色圓點(diǎn)狀;(4)大部分不凝集(+):絕大多數(shù)未凝集的紅細(xì)胞沉淀于孔底成紅色圓形狀,有可見(jiàn)凝集顆粒;(5)完全不凝集(-):液體與對(duì)照組相似,紅細(xì)胞沉于孔底。本研究以使50%紅細(xì)胞凝集的最小樣品濃度,稱(chēng)為1個(gè)凝集單位(HU)。
2 結(jié)果與分析
2.1 大豆凝集素純化曲線及純化效率
在N-乙酰基-D-半乳糖胺-epoxy-sepharose 6B親和層析柱中加入大豆凝集素粗提液后進(jìn)行親和層析的洗脫曲線,詳見(jiàn)圖1。第1峰為首先利用0.9%生理鹽水洗脫后得到的非特異性吸附的洗脫峰(即雜蛋白洗脫峰),第2峰為利用0.15 mol/L D-半乳糖的鹽溶液進(jìn)行洗脫的特異性吸附的洗脫峰(即大豆凝集素洗脫峰)。
大豆凝集素的純化效率如表1所示。本試驗(yàn)條件下所制得的大豆凝集素的純化效率為135 mg/100 g大豆粉。
2.2 大豆凝集素純度鑒定
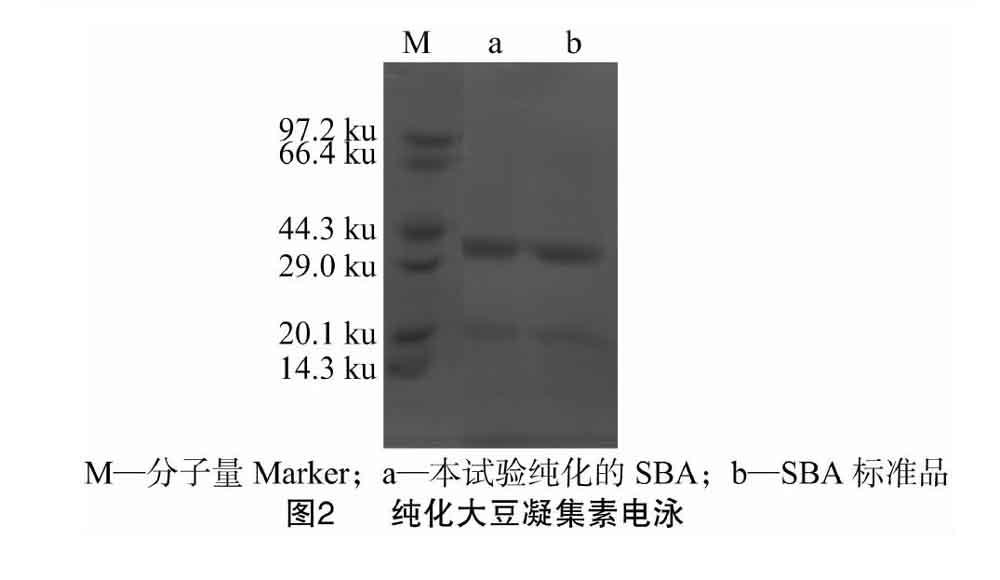
利用聚丙烯酰胺凝膠電泳對(duì)提純的SBA進(jìn)行純度鑒定,并與標(biāo)準(zhǔn)SBA相比,結(jié)果如圖2所示。提純的大豆凝集素各條帶在30 ku左右,與標(biāo)準(zhǔn)SBA基本一致,這與Lotan等的報(bào)道[18]一致,這意味著本試驗(yàn)方法制備的SBA純度較高。
2.3 大豆凝集素凝集活性測(cè)定
大豆凝集素能與紅細(xì)胞發(fā)生結(jié)合產(chǎn)生凝集。利用這一凝集特性進(jìn)行大豆凝集素凝集,是檢測(cè)大豆凝集素的主要方法之一[19]。研究表明,大豆凝集素可特異性地與兔紅細(xì)胞發(fā)生結(jié)合[20]。因此本試驗(yàn)采用自制5%新鮮兔紅細(xì)胞懸液進(jìn)行大豆凝集素的凝集活性測(cè)定。大豆凝集素凝集活性測(cè)定結(jié)果見(jiàn)表2。本試驗(yàn)所制備的大豆凝集素的凝集活性為256,與標(biāo)準(zhǔn)品相一致。
3 討論與結(jié)論
傳統(tǒng)的大豆凝集素的提純方法只是從獲取高純度的大豆凝集素的角度出發(fā)進(jìn)行改進(jìn),但是卻忽略了量的因素,并且大豆凝集素的提純效率較低。因此參照傳統(tǒng)的方法難以獲取足量的、純度較高的大豆凝集素,使大豆凝集素的量產(chǎn)受到限制。本試驗(yàn)采用0.9%生理鹽水溶液溶解脫脂大豆粉,置于 4 ℃ 條件下進(jìn)行過(guò)夜提取,收集浸泡后的上清液。將脫脂大豆粉放入鹽溶液,并放入4 ℃環(huán)境中有2個(gè)目的:(1)利用蛋白質(zhì)的溶解特性,使大豆中可溶性的成分溶于鹽溶液中,大豆凝集素屬于可溶性蛋白,因而溶于鹽溶液中。(2)利用某些蛋白具有冷沉的特性而達(dá)到去雜質(zhì)的目的。大豆中的11S球蛋白具有冷沉的特性,放在4 ℃溶液中過(guò)夜,約有86%的11S球蛋白沉淀出來(lái)。微濾的目的是為了去除粗提液中的顆粒性物質(zhì),避免親和層析時(shí)由于堵塞膠孔而降低粗提液的流速,從而造成純化效率較低。王利民等研究首先采用 0.01 mol/L,pH值7.6 PBS溶液浸提,然后再用硫酸銨逐級(jí)沉淀法來(lái)制備大豆凝集素粗提液[13]。與王利民等的研究[13]相比,本試驗(yàn)減少了大豆凝集素粗提液的制備時(shí)間及費(fèi)用,有利于提高大豆凝集素的提純效率。
大豆凝集素是一種大分子蛋白質(zhì),分子量約為 120 ku,大豆凝集素是由略有不同的4個(gè)亞基組成的四聚體,并有規(guī)則的2個(gè)二聚體組成,因此大豆凝集素可以看作是“二聚體的二聚體”,每個(gè)亞基的分子量約為30 ku[18]。從本試驗(yàn)的結(jié)果可以看出,采用本試驗(yàn)改進(jìn)的大豆凝集素純化方法所制備的大豆凝集素的純度較高,與Sigma的大豆凝集素標(biāo)準(zhǔn)品相近,且大豆凝集素亞基分子量與理論值相符,與標(biāo)準(zhǔn)品的SBA蛋白電泳條帶位置相同。這與Pusztai等的研究結(jié)果[21]相一致。
大豆凝集素的4個(gè)亞基均含有1個(gè)單獨(dú)的糖結(jié)合位點(diǎn),因此每個(gè)大豆凝集素分子都含有4個(gè)N-乙酰基-D-半乳糖胺結(jié)合位點(diǎn)。因此,大豆凝集素粗取液加入親和層析體系后,首先粗提液中的雜蛋白被洗脫下來(lái),而大豆凝集素則與凝膠上的半乳糖胺結(jié)合。D280 nm變?yōu)榱愫螅臑榘肴樘沁M(jìn)行洗脫。大豆凝集素與半乳糖結(jié)合,從而從凝膠上被洗脫下來(lái)。本試驗(yàn)所制備的大豆凝集素的產(chǎn)率為 135 mg/100 g,這與Fasina等的結(jié)果[22]相一致。
綜上,本試驗(yàn)通過(guò)優(yōu)化大豆凝集素粗提液的制備方法,制得了純度較高的大豆凝集素。本試驗(yàn)所制備的大豆凝集素純化效率為135 mg/100 g豆粉,純度與SBA標(biāo)準(zhǔn)品一致,可為大豆凝集素的量產(chǎn)提供參考。
參考文獻(xiàn):
[1]Friedman M,Brandon D L. Nutritional and health benefits of soy proteins[J]. Journal of Agricultural and Food Chemistry,2001,49(3):1069-1086.
[2]Bajpai S,Sharma A,Gupta M N. Removal and recovery of antinutritional factors from soybean flour[J]. Food Chemistry,2005,89(4):497-501.
[3]Fasina Y O,Classen H L,Garlich J D,et al. Investigating the possibility of monitoring lectin levels in commercial soybean meals intended for poultry feeding using steam-heated soybean meal as a model[J]. Poultry Science,2003,82(4):648-656.
[4]張柏林,秦貴信,劉 寧,等. 大豆凝集素結(jié)構(gòu)及其活性測(cè)定方法的研究進(jìn)展[J]. 大豆科學(xué),2009,28(1):160-163.
[5]王利民. 大豆凝集素在不同種屬動(dòng)物體內(nèi)的消化動(dòng)力學(xué)及抗?fàn)I養(yǎng)作用比較研究[D]. 長(zhǎng)春:吉林農(nóng)業(yè)大學(xué),2007.
[6]Franco-Fraguas L,Alicia P,F(xiàn)erreira F,et al. Preparative purification of soybean agglutinin by affinity chromatography and its immobilization for polysaccharide isolation[J]. Journal of Chromatography B,2003,790(1/2):365-372.
[7]Liener E I. Implications of antinutritional components in soybean foods[J]. Critical Reviews in Food Science and Nutrition,1994,34(1):31-67.
[8]Liener E I,Pallansch M J,et al. Purification of a toxic substance from defatted soy bean flour[J]. Journal of Biological Chemistry,1952,197(1):29-36.
[9]Wada S,Pallansch M J,Liener I E,et al. Chemical composition and end groups of the soybean hemagglutinin[J]. Journal of Biological Chemistry,1958,233(2):395-400.
[10]張洪淵,劉克武,楊守忠,等. 大豆凝集素、脲酶和胰蛋白酶抑制劑的分離純化[J]. 中國(guó)油料作物學(xué)報(bào),1991(1):41-45.
[11]Vretblad P. Purification of lectins by biospecific affinity chromatography[J]. BBA-Protein structure,1976,434(1):169-176.
[12]Li Z T,Li D,Qiao S Y,et al. Anti-nutritional effects of a moderate dose of soybean agglutinin in the rat[J]. Archiv Fur Tierernahrung,2003,57(4):267-277.
[13]王利民,秦貴信,劉林娜,等. 三種親和層析體系純化大豆凝集素的比較研究[J]. 大豆科學(xué),2007,26(1):51-54.
[14]李振田. 大豆凝集素的檢測(cè)、純化和對(duì)大鼠抗?fàn)I養(yǎng)機(jī)理的研究[D]. 北京:中國(guó)農(nóng)業(yè)大學(xué),2003.
[15]胡海霞. 大豆凝集素與不同種屬動(dòng)物腸壁結(jié)合規(guī)律的比較研究[D]. 長(zhǎng)春:吉林農(nóng)業(yè)大學(xué),2008.
[16]何昭陽(yáng). 動(dòng)物免疫學(xué)實(shí)驗(yàn)技術(shù)[M]. 長(zhǎng)春:吉林科學(xué)技術(shù)出版社,2002.
[17]郭堯君. 蛋白質(zhì)電泳實(shí)驗(yàn)技術(shù)[M]. 北京:科學(xué)出版社,1999.
[18]Lotan R,Siegelman H W,Lis H,et al. Subunit structure of soybean agglutinin[J]. Journal of Biological Chemistry,1974,249(4):1219-1224.
[19]Jaffe G W. In toxic constituents in plant foodstuffs[M]. New York:Academic Press,1980.
[20]劉林娜. 不同種屬動(dòng)物對(duì)大豆凝集素敏感性的比較研究[D]. 長(zhǎng)春:吉林農(nóng)業(yè)大學(xué),2006.
[21]Pusztai A,Watt W B,Stewart J C,et al. A comprehensive scheme for the isolation of trypsin inhibitors and the agglutinin from soybean seeds[J]. Journal of Agricultural and Food Chemistry,2002,39(5):862-866.
[22]Liener I E. Comment on a semi-pilot-scale procedure for isolating and purifying soybean(Glycine max)lectin[J]. Journal of Agricultural and Food Chemistry,2003,51(16):4532-4538.
- 江蘇農(nóng)業(yè)科學(xué)的其它文章
- Cu2+脅迫對(duì)大豆生長(zhǎng)和抗氧化酶活性的影響
- 解淀粉芽孢桿菌草酸脫羧酶基因的克隆、原核表達(dá)與活力測(cè)定
- 基于精準(zhǔn)養(yǎng)殖提升肉羊生產(chǎn)效益及福利化水平研究進(jìn)展
- 現(xiàn)代農(nóng)業(yè)科研院所人才激勵(lì)與評(píng)價(jià)機(jī)制研究
- 科研項(xiàng)目全流程信息化管理系統(tǒng)的設(shè)計(jì)與實(shí)現(xiàn)
- 我國(guó)桃產(chǎn)業(yè)出口貿(mào)易的現(xiàn)狀分析及應(yīng)對(duì)策略

