成年先天性心臟病致大面積腦梗死一例報道并文獻復習
章林,杜少輝,楊珣,張強,楊嘉敏,駱沁文,李少鋒
大動脈粥樣硬化、小動脈閉塞及心源性栓塞均是腦梗死的常見病因。近年來隨著手術及護理學發展,先天性心臟病手術率及早期存活率升高,而成年先天性心臟病致腦梗死者較少見,其實先天性心臟病對神經系統的損傷是持續性的,其可影響患者生活質量、學業成績及獨立生活能力,因此需提高臨床工作者對該病的重視和認識。本文報道1例成年先天性心臟病致大面積腦梗死患者慢病進行文獻復習,以提高臨床醫生對成年先天性心臟病致腦梗死的認識。
1 病例簡介
患者,女,26歲,因“言語不能伴右側肢體無力2 d”于2018-04-25入住深圳市第二人民醫院,家屬代述患者2 d前睡醒時突發言語不能、右側肢體無力,可扶墻站立,無惡心、嘔吐,無肢體抽搐,遂由家屬送至醫院就診,行顱腦磁共振成像(MRI)檢查結果示左側顳葉、頂葉大面積急性梗死,后轉至病房住院治療。既往有先天性心臟病病史,未系統治療,未婚,無性病及冶游史,否認煙酒嗜好,否認家族遺傳史。入院查體:體溫36.2 ℃,脈搏82次/min,呼吸20次/min,血壓93/50 mm Hg(1 mm Hg=0.133 kPa)。肺部聽診無異常,胸骨左緣可聞及3/6級收縮期吹風樣雜音,腹部查體無特殊。神經系統查體配合欠佳,意識清晰,完全運動性失語,兩側瞳孔等大等圓,直徑3 mm,對光反射靈敏,眼球活動正常,無眼震,右側鼻唇溝變淺,伸舌偏右。右上肢肌力0級,右下肢肌力0~1級,左側肢體活動可,右側肢體肌張力減弱,腱反射可引出,右側巴氏征、查多克征(+),左側肢體病理征(-),頸軟無抵抗,克氏征(-)。兩側鎖骨上區及頸動脈聽診區未聞及血管雜音。雙手可見杵狀指。美國國立衛生研究院卒中量表(NIHSS)評分11分,Barthel指數(BI)評分20分,洼田飲水試驗1級,改良Rankin量表(mRS)4級。急診動脈血氣分析結果示動脈血二氧化碳分壓為21.8 mm Hg,動脈血氧分壓為59.2 mm Hg,實際剩余堿為-8.2 mmol/L,實際碳酸氫根為14.2 mmol/L,標準剩余堿為-9.6 mmol/L,標準碳酸氫根為17.8 mmol/L,二氧化碳總量為12.4 mmol/L。血常規、血生化、自身免疫等未見明顯異常。動態心電圖檢查結果示竇性心律不齊;交界性逸搏、室性逸搏;偶發多源房性期前收縮、室性期前收縮;部分時間ST-T段改變;心率變異性增高。心臟彩超檢查結果示先天性心臟病;室間隔缺損(肌部),缺損處可見雙向血流信號;肺動脈內徑增寬;肺動脈瓣重度狹窄;右心室流出道輕度狹窄。顱腦CT檢查結果示左側顳葉、頂葉大面積梗死,見圖1A、1B。頭頸部CT血管造影檢查結果示左側大腦中動脈狹窄、閉塞。腦電圖未見異常。診斷:(1)腦梗死(左側顳葉及頂葉,心源性栓塞型);(2)先天性心臟病:室間隔缺損(肌部)、肺動脈瓣狹窄(重度);(3)左側大腦中動脈重度狹窄或閉塞;(4)心律失常:交界性逸搏、室性逸搏。給予患者改善血液循環、清除氧自由基、營養神經、抗血小板聚集、抗凝等治療。患者出院時右側肢體肌力稍恢復,言語不清好轉。
2 討論
先天性心臟病是青少年腦梗死的常見原因,其中室間隔缺損并發腦梗死較少見。SHUIAB[1]于1989年首次報道1例室間隔缺損并腦梗死患者,推測其發病原因為栓塞。陳世保等[2]于2018年報道了1例室間隔缺損并發腦梗死患者,其發病原因可能是患者出現艾森門革綜合征后機體處于慢性缺氧狀態,刺激紅細胞生成素增多,導致血紅蛋白及紅細胞比容(HCT)持續升高,進而發展為繼發性紅細胞增多癥。本例患者發生先天性心臟病并發腦梗死的機制可能如下:(1)患者幼年時有運動耐力低下表現,且血氣分析結果顯示低氧血癥,有杵狀指,提示患者腦部持續性缺氧;(2)患者動態心電圖檢查結果示心律失常,可間接影響腦部血供;(3)心臟彩超檢查結果示患者室間隔缺損處雙向血流信號,且由無青紫型轉變為有青紫型,提示艾森門革綜合征。
先天性心臟病患者致腦損傷的原因較復雜,但主要包括胎兒時期腦損傷、腦血流改變、顱內分子生物學指標變化、血栓形成及手術因素。而既往研究表明,手術前檢查發現約50%的先天性心臟病患者在新生兒期即有神經系統發育不良表現[3]。
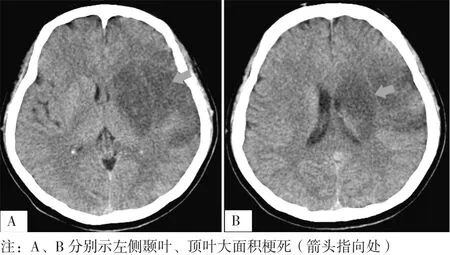
圖1 顱腦CT檢查結果Table 1 Craniocerebral CT examination results
2.1 胎兒時期腦損傷 先天性心臟病患者的腦損傷在胎兒時期已存在,主要是先天性心臟病使胎兒血流動力學改變,腦血流減少,腦氧供降低,進而使腦細胞生長及成熟受限,發生白質病變。先天性心臟病胎兒MRI檢查結果示總腦容量(經孕齡及體質量調整)減少、腦代謝異常、皮質發育延遲[4]。通過評估先天性心臟缺陷患者術前大腦發育情況發現,超過20%的患者有40%~50%的白質損傷[5-6]。
研究表明,先天性心臟病患者大腦成熟度低是圍術期腦損傷及神經發育障礙的重要危險因素[7-8]。一項有關青少年大動脈轉位的研究結果顯示,白質微觀結構的區域變化與計算力、注意力、執行功能、視覺和空間技能以及記憶減退有關[9]。HEINRICHS等[10]發現32%行大動脈轉位術的患者存在中重度白質損傷,且損傷程度越重則患者神經發育障礙越嚴重。
2.2 腦血流改變 腦血流變化在青紫型及非青紫型先天性心臟病患者中有不同機制:青紫型先天性心臟病是由右向左分流,體循環中混有靜脈血液,致動脈血中氧濃度降低,機體長期處于缺氧狀態,導致智力發育障礙、暈厥、頭暈、頭痛等。非青紫型先天性心臟病由左向右分流,肺血多,易致心功能異常及充血性心力衰竭,可形成腦水腫及腦缺血缺氧性改變。另外心臟結構及血流動力學改變可致心律失常,進而影響腦血供[11]。夏禮勤等[12]對66例先天性心臟病患兒進行腦血流圖(REG)檢查結果示,腦血流異常發生率較高(80.3%),其中青紫型先天性心臟病中重度腦血流異常比例更高,REG檢查結果示波幅、流入容積速度降低,且其腦血流下降程度與動脈血氧分壓及血液黏度有關[12]。
2.3 顱內分子生物學指標變化
2.3.1 N乙酰天門氨酸(NAA)降低 MILLER等[13]對先天性心臟病患兒及健康對照者行磁共振波譜檢查結果示,先天性心臟病患兒NAA峰較健康對照者降低,而NAA降低提示神經元未成熟,也反映慢性缺氧對神經元損傷;彌散成像結果示先天性心臟病患兒腦組織水分含量較多,提示神經元及神經膠質細胞發育均不成熟。
2.3.2 乳酸升高、谷氨酸代謝異常 張斯琴等[14]通過分析25例青紫型先天性心臟病患者磁共振質子波譜檢查結果發現,青紫型先天性心臟病患者乳酸升高,提示患者腦能量代謝異常。一項針對新生兒缺氧缺血性腦病的研究顯示,在病變早期即可觀察到乳酸峰,且乳酸峰與癥狀呈正相關,經治療后乳酸峰回落,此外谷氨酸等興奮型氨基酸代謝異常,而這些異常對神經元具有毒性作用[15]。
2.4 血栓形成
2.4.1 血栓形成和繼發性出血 青紫型先天性心臟病患者低氧血癥慢性期HCT逐漸增加,于2周后高于參考范圍,導致血流瘀滯及全身各器官血栓形成,進一步促進腦栓塞,增加肺出血和腦出血發生風險[16]。
2.4.2 艾森門革綜合征 房間隔缺損、室間隔缺損為左向右分流,而當肺動脈高壓發展至器質性肺動脈阻塞性疾病時出現右向左分流,皮膚黏膜由無青紫發展為有青紫時即為艾森門革綜合征[17]。邢西遷等[18]通過分析4例艾森門革綜合征患者發現,均無靜脈血栓形成的危險因素,且D-二聚體陰性,下肢靜脈彩超檢查結果未見血栓形成,但心臟彩超檢查結果示肺動脈壓升高、肺部血管增的強影像學特點均提示肺動脈近端或較大分支有層狀附壁血栓形成,提示艾森門革綜合征致肺動脈栓塞具有隱匿性、漸進性等,易漏診;原因可能是肺動脈高壓導致肺動脈血流減慢,而機體缺氧可刺激骨髓造血細胞生成,使代償性紅細胞生成增多致血液黏度增加,導致肺動脈血栓形成。
2.5 手術導致腦損傷 腦血管疾病是先天性心臟病患者術后較常見且嚴重的并發癥之一。既往研究結果表明,成年人心臟術后腦梗死發生率為2%~6%,兒童心臟術后腦梗死發生率為0.54%[19]。雖然兒童心臟術后腦梗死發生率較低,但腦梗死是兒童死亡的十大原因之一[20]。先天性心臟病術后并發腦梗死可能的機制為創傷造成全身炎性反應,導致血容量改變、血壓波動、繼發高凝狀態及各種性質栓子形成[21]。

