表達人源HPD基因對釀酒酵母孢子壁二酪氨酸層正確組裝的干擾
王曉文,殷政,高曉冬,中西秀樹
(江南大學 生物工程學院,江蘇 無錫,214122)
人和酵母在10億年前有共同的祖先,兩物種間部分代謝及其調控途徑是保守的[1]。在釀酒酵母(Saccharomycescerevisiae)中,人類蛋白質的過表達會擾亂釀酒酵母內在的生理機能,導致其表型發生變化,可被直接檢測,這是以釀酒酵母為模式生物進行科學研究的關鍵所在[2]。在本實驗室之前的研究中,根據二酪氨酸的自熒光,即可在紫外光下發出熒光的特性,建立了一種特殊的篩選方法,通過釀酒酵母的相對熒光強度篩選特異性抑制其產孢過程的人類基因[3-4]。通過篩選,得到了一個具有獨特性質的基因,即4-羥苯丙酮酸二加氧酶(4-Hydroxyphenylpyruvate dioxygenase,HPD),Hpd蛋白是酪氨酸分解代謝途徑中的關鍵酶[4],如圖1所示。Hpd蛋白可以催化酪氨酸的代謝產物4-羥基苯丙酮酸(4-hydroxyphenylpyruvic acid,HPP)轉變為尿黑酸(homogentisate,HGA)[5-6]。尿黑酸即2,5-二羥苯乙酸,通過氧化作用會轉化為黑色的醌類物質[7]。
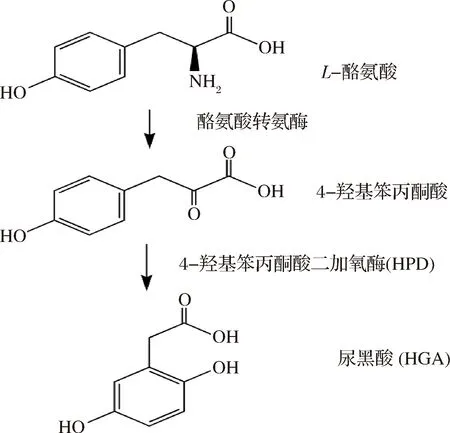
圖1 L-酪氨酸的代謝途徑
Fig.1 The metabolic pathways of L-tyrosine
釀酒酵母(Saccharomycescerevisiae)二倍體在氮源或發酵型碳源匱乏的條件下,會進行減數分裂并進入產孢過程,最終在二倍體細胞中形成4個單倍體孢子[8-9]。相比于營養細胞,釀酒酵母孢子可以有效抵抗外界的惡劣環境,該特性主要是由于孢子壁最外2層結構的保護作用,即殼聚糖層和二酪氨酸層。孢子壁結構由內到外依次合成,在殼聚糖層形成后,二酪氨酸層才開始合成。N,N’-二甲酰基-LL-二酪氨酸(N,N’-bisformyl-LL-dityrosine)為二酪氨酸層的主要組成成分,其形成過程分為2步:L-酪氨酸的N-甲酰基化以及N-甲酰基酪氨酸的二聚化[1]。這2個步驟分別由Dit1和Dit2兩個蛋白調控完成[9]。隨后,N,N’-二甲酰基-LL-二酪氨酸分子通過包括Dtr1在內的多個轉運蛋白被運送到形成過程中的孢子壁上進行組裝[5],但是目前這一組裝過程的具體機制尚不清楚。本研究發現,篩選到的Hpd蛋白過表達時釀酒酵母產孢率不變,但自身熒光強度下降,這一現象表明Hpd蛋白的表達可能會干擾二酪氨酸層的組裝。
因此,本文將已篩選得到的人類HPD基因導入釀酒酵母中,對其在生長狀況、產孢率、熒光強度、乙醚敏感性、CFW染色及培養基顏色變化等方面的表型進行研究,分析人類HPD基因對釀酒酵母產孢過程及酵母孢子壁組裝的影響,以此探究酵母孢子的形成機制。
1 材料與方法
1.1 菌株與生長條件
除了另外標注的技術外,本文所提到的基因操作均是按照參考文獻[10]中描述的方法進行的。本文所用到的酵母菌株見表1, 質粒序列表2。

表1 本研究所用到的釀酒酵母菌株及其基因型

表2 本研究所用到的質粒
在克隆過程中,大腸桿菌在加入氨芐青霉素(100 μL/mL)的LB培養基(1%酵母提取物、2%蛋白胨、2%NaCl)中培養。酵母營養細胞是在YPAD(1%酵母提取物、2%蛋白胨、2%葡萄糖、0.033%腺嘌呤)或去除尿嘧啶的氨基酸混合物的營養缺陷型選擇培養基SD-Ura(0.67%酵母基礎氮源、2%葡萄糖、0.2%去除尿嘧啶的氨基酸缺陷粉末混合物)中培養。酵母產孢細胞是在YPACe培養基(1%酵母提取物、2%蛋白胨、2%乙酸鉀)和KACe培養基(2%乙酸鉀)中培養。
1.2 質粒
本文所用的質粒見表2。質粒的構建方法均是按照參考文獻[3]操作的。
1.3 檢測釀酒酵母產孢率
接種釀酒酵母單菌落到5 mL的SD-Ura液體培養基中,在30 ℃,220 r/min的條件下過夜培養;轉接100 μL菌液到5 mL YPACe液體培養基中,在30 ℃ 220 r/min的條件下培養24 h;收集菌體,用ddH2O洗滌2次之后,轉接到5 mL KACe產孢培養基中,在30 ℃ 220 r/min的條件下培養24 h使其產孢。隨后,在血球計數板上取10 μL菌液點樣,顯微鏡下觀察細胞形態,統計酵母孢子和營養細胞的數量,計算釀酒酵母的產孢率。
1.4 檢測營養細胞生長的情況
挑取釀酒酵母單菌落在SD-Ura固體平板上劃線,于30 ℃培養24 h,觀察營養細胞的生長情況。
1.5 檢測釀酒酵母孢子在紫外光下的熒光強度
挑取釀酒酵母單克隆,在20 μL無菌水中重懸,點在SD-Ura固體培養基上, 30 ℃培養24 h。長出明顯菌落后,將其影印到貼合了濾紙的新的SD-Ura固體培養基上,30 ℃培養16 h。待濾紙上長出明顯釀酒酵母菌落后,用鑷子將其移至KACe固體培養基上,30 ℃培養24 h。隨后,在透明的塑料容器中滴上100 μL 10%的氨水,將含有釀酒酵母孢子的濾紙放入并使其浸潤,在紫外光下用凝膠成像儀進行拍攝,用Image J軟件處理圖片從而測定釀酒酵母孢子的熒光強度。
1.6 釀酒酵母孢子乙醚敏感性的檢測
產孢后,在顯微鏡下檢測產孢率,離心收集釀酒酵母孢子,用ddH2O洗滌2次,加入適量無菌水稀釋,在OD660下檢測吸光度,稀釋后的菌體濃度應控制在每毫升3×104個。在1.5 mL離心管中加入200 μL已調整好濃度的孢子,并加入100 μL ddH2O作為0 min的對照。另在1.5 mL離心管中加入200 μL孢子、100 μL乙醚,30 ℃靜置,在0、20、40 min分別吸取50 μL孢子的混合液置于1.5 mL的離心管中,加入950 μL ddH2O,充分混勻,從中取100 μL的混合液均勻涂在YPAD固體平板上,30 ℃培養24 h。統計長出的菌落數量,計算乙醚處理后的孢子存活率。
1.7 熒光增白劑(calcofluor white,CFW)染色
CFW染色的方法見參考文獻[14]。用NIS-Element AR熒光顯微鏡拍照的曝光時間固定為300 ms,然后用該顯微鏡進行圖片處理并測定其熒光強度。
CFW染色步驟:離心收集細胞,用PBS洗2次后,將細胞重懸于200 μL 1×PBS溶液,再加入20 μL CFW溶液(質量濃度為1 mg/mL),混勻,30 ℃避光靜置30 min,離心去上清,然后用1×PBS溶液洗2次,最后將細胞重懸于200 μL PBS溶液,進行顯微鏡下的觀察與拍攝。
1.8 HPLC分析產孢培養基中的二酪氨酸
將二酪氨酸從含有二酪氨酸的生物大分子中釋放出來的方法詳見參考文獻[15]。HCl處理可以水解復合的二酪氨酸并去除二酪氨酸的甲酰基,使其轉化為更易被檢測到的LL-二酪氨酸,因此將完成產孢后的產孢培養基離心取上清液200 μL至1.5 mL離心管中,加入200 μL 6 mol/L HCl,將混合液在95 ℃下敞口加熱5 h。加入200 μL ddH2O重懸裂解粉末,充分溶解后,15 000 r/min離心10 min,然后通過0.45 μm微過濾器過濾,得到產孢培養基的二酪氨酸裂解液。
采用HPLC對二酪氨酸水解產物進行分析的方法詳見參考文獻[16]。HPLC采用Discovery C18柱(150 mm × 4.6 mm,5 μm),使用Waters分離模塊e2475高效液相色譜系統。該方法所用流動相A為0.1%三氟乙酸,B為100%乙腈,流速為1 mL/min,注射體積為10 μL,檢測的激發波為285 nm,發射波為425 nm。所用梯度程序如表3所示。
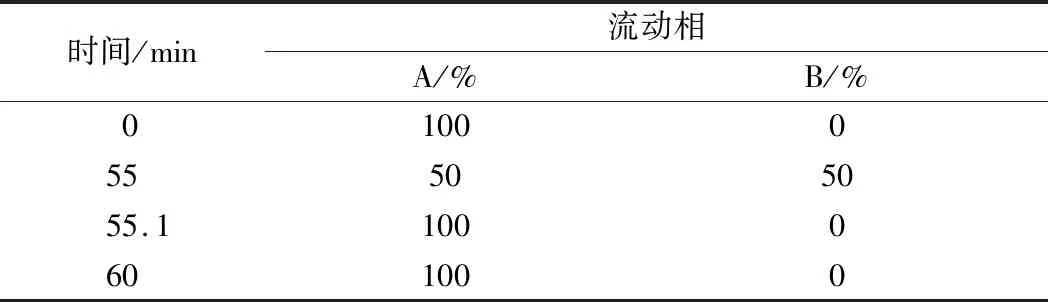
表3 HPLC的梯度程序
1.9 體外添加尿黑酸對孢子形成過程中表面氧化性檢測
離心收集細胞,用無菌水洗滌2次,在OD660下檢測吸光度,確保最終接入2 mL培養基的細胞濃度為每毫升3×107個。每個樣品中加入50 μL的尿黑酸母液(200 mmol/L),30 ℃,220 r/min培養12 h,離心收集培養基,通過測量OD480,分析氧化性強弱。
1.10 統計學分析
至少3次獨立試驗,結果用平均值±標準偏差(SD)表示。
2 結果與分析
2.1 HPD基因的表達對釀酒酵母營養生長和產孢率沒有明顯的抑制作用
為了檢測HPD基因表達對釀酒酵母營養生長的影響,將質粒pRS426-TEFpr-HPD轉化入釀酒酵母AN120中,以表達空質粒pRS426-TEFpr的釀酒酵母AN120作為對照,挑取單菌落在SD-Ura固體平板上劃線培養,24 h后觀察菌株的生長情況,如圖2-a所示。過表達HPD基因的釀酒酵母可以正常生長,與對照的生長情況基本一致,該結果說明HPD基因的表達對釀酒酵母營養細胞的生長沒有明顯的抑制作用。

a-在SD-Ura平板上培養24 h后的生長情況;b-產孢后的孢子形態;c-產孢率和完成減數分裂的百分比。其中,對照-過表達pRS426-TEFpr質粒的野生型(AN120);HPD-過表達pRS426-TEFpr-HPD質粒的野生型(AN120)
圖2 表達HPD基因對釀酒酵母細胞生長和產孢率的影響
Fig.2 Influence on growth and sporulation rate after HPD genes expression in vegetative cells
為了檢測HPD基因對釀酒酵母的產孢率的影響,將表達pRS426-TEFpr-HPD質粒的釀酒酵母接入液體培養基中進行產孢,以表達空質粒pRS426-TEFpr的釀酒酵母AN120作為對照。產孢后取部分菌液,觀察孢子形態并且統計產孢率,結果如圖2-b和圖2-c所示,與野生型對照相比,過表達HPD基因的釀酒酵母的孢子形態以及產孢率均無明顯差異,說明HPD基因的表達對釀酒酵母的產孢率沒有明顯的抑制作用。
2.2 HPD基因的表達影響二酪氨酸層的形成
前期篩選結果顯示,過表達HPD基因的釀酒酵母與野生型相比,其孢子的熒光強度明顯下降。為了驗證這一結果,將過表達HPD基因的釀酒酵母孢子與過表達空質粒的野生型孢子在紫外光下的熒光強度進行對比,結果如圖3-a顯示,與野生型孢子相比,表達HPD基因的釀酒酵母孢子自身的熒光強度明顯下降。而之前的研究結果顯示,過表達HPD基因的釀酒酵母產孢率與野生型孢子的產孢率基本一致,說明該菌株減數分裂過程能夠順利完成,但其孢子壁上二酪氨酸層在形成過程中出現缺陷,從而導致該菌株產生的孢子自熒光強度下降。釀酒酵母孢子由于二酪氨酸層的保護作用能夠表現出對乙醚以及CFW的抗性。

a-在紫外下的孢子熒光強度;b-乙醚敏感性的檢測;c-CFW染色后在熒光顯微鏡下的染色。其中,對照-過表達pRS426-TEFpr質粒的野生型(AN120);HPD-過表達pRS426-TEFpr-HPD質粒的野生型(AN120)
圖3 過表達HPD基因孢子的熒光強度、乙醚敏感性和CFW染色熒光檢測
Fig.3 The fluorescence intensity /ether sensitive test and CFW staining of HPD expressed spores
為了確定HPD基因的表達是否會造成孢子壁上二酪氨酸層的缺陷,本研究用已知的具有二酪氨酸層缺陷釀酒酵母菌株dit1Δ突變株和osw2Δ突變株[17],作為陽性對照,用過表達空質粒的野生型孢子作為陰性對照,對過表達HPD基因的釀酒酵母孢子進行乙醚敏感性檢測,結果如圖3-b所示。與野生型釀酒酵母孢子相比,過表達HPD基因的孢子的乙醚敏感性顯著上升,其敏感度介于dit1Δ突變株和osw2Δ突變株二者之間,表現出明顯的二酪氨酸層缺陷。
為了進一步驗證過表達HPD基因孢子壁中的二酪氨酸層組裝是否正確,對過表達HPD基因的孢子進行了CFW染色試驗。CFW染料可以與幾丁質或殼聚糖結合,在熒光顯微鏡下可觀察到幾丁質或殼聚糖被染色,而孢子壁上完整的二酪氨酸層可以保護里層的殼聚糖被CFW染色[18]。釀酒酵母菌株dit1Δ突變株是已知的具有二酪氨酸層缺陷的酵母菌株,用其作為陽性對照,用過表達空質粒的野生型孢子作為陰性對照,結果如圖3-c顯示,過表達HPD基因的孢子壁CFW熒光明顯比野生型孢子壁的CFW熒光更強,但比dit1Δ突變株的CFW熒光弱,表明其二酪氨酸層的確發生缺失。結合之前的試驗結果,發現在釀酒酵母孢子中HPD基因的表達會造成二酪氨酸層在形成過程中發生缺陷,而并非完全缺失,因此,HPD基因的確會影響釀酒酵母孢子壁中二酪氨酸層的正確組裝。
2.3 HPD基因的表達誘發孢子壁的二酪氨酸分泌到培養基中
為了研究過表達HPD基因的釀酒酵母孢子二酪氨酸層缺失的原理,本文檢測了培養后的產孢培養基熒光強度。取過表達HPD基因的釀酒酵母孢子與過表達空質粒的野生型孢子的產孢培養基各500 μL,點在干凈的濾紙上,在紫外光下檢測濾紙的熒光強度,并使用Image J軟件對二者的熒光圖片進行定量分析,結果如圖4-a和4-b所示。與野生型產孢培養基相比,過表達HPD基因的產孢培養基熒光強度明顯上升。結合之前的研究結果,過表達HPD基因的釀酒酵母孢子二酪氨酸層缺失的機制可能是HPD基因的表達使孢子壁上二酪氨酸層的組裝過程中發生缺陷,導致了參與二酪氨酸層組裝的大量二酪氨酸復合物無法成功組裝到二酪氨酸層上,從而泄漏到培養基中,使得其產孢培養基的熒光強度相對于野生型有所上升。該結果表明HPD基因的過表達可能影響二酪氨酸層的正確組裝。
為了驗證這一猜想,對過表達HPD基因的孢子培養基經過HCl處理之后的樣品進行了HPLC的熒光檢測,以合成的LL-二酪氨酸作為陽性對照,無二酪氨酸形成的dit1Δ孢子培養基的鹽酸裂解液為陰性對照,結果如圖4-c所示。經過HCl的處理,過表達HPD基因的釀酒酵母與野生型釀酒酵母的產孢培養基中都檢測到了LL-二酪氨酸的存在,并且過表達HPD基因的產孢培養基中LL-二酪氨酸的信號峰>野生型孢子,如圖4-c箭頭所示。結果表明,經過6 mol/L HCl處理后,產孢培養基中出現了游離的LL-二酪氨酸。但是沒有能檢測到DL-二酪氨酸,由于LL-二酪氨酸是在組裝到孢子壁上后部分轉化為DL-二酪氨酸,說明這些二酪氨酸復合物并沒有成功組裝到二酪氨酸層中,而是直接泄漏到培養基中,該數據進一步證明了過表達HPD基因會導致LL-二酪氨酸泄漏至培養基中。
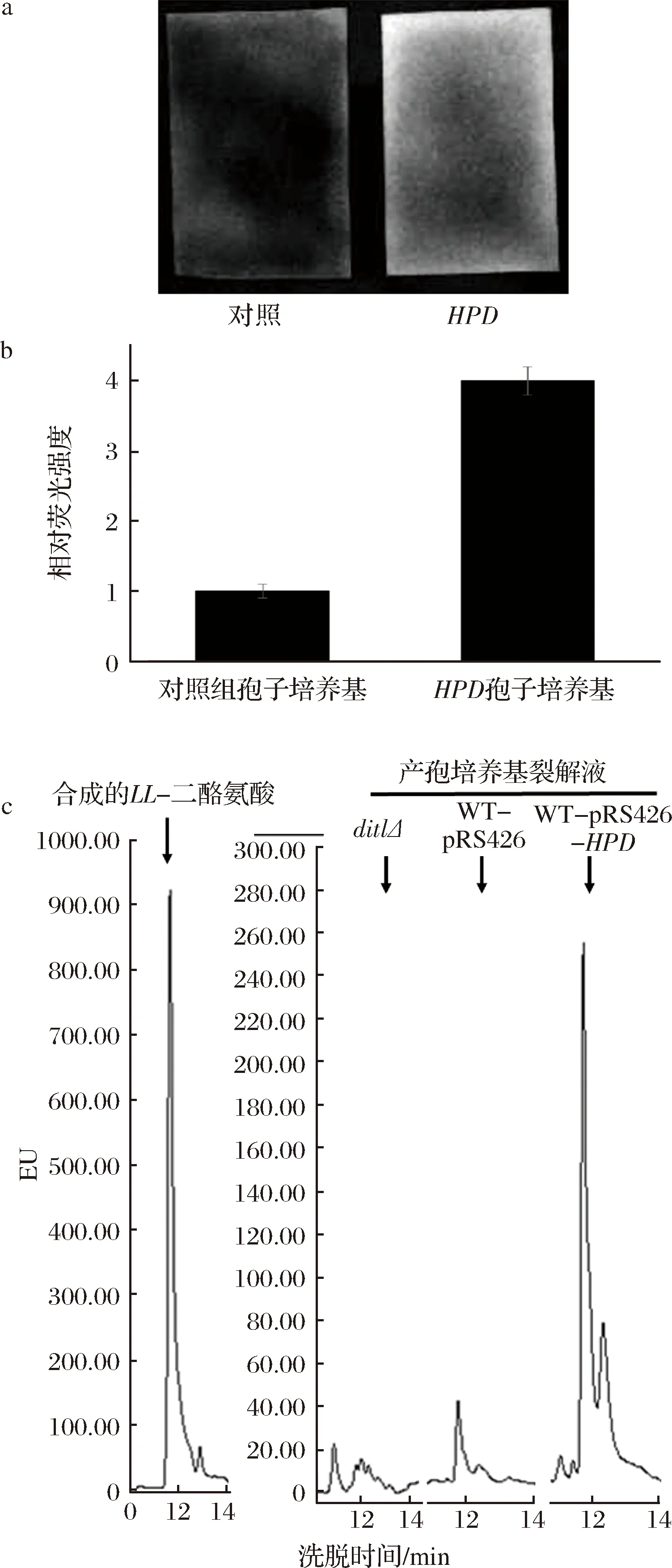
對照-過表達pRS426-TEFpr質粒的野生型(AN120);HPD-過表達pRS426-TEFpr-HPD質粒的野生型(AN120)
圖4 HPD基因的表達對釀酒酵母產孢培養基熒光強度的影響
Fig.4 The effect of HPD expressed yeast on sporulating medium’s fluorescence intensity
2.4 HPD基因的表達檢測出產孢過程中的氧化活性
使用過表達HPD基因的釀酒酵母進行液體產孢試驗時發現,與野生型相比,在經過KACe產孢培養基培養之后,過表達HPD基因的釀酒酵母的KACe培養基的顏色轉變明顯,由無色透明轉變為淺褐色,而野生型的產孢培養基則始終為無色透明液體,如圖5中4~5所示。此外,在SD-Ura液體培養基中將過表達HPD基因的釀酒酵母和過表達空質粒的野生型釀酒酵母培養與產孢過程相同的時間,同時,將HPD基因轉入無法產孢的單倍體酵母AN117-4B中,并在相同條件下使用KACe培養基培養相同時間,結果如圖5中1~3所示。在營養生長時,無論HPD基因是否表達,釀酒酵母培養基顏色都不會發生變化,如圖5中1~2,并且如果不是在產孢過程中,其培養基的顏色也不會出現變化,如圖5中3所示。

圖5 人類基因HPD的表達對釀酒酵母培養基顏色變化的影響
Fig.5 The effect of HPD expression on yeast mediums’ color change
該研究結果表明,這種培養基的顏色變化只出現在過表達HPD基因釀酒酵母的產孢過程中,出現這一顏色變化的原因可能是產孢過程中發生了特異性的氧化過程,可以使釀酒酵母中Hpd蛋白的催化產物尿黑酸氧化變色,從而使表達HPD基因的產孢培養基變色。
為了驗證孢子形成過程中其表面是否具有氧化性,利用尿黑酸被氧化后顏色會發生變化的特性,分別將單倍體營養細胞、二倍體營養細胞接入SD液體培養基中,將在YPACe中培養24 h即將進入產孢過程的營養細胞、已經完成產孢過程的釀酒酵母孢子接入產孢培養基中,使用不含細胞的SD液體培養基和產孢培養基作為對照,加入50 μL的尿黑酸母液培養12 h后,離心收集培養基,測量OD480值,分析氧化性強弱,結果如圖6所示。結果顯示,產孢過程中的釀酒酵母具有最強的氧化能力,其次是已經完成產孢過程的釀酒酵母孢子,無論是產孢過程中還是產孢結束后其氧化能力都遠高于營養細胞。
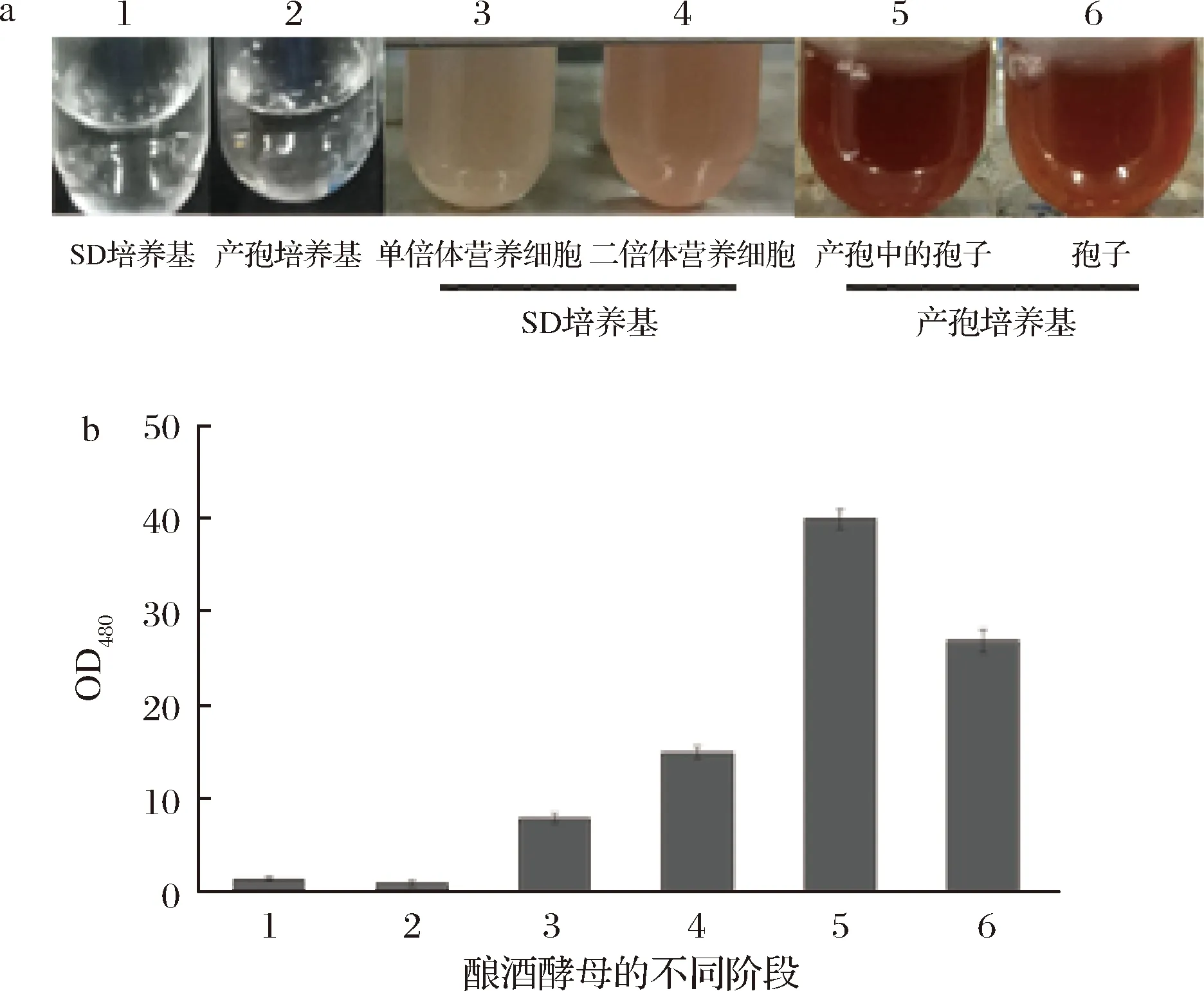
圖6 釀酒酵母不同階段氧化性分析
Fig.6 Analysis oxidation ability of yeast at different stages
3 結論
在釀酒酵母孢子內,L-酪氨酸可以經過Dit1和Dit2蛋白的催化轉變為N,N-二甲酰基-LL-二酪氨酸,并由Dtr1等運輸蛋白將其轉運到孢子壁表面進行二酪氨酸層的組裝[20],其過程如圖7所示,但是二酪氨酸如何組裝到殼聚糖層表面并且其單體之間如何連接形成完整的二酪氨酸聚合物的機制尚不清楚。
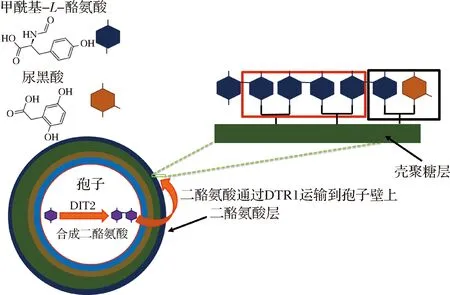
圖7 二酪氨酸層的形成過程以及尿黑酸對其影響
Fig.7 Schematic diagram of dityrosine layer assembly process and effection of homogentisate
相較于營養細胞,釀酒酵母孢子的氧化性明顯上升并且該氧化性極可能與二酪氨酸層的形成過程有關。研究結果顯示,在孢子形成過程中,氧化能力提高,N,N-二甲酰基-LL-二酪氨酸的羥基被氧化,使二酪氨酸之間形成交聯鍵從而相互連接,形成的二酪氨酸聚合物也以交聯鍵的形式與殼聚糖層連接,完成孢子壁的完整組裝,如圖7紅色方框所示。Hpd蛋白的催化產物尿黑酸的結構與酪氨酸相似,在尿黑酸氧化變色后可能參與到二酪氨酸的聚合過程,通過交聯鍵與二酪氨酸連接,如圖7黑色方框所示,造成二酪氨酸層無法進行準確組裝,最終導致孢子壁上出現缺陷。
本文研究結果表明,表達HPD基因的釀酒酵母孢子其自身熒光強度減弱,對乙醚敏感性和CFW染色的熒光強度均明顯上升,并且產孢培養基中檢測到二酪氨酸含量提高。其原因可能是Hpd蛋白的催化產物尿黑酸與二酪氨酸的結構相似,使其參與到二酪氨酸層的組裝過程,導致二酪氨酸層無法正確組裝,并且參與組裝的N,N-二甲酰基-LL-二酪氨酸泄漏至產孢培養基。此外,研究發現產孢過程中孢子表面氧化性提高,可能與N,N-二甲酰基-LL-二酪氨酸與殼聚糖層的連接以及N,N-二甲酰基-LL-二酪氨酸之間交聯結合有關,這一發現揭示了二酪氨酸層的形成機制,為后續二酪氨酸層的研究提供了新的思路。

