基于細胞碳-氮-氧需求的補料批發酵策略促進桿菌肽合成
楊華,宋昭,戴航,陳雄,李欣,陳守文,蔡冬波,李俊輝,王志*
1(發酵工程教育部重點實驗室,湖北省工業發酵協同創新中心,湖北省工業微生物重點實驗室,湖北工業大學,湖北 武漢,430068) 2(省部共建生物催化與酶工程國家重點實驗室(湖北大學),湖北 武漢,430062) 3(綠康生化股份有限公司,福建 浦城,353400)
地衣芽胞桿菌是革蘭氏陽性的產芽胞兼性厭氧微生物,能分泌淀粉酶、蛋白酶等水解酶[1-3],以及肽類抗生素,其中包括桿菌肽。通過非核糖體合成酶系合成的十二環肽分子[4]-桿菌肽具有廣譜抗菌、藥物殘留量少、無抗藥性等優良特性,是目前國際社會允許使用的為數不多的綠色飼料添加劑之一[5]。
地衣芽孢桿菌發酵生產桿菌肽的過程中,細胞優先使用速效碳、氮源已獲得最大的生長速率[6],并伴隨著培養環境、營養成分改變做出快速響應,如呼吸代謝抑制[7]、溢流代謝[8]等碳分解代謝阻遏的具體表現形式[9-10]。通過提高溶氧(dissolved oxygen, DO)促進氨基酸代謝[11]、中期流加H2O2降低溢流代謝程度[12],以及提高乙偶姻還原酶活性,降低胞內NADH/NAD+比率[13]等方法,均可以提高桿菌肽合成效率。而在桿菌肽補料發酵方面,劉道奇等發現葡萄糖補料能促進細胞溢流代謝,但桿菌肽的合成被抑制[14]。另外,桿菌肽發酵過程中培養基黏度大,易起泡,細胞數可高達百億CFU/mL等因素,均使氧的供應及利用效率逐漸降低[11],使得發酵前期DO跌至零[12]、中期菌體自溶[13]。就增加發酵液DO而言,工業上常增加通風量和提高轉速,但會增加能耗,也不利于泡沫的控制[15],而適量升高罐壓可以有效避免上述不利因素,如陳偉波等[16]將罐壓由0.02 MPa升至0.06 MPa,L-精氨酸產量提高了34%。另外,桿菌肽合成也與其前體氨基酸的供應效率呈正相關,如ORN[21]、Asp、Glu、Asn、His、Ile、Lys等[11]。因此,桿菌肽合成涉及到了碳-氮-氧等綜合因素,而相關的綜合研究還未見報道。
以工業地衣芽孢桿菌LC為發酵菌株,本文探索了pH耦合、間歇補料-罐壓控制和間歇-溶氧耦合流加等方式對細胞生長、代謝和桿菌肽合成的影響,建立了基于細胞需求的綜合補料策略,有效提高了桿菌肽發酵效率,為桿菌肽工業化生產的補料工藝優化提供了重要參考。
1 材料與方法
1.1 菌株
地衣芽孢桿菌(BacilluslicheniformisLC,LC菌株),湖北大學綠康生物工程研究所提供。
1.2 培養基
茄子瓶斜面培養基(g/L):酵母浸膏20, NaCl 5,瓊脂20,調pH 7.5。
種子培養基(g/L):豆粕90,玉米淀粉40,玉米漿2.5,輕質CaCO34,蛋白胨 5,(NH4)2SO41。
發酵培養基(g/L):豆粕79,玉米淀粉37.5,玉米漿7.5,輕質CaCO34.5,蛋白胨 15,(NH4)2SO40.75,MgSO4·7H2O 1.1。
1.3 培養方法
1.3.1 種子活化
無菌竹簽轉接-80 ℃保藏甘油管菌液至茄子瓶斜面,在恒溫培養箱中37 ℃培養24 h。
1.3.2 種子培養
茄子瓶斜面加50 mL無菌水制備菌懸液,取4 mL菌懸液接種于搖瓶中(裝液量50 mL)。37 ℃、250 r/min培養24 h,合瓶得到種子液。
1.3.3 50 L發酵罐培養
種子液接種后發酵液體積27 L,接種量5%,在通風量1.6 m3/h、溫度37 ℃、轉速350 r/min條件下發酵培養。
1.3.4 50 L罐發酵策略控制
發酵1:按發酵培養基配方進行發酵培養,罐壓0.03 MPa。
發酵2:pH耦合補料策略,基于發酵1實施。于18~20 h補氮源1.5 L(含豆粕250 g、玉米漿125 g),22~28 h采用pH耦合補糖。pH值設定方式為:22~24 h為7.5,22~28 h每2 h的pH設定值上升0.1,28 h后pH自然。發酵過程中共補入質量分數為75%的葡萄糖溶液400 mL,罐壓0.03 MPa。
發酵3:18~20 h補氮源3.0 L(含豆粕500 g、玉米漿250 g),其他同發酵2,補入葡萄糖340 g。
發酵4:間歇補料策略,從18 h開始,以200 mL/3 h的速率補入1 L質量分數為75%的葡萄糖溶液(750 g),第30小時補完。于18~20 h補氮源1.5 L(含豆粕250 g、玉米漿125 g),罐壓0.03 MPa。
發酵5:間歇補料-罐壓控制策略,基于發酵4,并且24 h至發酵結束罐壓維持在0.05 MPa。
發酵6:間歇-溶氧耦合補料策略。基于發酵5,18~21 h間歇補料,24 h開始將補料方式改為DO耦合(溶氧>35%時,耦合補入質量分數為75%的葡萄糖溶液),24 h至發酵結束罐壓維持在0.05 MPa。共補入葡萄糖500 g。
發酵7:間歇-溶氧耦合-二次氮源補料策略,基于發酵6。另外,在24~25 h第2次補入氮源1.5 L(含豆粕250 g、玉米漿125 g),發酵過程中共補入葡萄糖436 g。
1.4 分析方法
1.4.1 葡萄糖的測定
DNS法[12]。
1.4.2 桿菌肽效價測定
采用Ultimate 3000高效液相色譜進行桿菌肽效價測定[14],桿菌肽標準品(效價為65.8 U/mg)。
1.4.3 生物量的測定
采用稀釋平板涂布法獲得CFU/mL數據。
1.4.4 數據處理
所有試驗數據為至少3個平行試驗的平均值,用平均值±標準差(SD)表示,采用Origin 9.0進行數據分析。
2 結果與分析
2.1 發酵策略1對LC菌株生長和桿菌肽合成的影響
發酵1中桿菌肽效價、生物量、pH值和還原糖的變化如圖1所示。
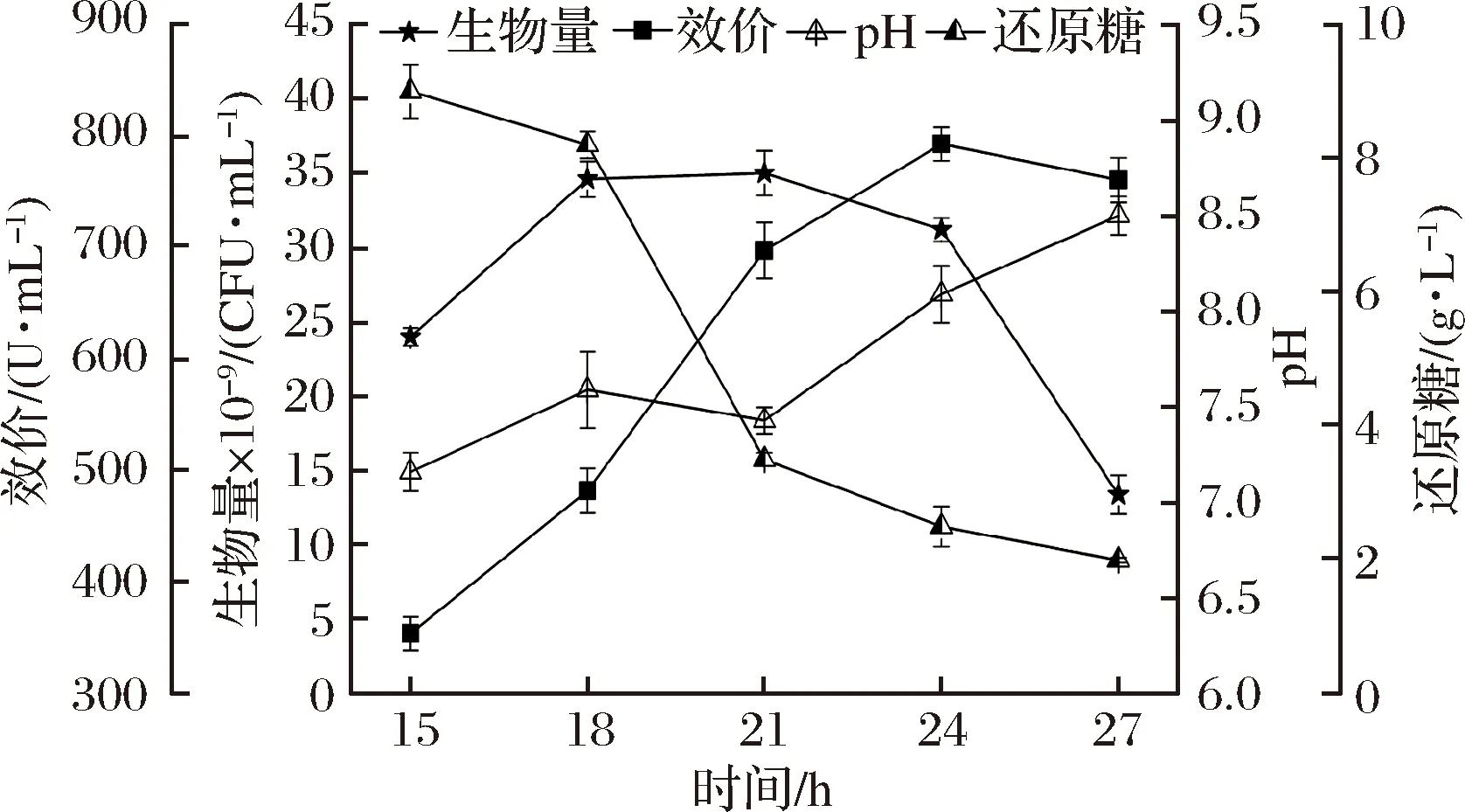
圖1 發酵1對細胞生長和桿菌肽合成的影響
Fig.1 Influences of fermentation 1 on cell growth and bacitracin synthesis
桿菌肽效價在24 h達到峰值793 U/mL,平均桿菌肽合成速率為33 U/(mL·h)。菌體快速生長至18 h,之后趨于穩定,并在21 h達到峰值35×109CFU/mL。21~24 h,還原糖基本耗完,菌體于24 h自溶。因此,應在21 h之前開始補料,以維持細胞代謝和桿菌肽的合成。
2.2 發酵策略2(pH耦合補料)對LC菌株生長和桿菌肽合成的影響
在發酵策略1中,21 h后還原糖基本耗完(圖1),碳源不足使氨基酸脫氨基作用加強,導致pH上升過快,菌體自溶,影響桿菌肽合成[17]。因此采用階梯控制pH的方式來耦合流加葡萄糖,延緩pH上升速度的同時補充碳源。另外,有機氮源對于細菌的生長和代謝也是必不可少的,并且富含桿菌肽合成的前體氨基酸。WANG等[18]研究了豆粕、菜籽餅、芝麻餅粉、花生餅粉等氮源對桿菌肽合成的影響,發現豆粕中氨基酸種類豐富,是桿菌肽發酵過程中的最佳單一氮源。但是豆粕在發酵過程中分解較為緩慢,所以考慮與發酵培養基中已有的速效氮源-玉米漿混合使用。在18~20 h補入玉米漿和豆粕,形成發酵策略2。發酵過程中桿菌肽效價、生物量、pH、還原糖變化如圖2所示。
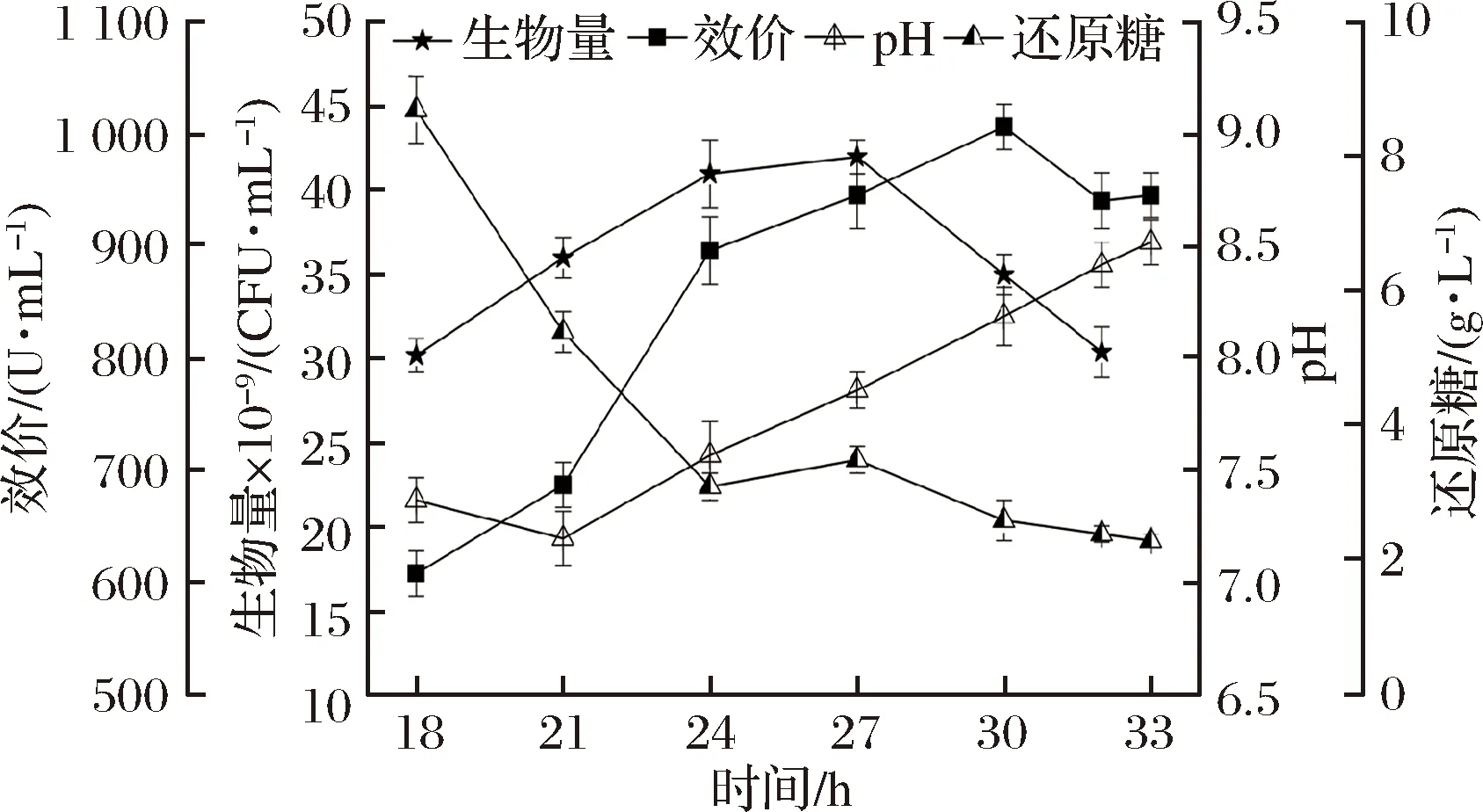
圖2 發酵2對細胞生長和桿菌肽合成的影響
Fig.2 Influences of fermentation 2 on cell growth and bacitracin synthesis
桿菌肽效價持續合成至30 h達到峰值(1 006 U/mL),平均合成速率為33.5 U/(mL·h)。菌體生物量在27 h達到峰值(42×109CFU/mL)后發生了自溶。糖質量濃度在18~24 h快速下降(8.7~3.1 g/L),但由于18~22 h的pH值<設定值,期間未補入葡萄糖。pH耦合補糖期間(22~28 h)的葡萄糖質量濃度維持在3 g/L左右,效價最高點(30 h)還原糖質量濃度為2.6 g/L。與發酵1相比,保持桿菌肽平均合成速率不變,合成時間延長了6 h,效價提高了26.9%。
2.3 發酵策略3對LC菌株生長和桿菌肽合成的影響
作為十二環肽分子,發酵過程中氮源的充分供給是桿菌肽有效合成的基礎,由于發酵2在18 h補充氮源后效價得到明顯提升,于是在發酵2的基礎上,繼續加大氮源的補入量,形成了補料策略3。發酵過程中桿菌肽效價、生物量、pH、還原糖的變化如圖3所示。
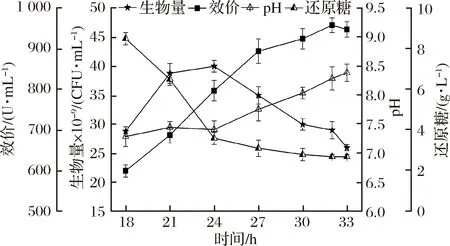
圖3 發酵3對細胞生長和桿菌肽合成的影響
Fig.3 Influences of fermentation 3 on cell growth and bacitracin synthesis
桿菌肽效價持續合成至32 h達到峰值958 U/mL,比發酵2減少了4.8%。菌體生物量24 h達到峰值40×109CFU/mL,與發酵2峰值生物量相當。葡萄糖質量濃度在18~24 h快速下降(8.5~3.6 g/L),之后一直維持低位。通過增加氮源補入量,并沒有進一步提高桿菌肽效價,可能是因為加大氮源的補入,增加了菌體分解和轉運大分子蛋白質的負擔,加速了能量的消耗[19,22]。另外,氮源補入量增加而碳源的補加量并未相應調整,導致碳氮源比例失衡,也影響了氮源的利用效率[20],此時桿菌肽轉運蛋白bcrABC也可能被抑制[23-24]。最終桿菌肽效價只有發酵2的95%。
2.4 發酵策略4(間歇補料)對LC菌株生長和桿菌肽合成的影響
發酵3效價低于發酵2,說明一味提高氮源濃度會導致碳氮比失衡,從而影響桿菌肽的合成[25-26]。而采用pH耦合流加葡萄糖的方式,無法在pH較低時補加葡萄糖。于是以發酵2為基礎,基于18~24 h葡萄糖質量濃度降低5.6 g/L,以及發酵3在18 h后葡萄糖供給不足的現象,采用間歇補料的方式,在18~30 h每3 h補入5.6 g/L的葡萄糖(200 mL的75%葡萄糖溶液/3 h),形成發酵策略4(間歇式補料),見圖4。
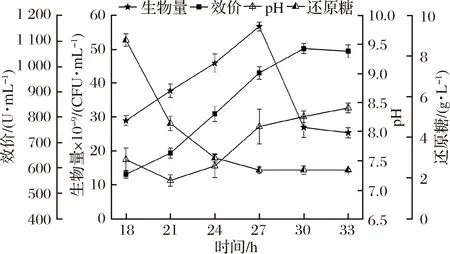
圖4 發酵4對細胞生長和桿菌肽合成的影響
Fig.4 Influences of fermentation 4 on cell growth and bacitracin synthesis
如圖4所示,菌體生物量持續合成至27 h并達到峰值56.8×109CFU/mL,比發酵2提高了35.2%,和發酵2相比,以200 mL/3 h補入葡萄糖的方式更能促進菌體的生長,但生物量過高后,菌體維持代謝所需要的葡萄糖、氮源以及溶氧等無法得到保障,營養和能量供應受限,開始大量自溶[12]。桿菌肽效價在30 h達到峰值(1 070 U/mL),比發酵2和發酵3分別提高了6.4%和11.7%,桿菌肽平均合成速率為35.7 U/(mL·h),略高于發酵2。與發酵2相比,雖然發酵過程中多補入了450 g葡萄糖(其中18~21 h補入300 g),但葡萄糖并沒有在胞外積累。18~24 h葡萄糖質量濃度從8.8 g/L降到3 g/L,之后維持低位。
2.5 發酵策略5(間歇補料-罐壓控制)對LC菌株生長和桿菌肽合成的影響
根據圖1~4試驗結果,實驗條件下桿菌肽發酵峰值細胞數可達百億級CFU/mL,對溶氧的需求極大。而由圖5可知,18 h補料后溶氧降為0,因此推測DO不足使得氧化磷酸化供能效率低,可能是桿菌肽效價無法繼續有效合成的原因。于是基于發酵4,在24 h將罐壓從0.03 MPa提高到0.05 MPa,研究其對24 h前后生長和桿菌肽合成的影響(圖5)。
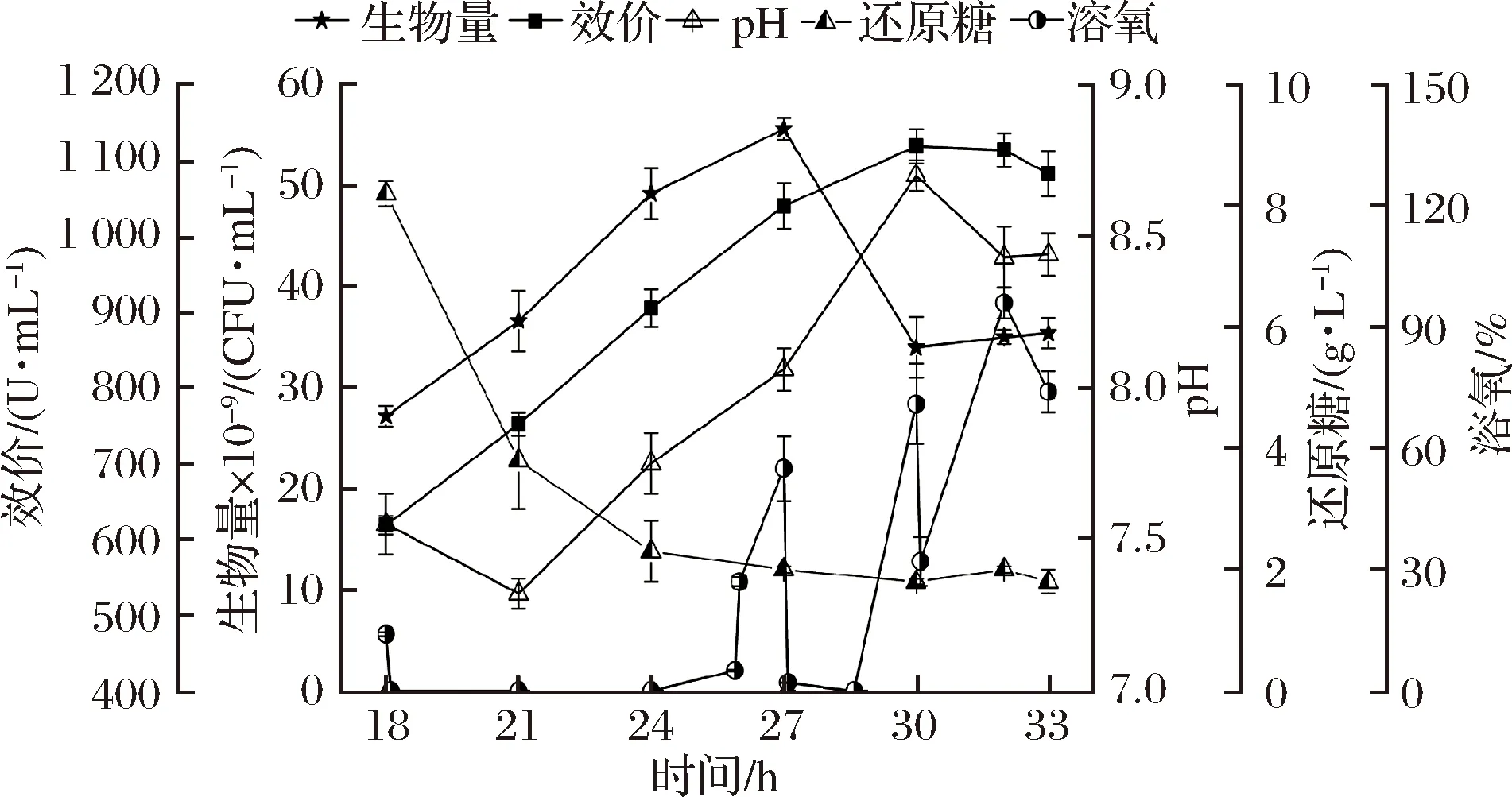
圖5 發酵5對細胞生長和桿菌肽合成的影響
Fig.5 Influences of fermentation 5 on cell growth and bacitracin synthesis
如圖5所示,24 h罐壓提高到0.05 MPa,桿菌肽效價持續合成至30 h達到峰值(1 118 U/mL),比發酵4提高了4.5%,說明提高溶氧對桿菌肽合成有積極的影響。但提高溶氧對生物量的影響不明顯,菌體生物量在27 h達到峰值(55.6×109CFU/mL)后的變化趨勢和峰值濃度都和發酵4基本一致,說明細胞數在峰值條件下,能量供應及碳源不足可能與菌體自溶有關。
18~24 h葡萄質量糖濃度從8.2 g/L降到2.3 g/L,變化趨勢與發酵4一致。另外,18 h補入氮源和葡萄糖后,DO即從14%降為0并一直維持至26 h左右,并沒有因24 h升罐壓而立即升高。期間大量碳源和氮源被消耗,菌體代謝活躍。隨著細胞生長和碳氮源的消耗,碳源不足可能引起了細胞氧化磷酸化的耗氧降低,使DO于26 h開始回升,并于27 h達到55%。此時桿菌肽效價(1 040 U/mL)比發酵4(975 U/mL)提高了7%。隨著27 h間歇補料(200 mL的質量分數為75%葡萄糖),DO再次被大量消耗而跌為0,說明26 h時碳源供應確實處于不足狀態,使氧化磷酸化對溶氧的消耗減少。
30 h間歇補料后,由于此時細胞數只有27 h的61%,對碳源的需求減少。仍按200 mL/3 h的葡萄糖補入量對于此時(30 h)的細胞而言,可能已經過量,CcpA被激活[10],氧化磷酸化作用被抑制[9],菌體對氧的利用速率反而減小,因而DO沒有像27 h那樣出現跌0的情況;
另外,溢流代謝被激活,大量的小分子有機酸如乙酸被合成[8],引起pH在發酵后期由8.7下降至8.4,補入的葡萄糖通過溢流代謝僅僅維持了細胞活性,但并沒有促進桿菌肽效價的合成。
2.6 發酵策略6(間歇-DO耦合補料)對LC菌株生長和桿菌肽合成的影響
發酵4和5中菌體生物量在27 h分別達到了56.8×109CFU/mL和55.6×109CFU/mL,比發酵1(未補料)提高了60%左右,但高菌體量也激化了能量供應的矛盾。至30 h時,細胞又自溶了40%左右,這也造成了碳氮源的浪費。而且,這種間歇補料的方式在25~26 h溶氧開始回升時并不能及時補入葡萄糖;而在30 h菌體自溶后對碳源需求量減小時,又補入了過量的碳源,所以在24 h后應采用溶氧耦合的方式根據細胞對碳源的需求補入葡萄糖,形成發酵策略6(圖6)。
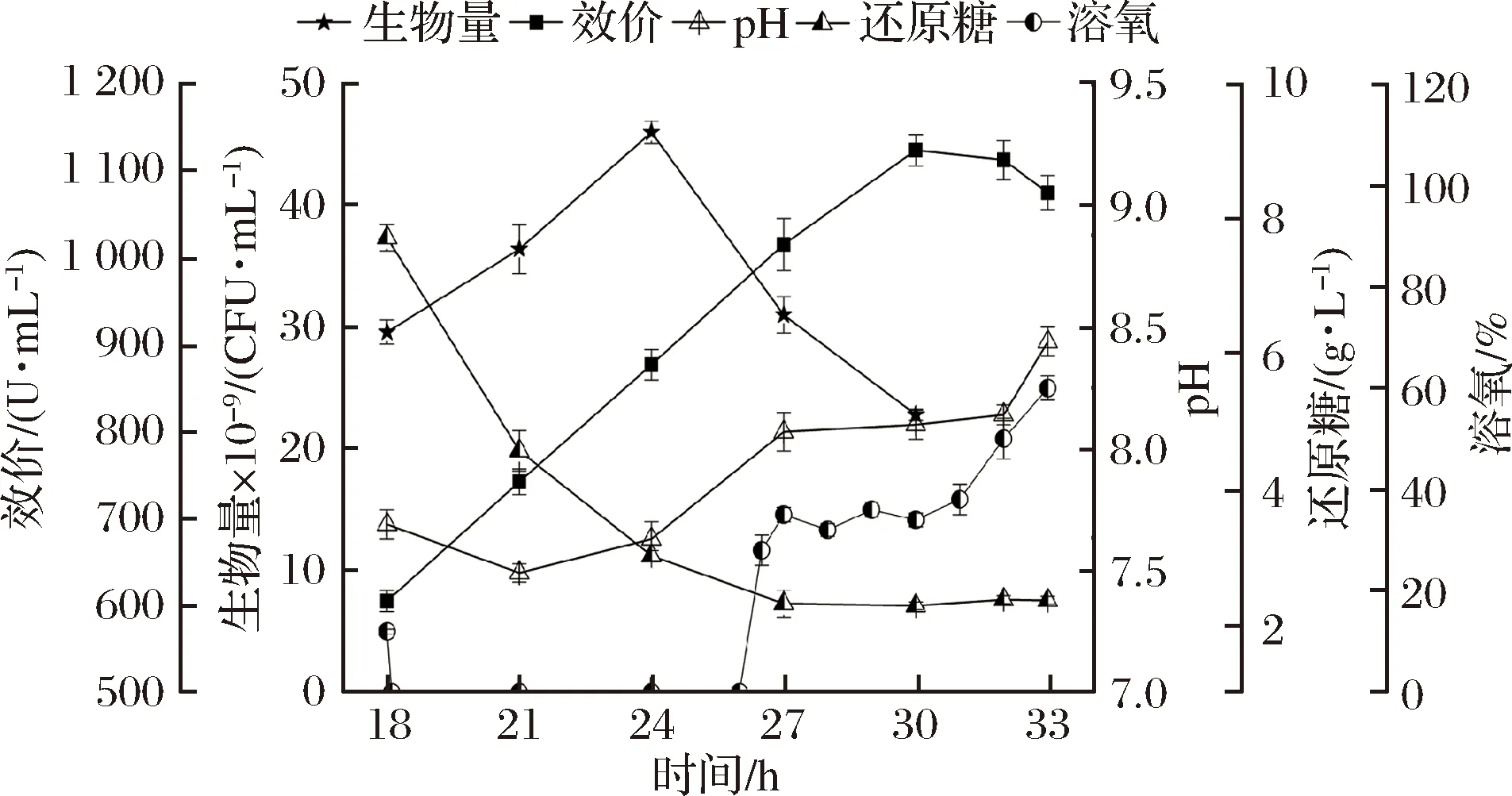
圖6 發酵6對細胞生長和桿菌肽合成的影響
Fig.6 Influences of fermentation 6 on cell growth and bacitracin synthesis
如圖6所示,菌體生物量在24 h即達到峰值46×109CFU/mL,和發酵5在24 h的菌體生物量相當(47.6×109CFU/mL),但比其峰值生物量減少了17%。雖然菌體在24 h后就逐漸自溶,但桿菌肽的合成速率沒有受到影響,進一步說明桿菌肽的合成不需要維持菌體的高生物量。
24 h開始葡萄糖耦合DO(35%)補料策略,由于24~27 h的DO一直低于35%,因而期間未補入葡萄糖。葡萄糖質量濃度從18~24 h快速下降(7.7~3 g/L),然后一直維持在2.3 g/L左右。
桿菌肽效價近線性上升至30 h的峰值濃度1 123 U/mL,與發酵5基本一樣,但是補糖量總計500 g,比發酵5補糖量(750 g)減少了33.3%,節約了成本。而且這種基于DO耦合的補料方式滿足了細胞對DO-糖代謝匹配的需求,桿菌肽對糖的得率系數(YP/S)提高了22.7%(表1)。
2.7 發酵策略7(間歇-DO耦合-二次氮源補料)對LC菌株生長和桿菌肽合成的影響
鑒于發酵6和發酵5的試驗結果,考慮到桿菌肽合成不僅與糖和DO有關,更是涉及到碳-氮-氧的綜合因素,因此,在發酵6的基礎上,于24 h二次補入氮源(豆粕250 g、玉米漿125 g)形成發酵策略7,考察其對桿菌肽合成的影響。
如圖7所示,桿菌肽效價持續合成至30 h,達到峰值1 220 U/mL,比發酵6提高了9.1%,說明24 h后,氮源不足是影響桿菌肽合成的另一個重要因素。另外,雖然生物量于24 h達到峰值(45×109CFU/mL)后自溶,但是27 h時細胞僅自溶了11%,相比于發酵6(自溶率33%)降低了66%。說明綜合匹配碳-氮-氧3個關鍵因素的補料方式能有效地維持細胞在發酵中后期的代謝活性,形成了基于細胞生理需求的發酵策略,突破了有關葡萄糖不適宜作為桿菌肽補料碳源的認知,并提高了桿菌肽的合成效率[40.67 U/(mL·h)],比相關報道[14]的桿菌肽合成效率[29 U/(mL·h)]提高了40.3%。
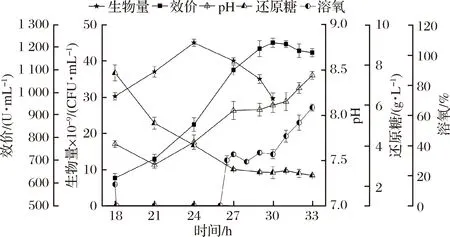
圖7 發酵7對細胞生長和桿菌肽合成的影響
Fig.7 Influences of fermentation 7 on cell growth and bacitracin synthesis
為了進一步分析補料策略對桿菌肽合成的影響,對發酵1~7進行了總結,相關參數如表1所示。
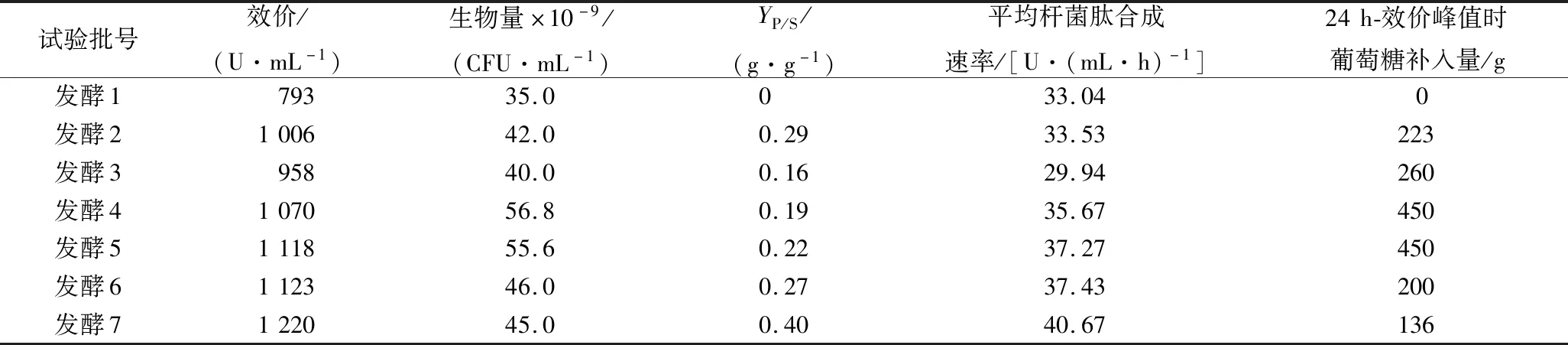
表1 所有試驗批次相關參數情況
注:效價為發酵過程中桿菌肽的最高效價;生物量為發酵過程中菌體的最高生物量;YP/S是糖對新增桿菌肽的得率系數,糖質量=效價達到峰值時補入的糖質量,新增效價=峰值效價-793,體積按27 L計,桿菌肽效價的質量系數為65.8 U/mg;平均桿菌肽合成速率為從發酵開始到桿菌肽達到最大值的平均桿菌肽合成速率。
如表1所示,發酵7桿菌肽效價最高,分別比發酵2、4提高了21%和14%。通過提高罐壓(增強氧的供應強度)、補入碳源、氮源,桿菌肽效價比未補料(發酵1)提高了54%,平均桿菌肽合成速率提高了23.1%,節省了發酵時間。同時發酵7形成了基于細胞碳氮源和能量需求的補料模式,其YP/S(葡萄糖桿菌肽得率)達到了0.4 g/g,遠高于其他補料試驗批次。
3 結論
本研究探索了碳、氮源的間歇補加、pH耦合流加、氧的供應強度以及DO耦合流加對細胞生長、代謝和桿菌肽合成的影響。結論如下:
(1)pH耦合補料策略(18 h補入氮源、pH耦合補糖)的桿菌肽效價(1 006 U/mL)比對照提高了27%,但當18~22 h需要增加葡萄糖供應量時,卻存在因pH低于耦合設定值而無法補入的缺陷。
(2)間歇補料-罐壓控制策略(18 h補入氮源、間歇補糖、罐壓控制)的效價(1 118 U/mL)比對照提高了41%,也比pH耦合策略提高了11%,但存在發酵后期碳源不足時(溶氧迅速回升至55%),葡萄糖無法及時補入、而細胞自溶后對糖需求量減少時仍按設定值補入的缺陷,即存在發酵后期補糖量與DO不匹配的問題。
(3)采用間歇-DO耦合補料策略(18 h補入氮源、18~21 h間歇補糖,24 h以后耦合DO補料、罐壓控制),可以避免18~24 h葡萄糖補入量不足和發酵后期葡萄糖補入過量的問題,雖然桿菌肽效價為1 123 U/mL,但是由于補糖量比間歇補料-罐壓控制模式減少了33.3%,因此桿菌肽對糖的得率系數(YP/S)提高了22.7%。
(4)基于間歇-DO耦合補料策略于24 h二次補入氮源后,桿菌肽效價峰值達到了1 220 U/mL,比pH耦合、間歇補料-罐壓控制分別提高了21%和9.1%,平均桿菌肽合成速率為40.67 U/(mL·h),突破了有關葡萄糖不適宜作為桿菌肽補料碳源的認知,形成了基于細胞需求的綜合碳-氮-氧因素的補料策略,為工業化補料發酵生產桿菌肽提供了重要參考。

