基于“學習進階”的初中化學教學設計
梁榮君
摘要: 針對教學實踐中的問題,結合學習進階基本要素進行教學設計;按能力層面設定宏觀、微觀和符號三個認知層面進階維度;通過對各層級進階水平、預估目標和評估方式的闡述,分析學習進階路徑圖,得出學習是螺旋上升的過程。在這過程中促成核心知識的落實和進階目標的達成。
關鍵詞: 學習進階; 化學方程式; 質量守恒定律; 教學設計; 初中化學 文章編號: 10056629(2019)6004407??????中圖分類號: G6338??????文獻標識碼: B
提高每一個學生的科學素養是科學課程的核心理念[1]。縱觀初中科學的知識體系,浙教版《科學》八年級下冊第三章第3節“化學方程式”包括“質量守恒定律”、“化學方程式”和“依據化學方程式進行計算”。在“質量守恒定律”部分注重宏觀實驗現象和微觀本質分析,而“化學方程式”和“依據化學方程式進行計算”這兩個部分以符號作為化學語言,融合宏觀、微觀層面,開始從符號表征的角度去認識化學反應過程,因此這節內容是初中化學中的核心知識內容。
然而,在教學實踐中卻存在一些問題,主要體現在以下幾個方面: (1)教學開始時忽略學生已有知識;(2)為了使質量守恒定律的得出具有普遍性,多個實驗的呈現缺乏邏輯性,缺少個體到系統思想的滲透和全部反應到具體反應的思維轉變;(3)在質量守恒定律內容表述上缺乏完整性;(4)在深化質量守恒定律過渡到化學方程式的書寫過程中,對于微觀本質的探討缺乏連貫性,沒有將宏觀現象和微觀本質進行有效融合;(5)依據化學方程式進行計算的教學中,缺乏對宏觀、微觀和符號三重表征有效整合的理解,將計算過程作為孤立和模式化的過程,導致學生在處理相關問題時缺乏自主和靈活應用能力。
學習進階是對學生在各學段學習同一主題的概念時所遵循的連貫的、典型的學習路徑的描述,一般呈現為圍繞核心概念展開的一系列由簡單到復雜、相互關聯的概念序列[2]。學習進階基本要素包括進階起點、進階終點、進階維度、多個相互關聯的成就水平和各水平預期表現及其評估。其中進階終點又稱為進階目標;多個相互關聯的成就水平表現為進階起點和各進階維度內的各層級進階水平;各水平的預期表現是指在達成較低層級進階水平后,處于某一層級進階水平時的應有表現,也可以稱為某一進階水平對應的預估目標。
1?進階起點分析
進階起點是指學生在學習新的知識時已有的知識。
在七年級上冊第四章已學習過物理變化和化學變化,通過實驗和生活中的現象,學生基本上能區分這兩種變化。在宏觀層面已形成了化學變化和物理變化的根本區別在于有無新物質產生。在八年級下冊第三章第一節也已學習過用文字表達式來表示化學反應的過程,學生已基本具備用文字表達式來表示常見化學反應的能力。
在八年級下冊第二章中學習了組成物質的元素、表示元素的符號、表示物質的符號等,已形成通過宏觀組成、微觀構成和符號表征三個維度進行認知的途徑。結合這些知識對物理變化中的微觀本質作出解釋,物質由分子等微粒構成,多個分子等微粒的質量之和表現為宏觀物質的質量。既然物理變化中分子種類和數量不變,那么宏觀物質的質量也不變,即物理變化的過程中,所有物質的質量保持不變,那么化學變化中各物質總質量如何變化?從物質能量觀角度而言,在化學變化中能量會發生變化,那么總質量是否會發生變化?
2?進階目標確定
當將學習進階應用到較長時段時,進階目標表現為課程目標。當將學習進階應用于一節內容教學時,進階目標則表現為課程標準中對應內容的目標和教學目標,因此進階目標是基于《初中科學課程標準》[3]、《科學教學參考書》[4]中關于實驗探究和該節內容的相關要求進行確定。
3?進階維度設定
進階維度是學習進階的內容維度[5]。內容可以是知識也可以是能力。將學習進階應用到“化學方程式”一節內容時,知識層面的核心概念包括質量守恒定律、化學方程式的書寫以及化學方程式的應用;能力層面則表現為從宏觀、微觀和符號不同的視角去認知化學反應的過程。知識和能力有一定的對應關系。
一般地,都以知識內容作為進階維度和各層級進階水平劃分的依據。但由于化學最重要的特征是利用宏觀、微觀和符號三重表征知識,同時在上述進階起點分析中已知學生已形成從宏觀、微觀和符號三個視角去認知具體的物質,因此在本節內容的教學中,進階維度設定為宏觀認知層面、微觀認知層面和符號認知層面。教學設計過程是在具體進階維度中按照認知特點分為若干層級的進階水平逐級進階的過程。由于進階維度的設定是基于能力層面的,因此各層級進階水平的設定也是與能力水平相對應的階段。
4?各維度進階水平及其預估目標和具體評估方式闡述
4.1?宏觀認知層面
這一維度對應的知識內容主要包括利用實驗得出質量守恒定律的完整表述的過程。按照教學進程將這一維度分成四個層級的進階水平。
4.1.1?層級11: 定性感知階段
這一階段是教學的起始階段,從具體的化學反應入手,感知化學反應中的質量變化問題。教師展示“木頭燃燒后留下灰燼”和“鐵釘生銹后外表附有厚厚的鐵銹”兩組實驗并設問: “這兩組圖片展示的是什么變化過程?其反應物分別是什么?質量如何變化?”。學生通過問題的思考和回答能辨別常見的化學反應并對反應物及其質量的變化有了定性的感知。
教師追問: “反應物的質量減少了,那生成物的質量呢?反應前后的總質量呢?”“用什么實驗方法能準確比較出化學反應前后物質的質量變化情況?”此時,教師引導學生通過實驗的方法測定化學反應前后物質的質量變化情況。
4.1.2?層級12: 間接定性比較階段
在層級1進階水平的基礎上,學生設計簡單的實驗方案測定實驗“木頭燃燒后留下灰燼”中參加反應物的質量變化。通過先測定反應物和生成物的質量,反應物是木頭和氧氣,生成物是灰燼和二氧化碳氣體。但氧氣和二氧化碳的質量比較難測定,因此遵循實驗可操作原則重新選擇具體的化學反應。最后確定氫氧化鈉溶液和硫酸銅溶液反應、過氧化氫制取氧氣、白磷燃燒三個實驗作為具體化學反應進行探究。
利用如圖1所示裝置,反應前將錐形瓶和滴管置于天平左盤,調節天平平衡,將滴管內的氫氧化鈉溶液滴入錐形瓶內,使兩種液體混合,觀察到產生了藍色沉淀確定已經發生化學反應,再次觀察天平是否平衡,判斷反應前后質量變化情況。由于該實驗通過天平是否平衡來確定總質量是否改變,不涉及具體的“量”,因此這一實驗涉及的實驗方法為間接定性比較的方法。
由于該實驗中不會有氣體進入或離開反應系統,是封閉型化學反應。實驗過程中封閉型化學反應無需密封實驗裝置即可對反應前后的質量進行比較。過氧化氫制取氧氣和紅磷燃燒的實驗中有氣體進入或離開反應系統,是開放型化學反應。開放型化學反應利用上述實驗裝置探究反應前后質量變化情況時應對錐形瓶進行密封。在過氧化氫制取氧氣的實驗中由于氣體的產生會使瓶內氣壓增大,可能會導致瓶塞沖出,造成實驗誤差并具有危險性。因此,對于封閉型化學反應利用該實驗裝置比較化學反應前后質量的變化是準確的,而對于開放型化學反應則會有較大的誤差。
4.1.3?層級13: 實驗修正并向定量測定轉變階段
過氧化氫制取氧氣的實驗中由于氣壓增大導致瓶塞沖出,可逐步對實驗裝置進行修正減少誤差,具體修正過程如圖2所示。經過修正發現活塞處摩擦不可避免,因此對實驗裝置進行修改: 利用精確的電子秤變間接定性比較為直接定量測定。直接定量測定的操作步驟為,首先分別稱出反應容器和反應物總質量及集氣瓶的質量,然后打開分液漏斗的閥門,通過排水法收集氧氣,最后重新稱出反應容器和剩余反應物總質量及收集滿氣體集氣瓶的質量,進行數據分析比較。
根據具體的化學反應,通過對實驗中誤差和不足的分析,有針對性地對實驗裝置逐步進行修正,促進學生分析和自主思考能力的提升,是發展宏觀辨識能力的體現。
4.1.4?層級14: 思維突破階段
通過上述各進階水平的達成,學生已經知道在化學反應中,反應前后物質的總質量不變的結論,但對于定律中“參與化學變化”這一難點還未突破。于是采用思維探究的方式,通過教師與學生的雙邊思維活動進行難點突破。
以紅磷燃燒的實驗為例,在通過實驗得出了紅磷燃燒前后質量不變之后,設置問題: “紅磷燃燒的實驗中是不是所有的物質都發生了反應?”“是不是可以認為發生反應的物質和生成的物質的質量相等?如何證明?”。通過對一系列問題的思考以及教師的指引和講解,得知若反應物全部反應了,那么生成物增加的質量一定和反應物減少的質量相等;若反應物部分反應了,由于未反應物質的質量不變,那么生成物增加的質量也應和反應物減少的質量相等。于是就可以確定質量守恒定律的適用范圍應是“在化學反應中,參加化學反應的各物質”。這一維度中各層級進階水平、預估目標和具體評估方式如表1所示。
這一進階維度對應的知識內容為質量守恒定律微觀本質的解釋及其理解,表現為三個層級的進階水平。
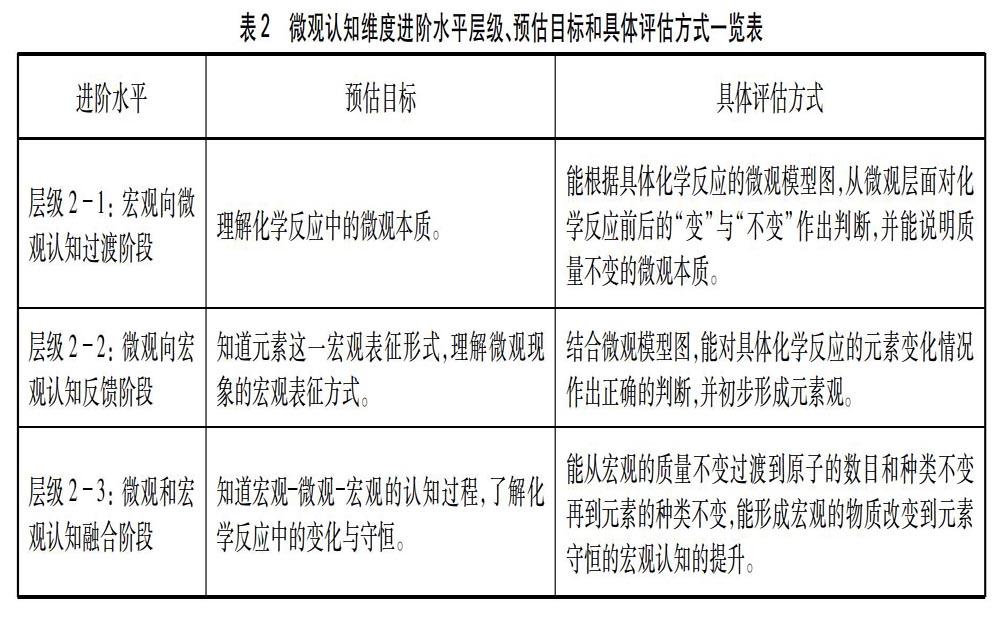
4.2.1?層級21: 宏觀向微觀認知過渡階段
此時已經確定質量守恒定律的內容及其適用范圍。根據進階起點,已經知道化學反應的實質在宏觀層面是產生新物質,從微觀層面而言是分子變成原子,原子重新組合成分子的過程。化學反應前后物質的總質量保持不變是宏觀現象,由于物質由微觀粒子構成,因此可以通過微觀認知視角對宏觀現象進行解釋。
如圖3是紅磷燃燒微觀示意圖,讓學生進行思考與討論: 紅磷燃燒前后磷原子和氧原子的數目在反應前后分別為多少個?如何變化?可得出化學反應的過程是原子重新組合成分子的過程,這一過程分子種類一定改變,而原子的種類和數目則不變。如圖4是過氧化氫制氧氣微觀模型圖,讓學生思考化學反應前后微觀粒子的變化情況。通過思考從微觀角度突破質量守恒定律中關于“參與化學變化”這一難點。
4.2.2?層級22: 微觀向宏觀認知反饋階段
質量守恒定律實質上是對質量變化規律的文字表述,從實驗角度證明這一規律是宏觀表征的體現,而對其進行微觀解釋則是微觀表征的體現,因此在理解微觀本質的基礎上,更要知道微觀和宏觀表征的對應之處。依據進階起點物質由元素組成,元素是指質子數相同的一類原子的總稱,因此物質從宏觀角度而言由元素組成,從微觀角度而言由分子或原子構成。結合圖3和圖4進行思考,在紅磷燃燒和過氧化氫制取氧氣的實驗中,反應物和生成物分別由哪些元素組成?在化學反應前后元素種類和生成物質量發生怎樣的改變?
4.2.3?層級23: 微觀和宏觀認知融合階段 認識化學反應的過程是“宏觀微觀宏觀”的過程,因此對于質量守恒定律的進一步理解應體現在宏觀和微觀認知視角的相互融合上。結合具體實驗,通過分析建立學生認知轉變圖(如圖5所示),體現學生從“物質改變”到“元素守恒”這一宏觀認知的提升。
因此,化學反應中的“變化”,從實驗這一宏觀現象出發表現為反應物及其狀態等實驗現象的變化得出物質種類的變化;其微觀本質則是分子變成原子,原子重新組合形成新的分子,導致“守恒”這一結果的出現;宏觀表征為質量不變和元素守恒,微觀表征為原子種類和數目的不變。通過雙重認知視角的融合,學生充分理解了質量守恒定律中的變化和守恒的辯證關系,也是平衡思想和變化觀念的具體表現,更體現了微觀探析能力。這一維度中各層級進階水平、預估目標和具體評估方式如表2所示。
4.3?符號認知層面
化學符號是化學語言,也是化學學科特有的一種表征方式,學生從宏觀和微觀視角認知化學反應后,在建立模型的基礎上,通過符號對物質進行表征是必然結果,因此化學反應過程也應體現在符號認知層面上,這一維度對應的知識內容是化學方程式及其應用,其進階水平表現為四個層級。
4.3.1?層級31: 符號定性表征反應階段 化學反應的文字表達式是對化學反應過程的定性表達。結合表示物質的化學式,讓學生寫出“紅磷燃燒”、“過氧化氫制取氧氣”的化學表達式。
4.3.2?層級32: 符號定量表征反應階段
質量守恒定律是對化學反應過程的定量描述。在學生能寫出表達式的基礎上,結合質量守恒定律將表達式轉化為定量表達是必然結果。
由于宏觀物質和符號是對應的,再結合微觀層面各層級進階水平的達成,在化學式前填上合適的計量數可以達到表征反應前后原子數量相等的目的,因此讓學生嘗試在“紅磷燃燒”的化學表達式中的化學式前面填上合適的計量數使表達式滿足質量守恒定律。這一過程稱為配平,此時將表達式中的“→”改為“”,再在符號上方添加反應條件,該表達式更名為化學方程式。學生完成“過氧化氫制取氧氣”的化學方程式,結合學生書寫情況,確定書寫化學方程式的具體步驟和書寫原則。
4.3.3?層級33: 宏微結合理解符號階段
在熟練掌握化學方程式的書寫后,在回顧化學式意義的基礎上,嘗試回答化學方程式的意義。以紅磷燃燒的化學方程式為例,定性宏觀層面表示反應物是紅磷和氧氣,生成物是五氧化二磷,反應條件為點燃;定量微觀層面表示4個磷原子和5個氧分子結合變為2個五氧化二磷分子,此時提示學生將具體的數量關系轉變為比例關系,即在這一化學反應中磷原子、氧氣分子和五氧化二磷分子之比為4∶5∶2;再以化學式對應的相對原子質量或相對分子質量引導學生得出這一化學反應中磷原子、氧氣分子和五氧化二磷分子的相對分子質量之比為31∶40∶71;最后引導學生理解從宏觀定量層面而言,這一化學反應中各物質的質量之比為31∶40∶71。
上述具體例子說明,實現從宏觀定性→微觀定量→微觀比例關系→宏觀比例關系→宏觀定量的轉變,宏觀和微觀相結合達到了理解化學方程式的目的。
4.3.4?層級34: 三重表征初步整合階段
用符號將化學反應的宏觀和微觀表征進行有效整合,是“三重表征”的體現,也是從三個視角去認知反應的過程。
學習知識是為了解決實際問題。在生產和科學研究中,對于化學反應常常要分析清楚各物質間的質量關系。如選取例題“實驗室用分解過氧化氫的方法制取氧氣。現要制得2克氧氣,需要多少克過氧化氫?”結合例子講解確定根據化學方程式計算的步驟。依據化學方程式進行計算是實際應用的一種方式,具體體現在對化學方程式的理解上。其他更多的實際問題要求學生在了解三重表征的基礎上,從三個認知視角去解決。如:
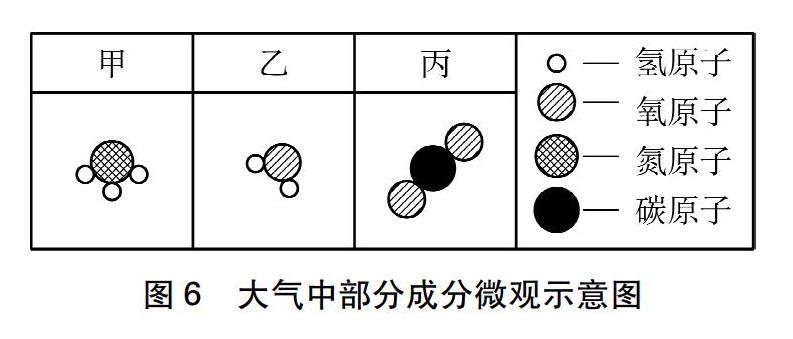
地球大氣演化經歷了原始大氣、次生大氣和現代大氣三個階段,次生大氣中部分成分的微觀示意圖如圖6所示,一定條件下,3.4g甲物質和4.8g氧氣恰好完全反應,生成5.4g乙物質和另一種物質X,下列判斷不正確的是(??)。
A物質甲的化學式是NH3
B物質X的質量為2.8g
C?物質X中含兩種元素
D?該反應的化學方程式中物質X與O2的化學計量數之比為2∶3[6]
在求解這一題目的時候學生要懂得靈活地選擇認知視角和表征方式,A選項是微觀和符號表征的結合;B選項則要通過對微觀模型和宏觀質量關系得出宏觀結果,是微觀和宏觀表征的結合;C選項則是符號和微觀表征的結合;D選項則是宏觀、微觀和符號三重表征整合的結果。
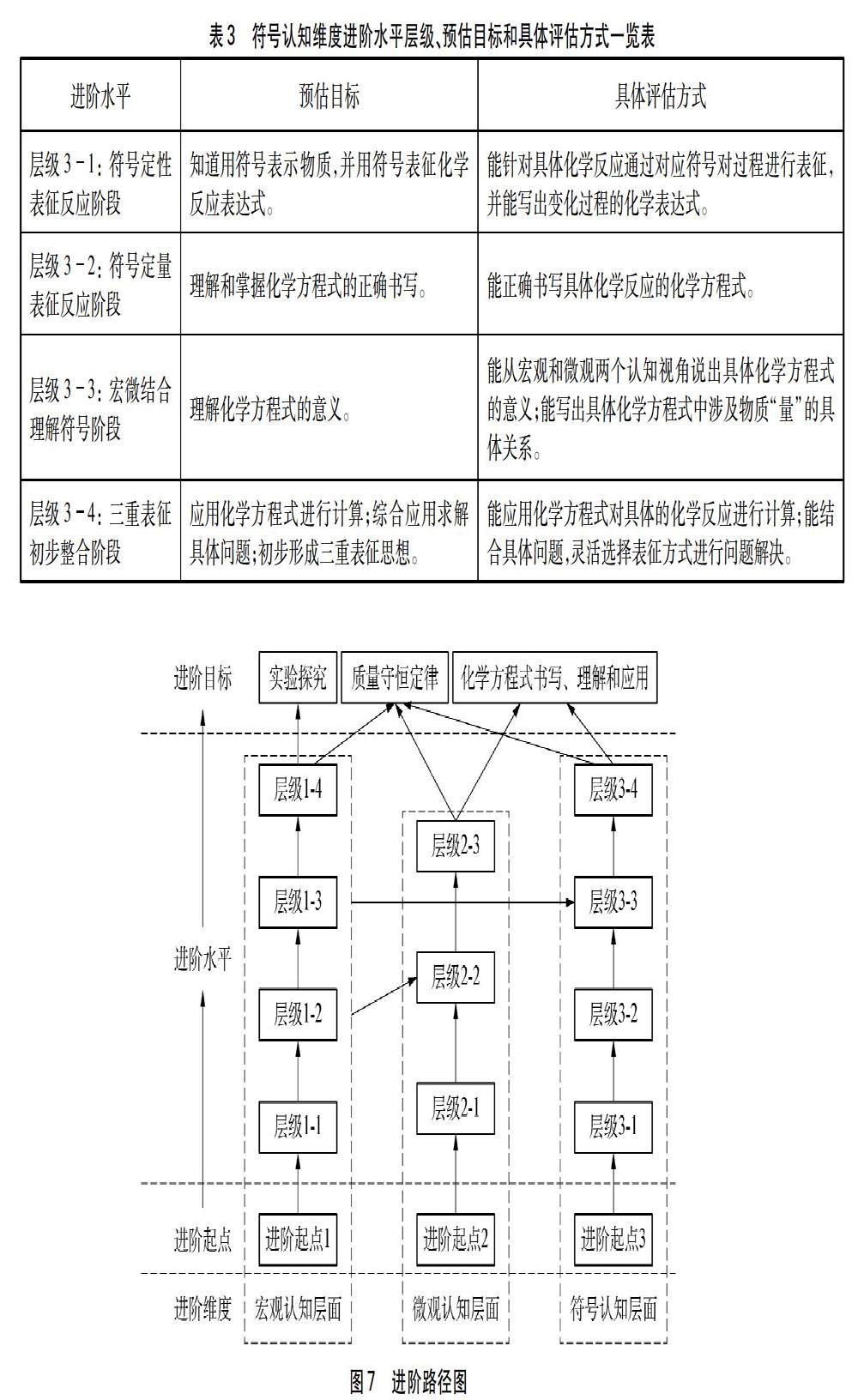
因此,在具體的問題中學生應懂得選擇合適的認知視角和表征方式去解決實際問題,這就要求學生需形成“三重表征”的思想,從而達成進階目標。這一維度中各層級進階水平、預估目標和具體評估方式如表3所示。
5?進階路徑圖及其說明
綜上,“化學方程式”具體學習進階路徑如圖7所示。
在教學的進程中,各進階維度所達成的各層級進階水平是獨立的,較低層級進階水平是較高層級進階水平的基礎,隨著每個層級進階水平的達成促成進階目標的達成。具體的進階目標落腳于具體的知識,這體現在進階路徑圖的縱向進程上,可以認為各進階維度之間是并列的關系。但進階維度的某些層級進階水平與其他維度的某些層級進階水平是關聯的,如層級22(微觀向宏觀認知反饋階段)即以層級21(宏觀向微觀認知過渡階段)為基礎,也涉及到宏觀認知層面這一維度;再如層級34(三重表征初步整合階段)的達成即涉及同維度低層級進階水平的達成,也涉及到宏觀和微觀認知層面這兩個進階維度等等,這體現在進階路徑圖的橫向進程上,可以認為各進階維度之間是交叉關系的;然而作為化學知識特有的三種表征方式,從學生的認知角度而言,首先接觸的是宏觀認知層面及其相關表征,再深入到微觀認知層面及其相關表征,最后通過構建模型建立符號去認識化學知識并進行相關表征,可以認為各進階維度之間是遞進關系的。因此,學生學習的過程是通過進階路徑圖中各層級進階水平的達成螺旋上升的過程。
總之,“化學方程式”作為初中科學中核心的化學知識,也是學生定量認知化學變化的開始,在整個知識體系的構建中起著重要的作用。另者,就學習進階而言,進階目標的達成是本節教學的終點,也是新的教學的進階起點,如宏觀辨識與微觀探析能力、“三重表征”思想、守恒觀的初步形成等等均要通過更高一級的學習再逐級進階。
參考文獻:
[1][3]?中華人民共和國教育部制定. 義務教育科學課程標準[S]. 北京: 北京師范大學出版社, 2012: 5, 14, 33.
[2]?劉晟, 劉恩山. 學習進階: 關注認知發展和生活經驗[J]. 教育學報. 2012, (4): 81.
[4]?朱清時. 科學教學參考書(八年級下冊)[M]. 杭州: 浙江教育出版社, 2014: 80.
[5]?楊云霞. 學習進階的研究現狀[J]. 科教導刊, 2018, (8): 3.
[6]?陳繼清. 質量守恒定律考點例談[J]. 中學化學, 2017, (2): 21.

