缺氧誘導BCL9促進結腸癌細胞的增殖與遷移
臧佳 謝亞運 李新星 張言言 胡志前
絕大多數惡性腫瘤生長迅速,導致腫瘤內部處于相對缺血、缺氧的狀態。在缺氧的條件下,缺氧誘導因子 1α(hipoxia induce factor 1α,HIF1α)亞基因降解受到抑制而在腫瘤細胞內部堆積[1-2]。大量堆積的HIF1α廣泛啟動下游基因的表達,改變細胞的能量代謝方式,誘導毛細血管生成,加速腫瘤細胞分裂、增殖[3-4]。
以往研究認為B-淋巴細胞瘤蛋白9(B-cell lymphoma 9,BCL9)是Wnt通路下游的轉錄協同因子,BCL9的表達能促進肝癌,胃癌,乳腺癌的發展[5-7]。在BCL9的啟動區域,存在多個缺氧誘導反應元件(hipoxia response element,HRE),BCL9可能受到HIF1α調控表達,從而促進腫瘤進展。目前,BCL9在結腸癌中的研究尚未見詳細報道,本研究擬探索HIF1α對BCL9的調控關系,并進一步探明BCL9對結腸癌細胞的惡性生物學作用。
材料與方法
一、一般資料
本研究中所有結腸癌標本及同一患者的正常結腸標本,皆來自2013年1月至2016年7月在上海長征醫院接受了腫瘤切除手術的患者,并且術后病理確診為結腸癌。所入選的病例均被告知研究內容,并取得患者本人或委托人的知情同意。收取的典型結腸癌及相應正常結腸組織立即放入液氮凍存或福爾馬林固定。本研究中所使用的HCT116細胞購自美國ATCC公司,配制含10%胎牛血清、90%DMEM高糖培養基、1%雙抗(鏈霉素、青霉素)的培養基培養細胞,低氧培養時設置氧濃度為4%。
二、實驗方法
1.免疫組織化學檢測BCL9:10%福爾馬林固定標本;梯度乙醇脫水,石蠟包埋組織;切片機切片(4 μm);60度烘烤切片20 min,二甲苯浸泡10 min(2次),無水乙醇浸泡5 min,梯度乙醇脫水,蒸餾水洗滌;使用抗原修復液修復抗原,3%雙氧水阻斷過氧化物;BCL9(1:3 000稀釋;ab37305,Abcam),室溫孵育1 h,PBS洗滌5 min,3次;孵育二抗,過程同前;使用DAB溶液顯色7 min;蘇木精復染,松節油封片,晾干;顯微鏡鏡下觀察、拍照。
2. RNA提取、逆轉錄及實時定量PCR:按常規方法抽提總RNA,使用TAKARA公司逆轉錄試劑盒逆轉錄。熒光實時定量PCR試劑購自Biotool公司,依說明書配制反應體系。設置反應程序為:初始95℃ 10 min;95 ℃ 30 s解鏈,58℃ 30 s退火,72℃ 10 s延伸,共40個循環;以GAPDH為內參,設三個復孔,取平均值。BCL9引物為,正向:5′-CAGCTGGATTCCAAATTCTC-3′, 反 向:5′-GAGTCGGCGGAAATACTTCG-3′;GAPDH 引物為,正向:5′-AACGGATTTGGTCGTATTG-3′,反向:5′-GGAAGATGGTGATGGGATT-3′。
3. 蛋白印記法檢測BCL9、HIF1α表達:裂解細胞收集蛋白;常規電泳、轉膜;10%脫脂牛奶封閉,室溫、搖床約2 h;TBST漂洗5 min;將PVDF膜放入抗體孵育盒中,加入用一抗體稀釋液(抗 BCL9、HIF1α、Actin,購自美國Santa公司),搖床4℃過夜;搖床上用TBST緩沖液漂洗3次,每次10 min;加入辣根過氧化物酶標記的二抗(美國Santa),搖床室溫孵育1 h;TBST漂洗3次,將ECL發光底物A、B按比例混合,適量覆蓋PVDF膜,顯影。
4. 熒光素酶活性檢測:設計引物調取BCL9的啟動子序列,5′-ACG CGT GCT AGC CCG GGC AGA TGG TCT CCG TCT CCT-3′;5′-AAC AGT ACC GGA ATG CCA GAC AAG CCA CAA ACA AGA C-3′;將啟動子序列克隆至PGL3載體XhoIHindIII酶切位點之間,測序驗證載體構建成功(PGL3-P-BCL9);實驗組轉染PGL3-P-BCL9后予缺氧處理或合并轉染HIF1α表達質粒(pcDNA3.1+HIF1α,購自金維智公司),對照組轉染PGL3-P-BCL9后予常氧培養或合并轉染pcDNA3.1+,48 h后裂解細胞,加熒光素試劑(購自Biotool公司),檢測熒光值。
5. CCK8細胞活性及Transwell實驗:以HCT116為靶細胞,轉染siRNA或過表達質粒pcDNA3.1+BCL9干 預BCL9的 表 達(siRNA序 列 為:CCUGAGGAGAUGCUGAAAUUAC),通過實時熒光定量PCR檢測干預效率,將干預后的HCT116細胞以相同密度接種于96孔板中,于36 h檢測吸光度;將干預后的HCT116細胞以相同密度接種于Transwell上室(武漢博士德生物技術有限公司),下室加入含10% FBS的培養基。培養24 h后結晶紫染色,拍照記錄結果。
三、統計學分析
應用SPSS 20.0統計軟件分析。計量資料采用均數±標準差()表示,組間比較采用t檢驗,以P<0.05為差異具有統計學意義。
結 果
一、結腸癌中BCL9表達升高
通過免疫組化技術,檢測20例結腸癌及同一患者正常結腸組織中BCL9的表達。結果如圖1A所示,腫瘤組織中BCL9表達量明顯高于正常組織。圖1B為實時熒光定量PCR檢測腫瘤及正常組織中BCL9 RNA的表達量,腫瘤組織中BCL9 RNA的表達量明顯高于瘤旁組織[(3.25±0.53)vs.(1.03±0.12),P<0.05],差異具有統計學意義。

圖1 腫瘤組織與正常組織的免疫組化與實時熒光定量PCR。1A:免疫組織化療結果顯示,腫瘤組織的BCL9表達量明顯高于正常組織(10倍鏡與40倍鏡下);1B:實時熒光定量PCR檢測發現BCL9 RNA的表達明顯高于正常組織,P<0.05,差異具有統計學意義
二、結腸癌中HIF1α調控BCL9表達
在BCL9啟動區域存在3個HRE,其具體位置如圖2A所示,HRE是HIF1α識別并結合靶基因的位點。通過缺氧或常氧培養HCT116細胞,于36 h后抽提總RNA進行實時熒光定量PCR檢測,結果如圖2B,缺氧與常氧組比較,[(6.71±0.83)vs.(1.54±0.21),P < 0.05],差異具有統計學意義;同時,我們抽提靶細胞蛋白,通過western-blot在蛋白水平驗證BCL9的表達(圖2C)。通過上述結果,我們發現缺氧誘導BCL9表達升高。為了進一步驗證缺氧誘導BCL9表達是通過HIF1α所介導,我們構建了含BCL9啟動子區域的熒光素酶報告載體PGL3-P-BCL9,并進行熒光素酶報告實驗,結果顯示如圖2D-E所示,缺氧或過表達HIF1α后熒光素酶活性明顯增強[(3.53±0.75)vs.(0.96±0.15),(4.83±0.62)vs.(1.02±0.14);P<0.05]。上述結果表明,缺氧誘導HIF1α激活BCL9的表達。
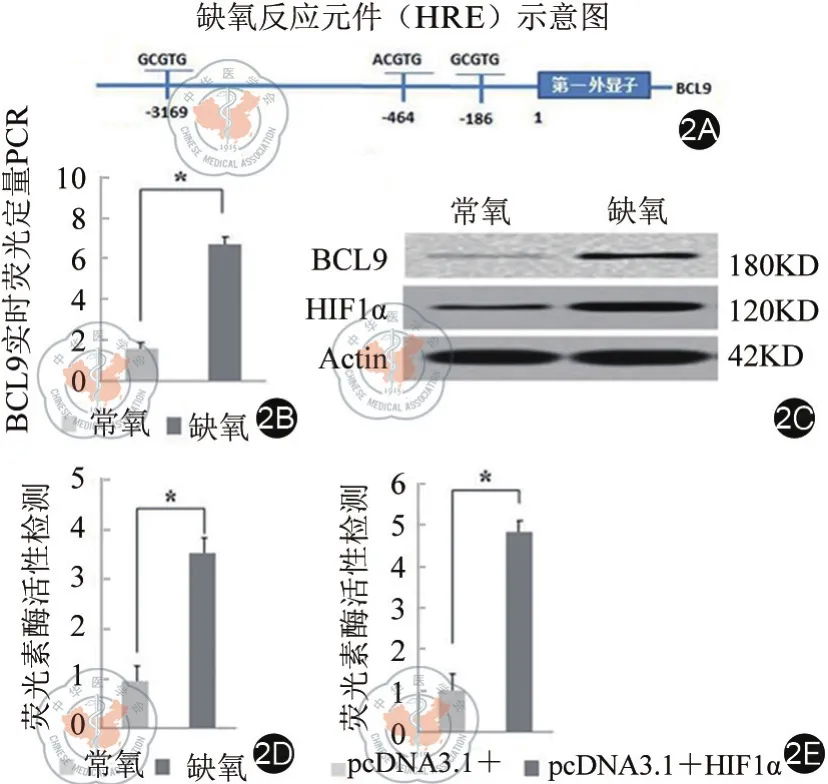
圖2 HIF1α調控BCL9表達。2A:BCL9啟動子區缺氧誘導原件(HER)的分布;2B:實時熒光定量PCR檢測BCL9 RNA的表達;2C:western-blot檢測BCL9、HIF1α的表達;2D、2E:熒光素酶活性檢測。代表P<0.05,差異具有統計學意義
三、BCL9促進結腸癌細胞增殖、遷移
以HCT116為靶細胞,通過siRNA或過表達質粒pcDNA3.1+BCL9干預BCL9的表達,實時熒光定量PCR檢測干預效率,結果如圖3A所示。干擾BCL9表達后,HCT116細胞的增殖活性明顯受到抑制[(1.23±0.12)vs.(1.87±0.15),P<0.05];過表達BCL9后,HCT116細胞的增殖活性明顯增強[(2.43±0.16)vs.(1.81±0.14),P<0.05],結果如圖3B所示。同時,干擾BCL9表達后,HCT116細胞的遷移能力明顯受到抑制;而過表達BCL9促進了HCT116細胞遷移(圖3C~D)。

圖3 BCL9對結腸癌細胞增殖和遷移能力的影響。3A:實時熒光定量PCR檢測BCL9干預效率;3B:CCK8實驗檢測干預BCL9后HCT116的增殖活性;3C、3D:Transwell實驗檢測干預BCL9后HCT116的增殖活性。代表P<0.05,差異具有統計學意義
討 論
結腸癌是常見的消化道惡性腫瘤,發病率占胃腸道腫瘤的第三位,其發病年齡基本在40歲以上,高發于50~60歲之間,男女比例為2~3:1。近年來,結腸癌的發病率與病死率呈上升趨勢,全世界每年大約有120萬新增病例。盡管近年來外科手術和化療方面取得了長足的進展,患者的5年生存率至今仍徘徊在50%左右,多數患者最終仍然死于結腸癌的局部復發或遠處轉移[8]。了解結腸癌惡性生物學行為的分子機制,探索精準、有效的治療方法已成為國內外研究該疾病的焦點。
人源BCL9首先在B細胞急性淋巴母細胞白血病(ALL)患者中發現,屬于條件細胞核相關蛋白并可穿梭于細胞核內外,在與核內的轉錄輔因子Pygo結合后則分布于核內[9]。有研究表明,BCL9在Wnt信號通路中作為銜接蛋白與β-catenin、TCF/LEF和Pygopus結合,形成TCF/LEF-βcatenin-BCL9-PYGO四聚體核復合物,從而參與激活經典Wnt信號通路下游靶基因的轉錄,促進腫瘤細胞增殖、轉移以及腫瘤組織血管生成[10-11]。BCL-9在多中惡性腫瘤組織中表達上調,如多發性骨髓瘤、肝細胞癌、胃癌、乳腺癌及肺腺癌組織等表達上調,并促進腫瘤細胞的增殖[5-7]。關于BCL9在結腸癌中的研究尚未見到詳細報道,我們通過免疫組化及實時熒光定量PCR檢測20例結腸癌組織及相應的正常結腸組織,發現結腸癌中BCL9表達明顯增高。
由于惡性腫瘤生長迅速,腫瘤內部微環境常處于相對缺氧的狀態,造成HIF1α在細胞內堆積,并與HIF1β形成穩定的二聚體進入細胞核,激活大量下游基因的表達,調整細胞適應缺氧環境[12-13]。HIF1α特異性地識別并結合HRE(G/ACGTG),從而激活靶基因的轉錄[14],在BCL-9啟動子區域存在多個HRE,我們認為結腸癌中BCL9的高表達可能由HIF1α激活所致。我們以HCT116細胞為靶細胞,給予缺氧處理后發現BCL9及HIF1α的表達在RNA水平及蛋白水平中顯著提高。為了進一步驗證HIF1α對BCL9的調控關系,我們構建了含有BCL9啟動子序列的熒光素酶報告載體,通過合并轉染對照和過表達HIF1α質粒,發現過表達HIF1α后熒光素酶活性明顯增強,這進一步證明了HIF1α對BCL9的調控關系。隨后,為了探索異常表達的BCL9對結腸癌的生物學作用,我們通過siRNA和過表達質粒干預HCT116細胞中BCL9的表達,結果表明干擾BCL9的表達可以抑制HCT116細胞的增殖及遷移能力,增強BCL9的表達可以促進HCT116細胞的增殖及遷移能力。
本研究表明,缺氧誘導BCL9在結腸癌組織中高表達,并且BCL9高表達可以促進結腸癌細胞的增殖及遷移,為研究結腸癌惡性生物學行為的分子機制提供了新的理論借鑒。同時,由于BCL9又是Wnt信號通路上的重要的轉錄協同因子,這表明缺氧信號通路可能通過BCL9參與Wnt信號通路的調控,為信號通路的網絡關系研究提供新的思路。

