硬化性肺細胞瘤的臨床及多層螺旋CT表現
王梅 曹捍波 王和平 王兆宇
硬化性肺細胞瘤(pulmonary sclerosing pneumocytoma,PSP)是一種少見的肺良性腺瘤,多于體檢時偶然發現,因臨床表現和影像學表現缺乏特異性而易被誤診。本研究對18例經手術及病理證實的PSP患者資料進行回顧性分析,探討其MSCT征象,旨在加深對此疾病的認識,為臨床診治提供參考依據。
1 資料和方法
1.1 一般資料 收集我院2012年6月至2017年6月治療的18例PSP患者臨床資料,男3例,女15例,年齡18~73歲,中位年齡52歲。18例均無明顯肺部臨床表現,健康體檢或非肺部其他疾病住院檢查發現14例,肺部其他疾病CT檢查發現4例。所有患者均經手術病理證實。本研究經本院倫理委員會同意。
1.2 儀器與方法 采用東芝Aquilion 64排螺旋CT機,常規胸部掃描,掃描范圍從肺尖至肺底部水平,掃描電壓 120kV,電流 110mA,準直 0.625×64,層厚和層距均為3mm作為掃描參數。其中12例行CT增強掃描,CT增強患者使用非離子型碘對比劑(320mgI/ml),經右肘正中靜脈取注射速度3.0ml/s,1.5ml/kg計算患者所需對比劑總量,自動團注法追蹤技術,雙期掃描。以最小層厚 0.5mm,間隔 0.5mm,高分辨率算法(HRCT)及標準法重組,而后傳入Vitrea圖像后處理工作站,利用重建軟件對病灶進行多平面重組(multiplanar reformation,MPR)、最大密度投影(maximum intensity projection,MPR)及容積再現(volume rendering,VR)等后處理,從而顯示病灶形態與鄰近結構關系。
1.3 圖像分析 所有CT圖像在肺窗(窗寬1500HU,窗位-500HU)和縱隔窗(窗寬400HU,窗位40HU)下進行觀察,由2位高年資胸部放射學診斷醫師分別獨立閱片,并記錄以下內容:(1)病灶形態學表現:包括病變位置、大小、形狀、有無分葉、密度(平均CT值)及有無鈣化;(2)鄰近結構改變:即病變周圍組織的繼發性改變(包括“血管貼邊征”、“暈征”及“空氣新月征”);(3)增強表現:主要包括強化類型及程度。增強后無肉眼可辨的密度不均勻區,為均勻強化;增強后病灶內見點、條狀及片狀強化顯著區或不強化區,為不均勻性強化。增強程度按Swensen標準[1],即CT值增加<15HU為無強化,CT值增加15~25HU輕度強化,CT值增加>25~45HU中度強化,CT值增加>45HU明顯強化;(4)有無肺門和(或)縱隔淋巴結腫大。
2 結果
病灶形態學改變:18例PSP均為單發,其中左肺6例(上葉2例,下葉4例),右肺12例(上葉2例,中葉4例,下葉6例),病變肺葉分布無明顯傾向性,均位于肺野外帶靠近胸膜下,呈圓形或類圓形,邊界清楚,直徑8~31mm,平均 18.9mm,未見分葉,2 例(11.1%)病灶內見斑點狀鈣化影。鄰近結構改變:6例(33.3%)病灶旁見“血管征貼邊”(圖 1),2 例(11.1%)見“暈征”(圖 2),1 例(5.6%)見“空氣新月征”(圖 3)。增強表現:12 例同時行平掃和增強的病例中,平掃平均CT值約16~48HU,平均35.7HU,動態掃描 CT 值 48~113HU,平均 82.6HU,增強掃描強化凈值(47.5±21.2)HU,8 例為不均勻強化,4 例均勻強化。18例PSP均無肺門和(或)縱隔淋巴結腫大。
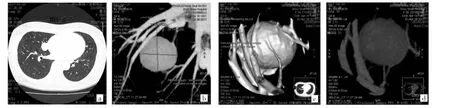
圖1 患者,女,56歲。(a:肺窗右肺中葉見一類圓形高密度影,邊界清晰;b:MIP示病灶大小21.5×24.3mm,密度均勻;c、d:三維重建見“血管貼邊征”)
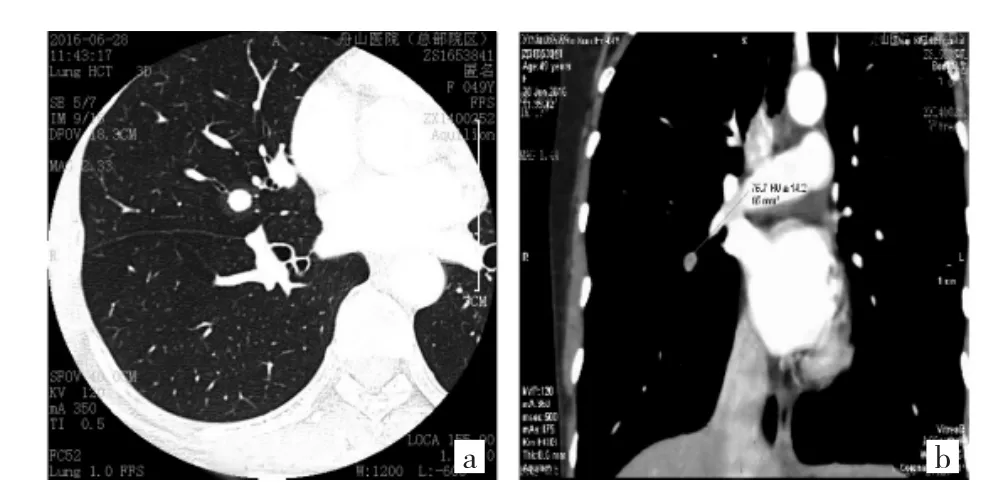
圖2 患者,女,49歲。[a:右肺中葉見一類圓形高密度影,邊界光整,病灶邊緣見“暈征”;b:增強掃描平均CT值約(75.7±14.2)HU]
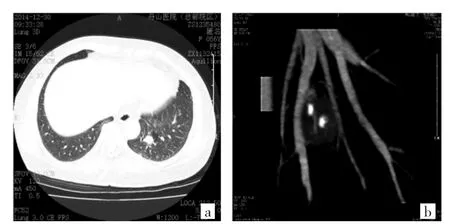
圖3 患者,女,56歲。(a:左肺下葉類圓形高密度影,病灶邊緣見“空氣新月征”;b:MIP重建病灶內見鈣化,瘤旁見“血管貼邊征”)
3 討論
3.1 臨床及病理特點 PSP是肺泡至終末細支氣管的錯構,組織來源是原始呼吸系統上皮的腫瘤[2],2015年WHO肺腫瘤分類把它列入肺腺瘤,屬于上皮來源良性腫瘤(0類)[3]。光鏡下觀察腫瘤是由位于上皮下間質中卵圓形細胞和表面立方形細胞構成四種組織形態結構:血管瘤樣區、乳頭狀區、實性區、硬化區(纖維化區)。由于細胞是連續譜系,組織結構有序貫關系,所以PSP內有2種或2種以上結構混合存在,不同組織結構間相互移行。本組患者均有3種以上結構。有研究發現卵圓形細胞的雌激素受體、孕激素受體在該腫瘤中具有高表達性[4-5],這為PSP好發于女性提供了細胞學證據。本組研究18例PSP患者,男3例,女15例,男女比例是1∶5,與文獻報道PSP好發于中年女性相符[5]。PSP患者一般無臨床不適癥狀,少數表現為咳嗽、咳痰、胸悶、胸背部痛、咳血及發熱等非特異性表現,有學者提出PSP病灶愈大、位置越靠近肺門,引起胸部不適等癥狀的概率越高,本組病灶平均直徑18.9mm,且多位于肺野外帶,無肺部癥狀[6-8]。
3.2 CT表現與病理基礎 PSP的典型CT表現為肺內孤立性結節或腫塊,圓形或類圓形,邊界清晰,很少有分葉。本組研究中12例(66.7%)PSP表現為圓形,6例(33.3%)為類圓形,均為孤立性結節,境界清楚,無分葉。PSP組織細胞來源較為一致,且沒有阻擋時(如葉間胸膜限制)生長上具有各向同向性,結果必然是接近圓形或類圓形。由于良性腫瘤屬膨脹性生長,細胞數量逐漸增多,腫瘤內上皮間質轉換(EMT)緩慢而有限,因此病灶即使位于胸膜下,也無胸膜牽拉。肺腫瘤鈣化的發生在纖維化區域、軟骨及壞死組織,形成和發展的速度很慢,PSP的硬化區即纖維化組織,持續很久就會出現散在或條狀的鈣化,多位于病灶邊緣。本組患者中有2例(11.1%)見鈣化。
本組患者動態增強掃描均為中至顯著強化,其中8例為不均勻強化,4例為強化均勻。增強明顯強化的區域是血管瘤樣區和乳頭狀區,實性區和纖維硬化區強化程度較低,結合免疫組化分析,血管瘤樣區的血管樣結構內襯肺泡上皮細胞,甲狀腺轉錄因子陽性,而CD34陰性。史景云等[9]認為PSP強化程度與病灶內微血管密度有關,組織學以血管瘤樣及乳頭狀結構為主的病灶,微血管密度高,增強掃描表現為早期顯著強化。而本研究發現單憑腫瘤內微血管密度增高不足以解釋其強化幅度常高于肺癌的情況,因為肺癌的微血管密度不低于PSP,再次對照病理切片,看見血管瘤樣區內的紅細胞是鮮活狀態,說明血管瘤樣區內有血液灌注,對比劑可以完全可以進入,這些區域面積遠大于普通血管截面積之和,所以PSP增強掃描呈中度、顯著性及漸進性強化。
鄰近結構改變:本研究6例(33.3%)瘤旁見“血管貼邊征”,發生機制可能是PSP屬于成年后生長和發展的良性腫瘤,病灶雖然膨脹性生長,但它不像早期肺癌沿著肺泡壁貼壁生長,將血管支氣管包繞進來,而是隨著腫瘤膨脹性生長,壓迫、推擠鄰近的氣管及支氣管結構,形成所謂的“血管貼邊征”。2例(11.1%)病灶邊緣見淡薄的“暈征”,結合病理血管瘤樣區有血液灌注,這些區域并沒有像血管一樣完整的邊界,也就是說有縫隙,血液可以向周圍肺泡滲出,這樣就形成了出血暈征,常常呈很淡的云霧狀,邊界不清,密度較低,不掩蓋腫瘤邊緣。部分文獻報道“空氣新月征”[10],即病灶周圍半月形無肺紋理透亮影,多為腫瘤內殘存支氣管或瘤體內出血破裂與鄰近支氣管相通,形成單向閥門效應有關,本組病例中僅1例。本組病例均未見肺門及縱隔淋巴結轉移,與周永等[11]研究一致。
綜上所述,筆者認為硬化性肺細胞瘤具有以下特點:(1)好發于中老年女性、幾乎無呼吸道癥狀;(2)CT表現為肺內孤立性結節,圓形或類圓形,表面光整,大多無分葉,密度均勻;(3)部分病灶可見鈣化;(4)增強掃描病灶呈中度至顯著強化及漸進性強化;(5)病灶邊緣大多有“血管貼邊征”,部分病灶邊緣見單薄的出血暈征。

