不同有機氮源對山藥-食藥用真菌“雙向發酵”的影響
許 彬,尹圣化,王振泉,李慧星,李 斌,郭書賢
(1.南陽理工學院 生物與化學工程學院,河南 南陽 473004;2.河南省工業微生物資源與發酵重點實驗室,河南 南陽 473004;3.南陽福元生態菌業有限公司,河南 南陽 473004)
山藥-食藥用真菌菌質是以山藥為培養基質,接種食藥用真菌菌種,經固態發酵后得到的菌絲、山藥基質及發酵代謝產物的混合物。在現代科技條件嚴密控制下,用有益的食藥用真菌發酵具有活性成分的中藥材,其除了能提供真菌所需營養外,同時因真菌酶的作用,分解轉化藥性基質的組織成分,使原有的成分(含活性成分)轉化,形成新成分,從而具有新的性味功能,因此發酵具有“雙向性”[1]。山藥中的淀粉、纖維素、微量元素等物質能為食藥用真菌提供營養,促進菌絲的生長代謝和抗氧化活性物質的生成[2]。同時,食藥用真菌在生長代謝過程中憑借菌絲的穿透能力、水解酶和氧化酶的酶解能力[3-5],可以解聚山藥基質的細胞結構,促進山藥中的抗氧化活性物質如山藥多糖、多酚、皂甙等[6-8]的釋放,并有可能生成新的活性物質。課題組前期研究表明,靈芝、蛹蟲草、香菇、銀耳對山藥基質具有良好的適應性,表現在這四種食藥用真菌與山藥形成的菌質在折干率、消耗率、自由基清除率方面總體上優于其他山藥-食藥用真菌菌質。這四種菌質的自由基清除能力遠高于山藥本身,且菌質提取物的高效液相色譜(high-performance liquid chromatography,HPLC)圖成分比山藥提取物的更多。因此,山藥-食藥用真菌的發酵具有“雙向性”,形成的菌質具有更高的抗氧化活性,可以開發為抗氧化食品,顯著增加山藥的附加值。
影響食藥用真菌在藥性基質上發酵的因素包括藥性成分種類、碳源種類和用量、氮源種類和用量等[2,9-11],由于山藥-食藥用真菌菌質可開發為抗氧化食品,而使用有機氮源則可以提高產品的營養價值,具有可食用性。蛋白粉可以作為食藥用真菌發酵體系中的有機氮源,顧冬艷等[12]將大豆粉作為北蟲草的發酵基質;高文庚等[13]在靈芝發酵基質中添加12%的大豆粉。氮源種類可能會影響菌絲在基質上的生長速度[14-15]、菌絲對基質的利用率、菌絲生物量[13,16]以及菌絲代謝產物和菌質的抗氧化活性[12,17-18]。
山藥是一種食藥同源食物,可以作為食藥用真菌的固態培養基質。課題組前期通過主成分分析研究得出,食藥用真菌對山藥基質適應性因子中包含了折干率、消耗率、超氧陰離子清除率、2,2-二苯基-1-苦基肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基清除率、羥基自由基清除率指標,耗時因子中包含了布滿天數指標。本研究以山藥作為培養基質分別接種發酵靈芝、蛹蟲草、香菇和銀耳四種對山藥適應性良好的食藥用真菌,以酵母浸粉、谷朊粉、花生蛋白粉、玉米蛋白粉、黃豆蛋白粉作為有機氮源,在固態條件下發酵獲得山藥-食藥用真菌菌質。實驗以上述基質適應性因子為檢測指標,通過加權評分法對各檢測指標加權,綜合評價蛋白粉對山藥-食藥用真菌“雙向發酵”適應性的影響,以確定各種山藥-食藥用真菌發酵體系中合適的有機氮源,為提高山藥-食藥用真菌發酵體系適應性提供理論支持。
1 材料與方法
1.1 材料與試劑
1.1.1 材料和菌種
馬鈴薯(產地:河南濮陽)、山藥(產地:河南焦作):南陽市佳樂福超市;酵母浸粉(蛋白質含量>60%):北京奧星生物技術公司;玉米蛋白粉(蛋白質含量>70%)、谷朊粉(蛋白質含量>75%):河南萬邦實業有限公司;花生蛋白粉(蛋白質含量>60%)、黃豆蛋白粉(蛋白質含量>60%):亳州華圣生物科技有限公司。
靈芝(Ganoderma lucidium)14025、蛹蟲草(Cordyceps militaris)14013、銀耳(Tremellafuciformis)50179、香菇(Lentinula sp.)14035:中國工業微生物菌種保藏管理中心。
1.1.2 化學試劑
葡萄糖、水楊酸、無水乙醇、硫酸亞鐵、過氧化氫、磷酸二氫鉀、硫酸鎂、三羥甲基氨基甲烷、鹽酸、連苯三酚(均為分析純):天津市科密歐化學試劑有限公司;維生素B1(生化試劑):北京酷來搏科技有限公司;瓊脂粉(生化試劑):北京奧博星生物技術有限責任公司;DPPH(分析純):合肥博美生物科技有限責任公司。
1.1.3 培養基
馬鈴薯葡萄糖瓊脂(potato dextroseagar,PDA)培養基:去皮馬鈴薯200 g,切成小塊,加水1.0 L煮沸30min,濾去馬鈴薯塊,將濾液補足至1.0 L。葡萄糖20.0 g,KH2PO43.0 g,MgSO4·7H2O 1.5g,維生素B1微量,瓊脂15.0g,pH 6.0。121℃滅菌20min。
菌質固態發酵培養基:將山藥洗凈、切碎成2~3mm左右的顆粒、自然晾干(含水量約10%)。在每個培養瓶中分裝干山藥23 g、實驗所選用的蛋白粉(酵母浸粉、玉米蛋白粉、谷朊粉、花生蛋白粉及黃豆蛋白粉)2 g、蒸餾水38m L,拌勻,浸潤2 h,得到山藥基質。將裝有山藥基質的培養瓶置于121℃滅菌30min。
1.2 儀器與設備
PHS-3C精密酸度計:上海儀電科學儀器股份有限公司;TDL-40C低速臺式大容量離心機、TG16-WS臺式高速離心機:湖南湘儀離心機儀器有限公司;TU-1901雙光束紫外可見分光光度計:北京普析通用儀器有限責任公司;0107超聲波細胞破碎機:上海冠森生物科技有限公司;FreeZoneRTriadTM2.5 L真空冷凍干燥機:美國LABCONCO有限公司;LRHS-300-Ⅱ恒溫恒濕培養箱:上海躍進醫療器械有限公司;LDZX-30FB立式滅菌器:上海申安醫療器械有限公司。
1.3 方法
1.3.1 固體平板菌種制備
挑取靈芝、蛹蟲草、香菇、銀耳的斜面菌種一塊分別接種至PDA培養基平板上,在溫度25℃、相對濕度75%條件下培養10 d,備用。
1.3.2 山藥-食藥用真菌菌質的發酵方法
將1.3.1中所得固體平板菌種切成約0.8 cm的菌塊,每個培養瓶接8塊。將接種好的山藥培養基放入溫度25℃、相對濕度75%的恒溫恒濕培養箱中,培養時間最長為20 d。以不加蛋白粉的純山藥作為空白對照。實驗重復3次。
1.3.3 菌質干燥
將發酵結束后的菌質轉移至9 cm培養皿中,鋪成1 cm的料層,置于-20℃冰箱中預凍2 h,再置于-80℃冰箱中預凍12 h。將預凍后的菌質置于真空冷凍干燥機中,分階段干燥。第一階段:設置隔板溫度-15℃,真空度30 kPa,維持5h;第二階段:設置隔板溫度-5℃,真空度30 kPa,維持5 h;第三階段:設置隔板溫度20℃,真空度8 kPa,維持20 h。
1.3.4 檢測方法
(1)菌絲布滿時間
以各食藥用真菌菌絲在純山藥培養基上的布滿天數為對照,當靈芝菌絲、蛹蟲草菌絲、香菇菌絲、銀耳菌絲在含蛋白粉的山藥培養基上蔓延生長至布滿培養基時(見圖1),記錄培養具體天數,記為該食藥用菌在培養基質上的布滿天數。菌絲在含蛋白粉的山藥培養基上的布滿天數與在純山藥培養基上的布滿天數的差異能夠反映蛋白粉對該山藥-食藥用真菌發酵體系耗時性的影響。

圖1 菌絲布滿培養基質的現象(a-側面,b-表面,c-底部)Fig.1 Phenomenon of hypha bestrewing medium(a-side,b-surface,c-bottom)
(2)折干率和消耗率
折干率反映了發酵后菌質的含水量。折干率越低,菌質的含水量越高,菌質中固相成分占比越少。基質消耗率反映了菌種對山藥基質的消耗情況,消耗率越高,說明基質被菌種分解代謝的越多。按1.3.3所述方法將菌質干燥后,采用鄔吉野[19]的方法測定折干率和消耗率,其計算公式如下:

(3)抗氧化活性測定
按1.3.3所述方法將菌質干燥后,用研缽將干燥后的菌質研成粉末狀。用無水乙醇按固液比1∶5(g∶m L),在超聲功率120W、溫度30℃條件下超聲浸提60min,將浸提混合物在4 000 r/m in條件下離心30m in,傾倒上清液,重復浸提一次,合并上清液,備用。參考文獻[20-22]測定羥基自由基(·OH)、DPPH自由基(DPPH·)及超氧陰離子自由基(O2-·)清除率。
1.3.5 數據處理和分析
(1)加權評分方法
采用加權評分法對檢測指標加權,綜合評價不同蛋白粉對山藥-食藥用真菌雙向發酵適應性的影響。根據前期研究結果,將各指標的主成分載荷絕對值(α折干率=0.503 9,α消耗率=0.491 0,αO2-·=0.483 0,αDPPH·=0.368 3,α·OH=0.365 8)所占比例轉化作為各指標加權評分的權值,即折干率權值為w1=22,消耗率權值w2=22,O2-·清除率權值w3=22,DPPH·清除率權值w4=17,·OH清除率權值w3=17,對各指標按式(3)做歸一化處理。按式(4)計算加權評分[23-24]。

式中:yjmax為第j個指標的最大觀測值;yimin為第j個指標的最小觀測值;yij為第j個指標的i個實驗處理的觀測值;zij為第j個指標的第i個實驗處理的歸一化值;wj為第j個指標的權值;Pi為第i個實驗處理的加權評分值。
(2)統計分析
利用SPSS 22.0處理實驗數據,采用Turkey HSD法對添加蛋白粉與空白各蛋白粉之間進行差異顯著性分析(顯著水平取0.05)。
2 結果與分析
2.1 菌絲布滿時間
山藥-食藥用真菌“雙向發酵”耗時以菌絲布滿山藥基質的天數來表示(按1.3.4(1)判斷)。不同氮源對山藥-食藥用真菌菌質發酵中菌絲長滿培養瓶時間的影響結果見圖2。
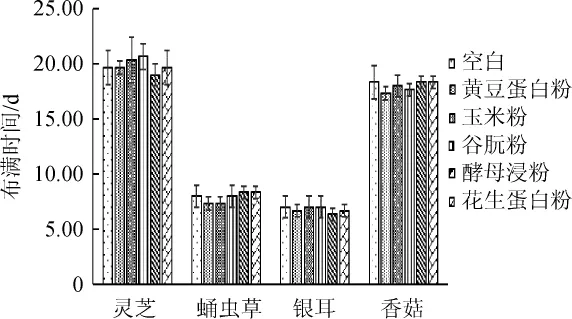
圖2 氮源對菌絲生長速率的影響Fig.2 Effect of nitrogen sources on hypha grow th rate
由圖2可知,本研究所考察的四種食藥用真菌,每種真菌在含有不同氮源的山藥基質以及純山藥基質上生長時,菌絲布滿整個培養瓶的所需時間差異均不顯著(P>0.05)。即在實驗所考察的用量下,不同氮源對山藥-食藥用真菌固態發酵的布滿時間無影響。這可能是由于氮源不能影響菌絲在培養基質表面的蔓延生長速度。
2.2 折干率和消耗率
2.2.1 折干率
不同氮源對山藥-食藥用真菌“雙向發酵”中菌質折干率的影響如圖3所示。
基質中的營養物質被分解后一部分用于合成菌體和次生代謝產物,一部分用于產生能量、水和CO2[25]。如果發酵后基質的干物質含量偏低,說明基質形成菌體的轉化率較低。各山藥-食藥用真菌體系發酵后的折干率(即干物質含量)見圖3。由圖3可知,氮源對各種山藥-食藥用真菌菌質折干率的影響差異均不顯著(P>0.05)。以山藥-靈芝體系為例,空白組菌質的折干率為(37.49±0.96)%,添加不同氮源后,山藥-靈芝菌質的最大折干率為(38.37±1.16)%(酵母浸粉),最小折干率為(36.28±0.94)%(玉米蛋白粉),菌質含水量變化不顯著(P靈芝=0.114>0.05),說明不同氮源對食藥用真菌轉化山藥基質形成菌體的轉化率影響不大,這可能是由于有機氮源結構復雜,菌絲還是主要利用山藥基質中的小分子氮源生長,因此添加了不同氮源的同一體系內,菌體對基質的轉化率是相近的,表現為折干率差異不顯著(P>0.05)。

圖3 氮源對菌質折干率的影響Fig.3 Effect of nitrogen sources on mycoplasm dry matter content
2.2.2 消耗率
不同氮源對山藥-食藥用真菌“雙向發酵”中基質消耗率的影響如圖4所示。

圖4 氮源對基質消耗率的影響Fig.4 Effect of nitrogen sources on substrate consum ing rate
由圖4可知,不同氮源對各山藥-食藥用真菌基質消耗率影響均顯著(P<0.01)。添加黃豆蛋白粉使山藥-香菇的基質消耗率顯著降低(P香菇=0.000<0.05);添加玉米蛋白粉使山藥-銀耳體系的基質消耗率顯著提高(P銀耳=0.007<0.05),山藥-香菇體系的基質消耗率顯著降低(P香菇=0.000<0.05);添加谷朊粉使山藥-靈芝和山藥-蛹蟲草體系的基質消耗率顯著降低(P靈芝=0.004<0.05,P蛹蟲草=0.000<0.05);添加花生蛋白粉使山藥-銀耳和山藥-香菇體系的基質消耗率顯著降低(P銀耳=0.008<0.05,P香菇=0.000<0.05);添加酵母浸粉山藥-靈芝、山藥-銀耳和山藥-香菇(P靈芝=0.000<0.05,P銀耳=0.005<0.05,P香菇=0.000<0.05)體系的基質消耗率顯著降低。當某一氮源的添加提高了山藥-食藥用真菌發酵體系的基質消耗率時,說明該氮源能促進菌絲對山藥基質的分解,當其添加降低了發酵體系的基質消耗率時,可能是由于蛋白粉中含有抑制菌體產生胞外酶類分解基質的物質,或者是該氮源附著于山藥基質表面,影響了菌絲對基質的分解利用。
2.3 抗氧化活性
2.3.1 超氧陰離子清除率
不同氮源對山藥-食藥用真菌菌質超氧陰離子清除率的影響如圖5所示。
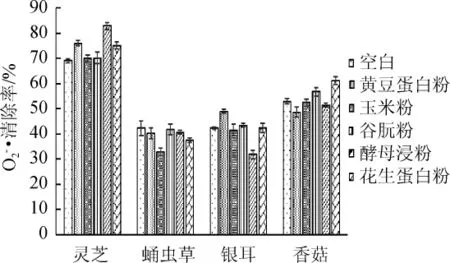
圖5 氮源對菌質提取物超氧陰離子自由基清除率的影響Fig.5 Effect of nitrogen sources on superoxide anion free radical scavenging rate ofmycoplasm extract
由圖5可知,不同氮源對山藥-食藥用真菌菌質超氧陰離子清除率影響顯著(P靈芝=0.000<0.01,P蛹蟲草=0.000<0.01,P銀耳=0.000<0.01,P香菇=0.000<0.01)。添加黃豆蛋白粉使山藥-靈芝和山藥-銀耳體系的超氧陰離子清除率顯著提高(P靈芝=0.001<0.05,P銀耳=0.001<0.05),使山藥-香菇(P香菇=0.038<0.05)體系的超氧陰離子清除率顯著降低;添加玉米蛋白粉使山藥-蛹蟲草體系的超氧陰離子清除率顯著降低(P蛹蟲草=0.000<0.05);添加谷朊粉對各體系的超氧陰離子清除率均無顯著影響(P>0.05);添加酵母浸粉使山藥-靈芝的超氧陰離子清除率顯著增加(P靈芝=0.000<0.05),使山藥-銀耳體系的超氧陰離子清除率顯著降低(P銀耳=0.005<0.05);添加花生蛋白粉使山藥-靈芝和山藥-香菇體系的超氧陰離子清除率顯著提高(P靈芝=0.003<0.05,P香菇=0.000<0.05)。
2.3.2 DPPH自由基清除率
不同氮源對山藥-食藥用真菌菌質DPPH·清除率的影響如圖6所示。
由圖6可知,蛋白粉對山藥-食藥用真菌菌質DPPH·清除率影響顯著(P靈芝=0.000<0.01,P蛹蟲草=0.000<0.01,P銀耳=0.000<0.01,P香菇=0.000<0.01)。添加黃豆蛋白粉使山藥-蛹蟲草和山藥-銀耳體系的DPPH·清除率顯著降低(P蛹蟲草=0.000<0.05,P銀耳=0.001<0.05);加玉米蛋白粉使山藥-蛹蟲草、山藥-銀耳和山藥-香菇體系的DPPH·清除率顯著降低(P蛹蟲草=0.000<0.05,P銀耳=0.001<0.05,P香菇=0.033<0.05);添加谷朊粉使山藥-靈芝、山藥-蛹蟲草和山藥-銀耳體系的DPPH·清除率顯著降低(P靈芝=0.000<0.05,P蛹蟲草=0.000<0.05,P銀耳=0.000<0.05);添加酵母浸粉使山藥-靈芝、山藥-蛹蟲草和山藥-香菇體系的DPPH·清除率顯著降低(P靈芝=0.000<0.05,P蛹蟲草=0.000<0.05,P香菇=0.000<0.05),使山藥-銀耳(P銀耳=0.005<0.05)體系的DPPH·清除率顯著降低;添加花生蛋白粉使山藥-蛹蟲草和山藥-香菇體系的DPPH·清除率顯著降低(P蛹蟲草=0.000<0.05,P香菇=0.000<0.05)。
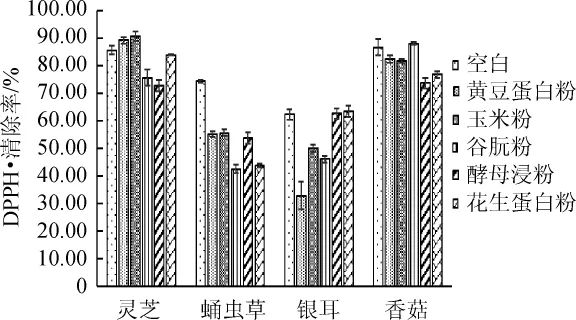
圖6 氮源對菌質提取物DPPH自由基清除率的影響Fig.6 Effect of nitrogen sources on DPPH free radicalscavenging rate ofmycoplasm extract
2.3.3 羥自由基清除率
不同氮源對山藥-食藥用真菌菌質羥自由基清除率的影響如圖7所示。

圖7 氮源對菌質提取物羥自由基清除率的影響Fig.7 Effect of nitrogen sources on hydroxyl radicalscavenging rate ofmycoplasm extract
由圖7可知,不同氮源對山藥-食藥用真菌菌質羥自由基清除率影響均極顯著(P<0.01)。添加黃豆蛋白粉使山藥-靈芝、山藥-香菇體系的羥自由基清除率顯著提高(P靈芝=0.006<0.05,P香菇=0.000<0.05),山藥-銀耳體系的羥自由基清除率顯著降低(P銀耳=0.000<0.05);加玉米蛋白粉使山藥-靈芝、山藥-蛹蟲草、山藥-銀耳和山藥-香菇體系的羥自由基清除率均顯著提高(P靈芝=0.000<0.05,P蛹蟲草=0.001<0.05,P銀耳=0.000<0.05,P香菇=0.000<0.05);添加谷朊粉使山藥-銀耳體系的羥自由基清除率顯著降低(P銀耳=0.005<0.05),使山藥-香菇體系的羥自由基清除率顯著提高(P香菇=0.005<0.05);添加酵母浸粉使山藥-蛹蟲草和山藥-銀耳體系的羥自由基清除率顯著降低(P蛹蟲草=0.000<0.05,P銀耳=0.000<0.05);添加花生蛋白粉使山藥-蛹蟲草和藥-銀耳體系的DPPH自由基清除率顯著降低(P蛹蟲草=0.002<0.05,P銀耳=0.000<0.05)。
添加氮源的山藥-食藥用真菌體系對各種自由基清除率提高,可能是由于氮源被分解成的短肽產物具有一定的抗氧化活性;對各種自由基清除率降低,可能是由于蛋白粉的添加影響了食藥用真菌代謝產生的抗氧化活性物質的產量。同一種氮源在不同的山藥-食藥用真菌發酵體系中,被真菌的酶類分解后產生的分解產物不同,且菌體吸收不同的氮源分解產物進而代謝產生的產物不同,導致添加不同氮源后山藥-食藥用真菌菌質的抗氧化活性變化趨勢不同。有研究表明,抗氧化活性物質主要通過提供電子或質子來發揮清除自由基的作用[26-27]。食藥用真菌在含有不同氮源的山藥基質上生長時,對基質成分代謝產物不同,產物的供氫或供電子的能力不同,因此最終表現為氮源對山藥-食藥用真菌菌質的抗氧化活性的影響產生差異。
2.4 各指標加權綜合評分
不同氮源對山藥-食藥用真菌“雙向發酵”適應性的綜合評分如表1所示。

表1 “雙向發酵”適應性綜合評分Table 1 Comprehensive score of'bi-directionalfermentation'adaptability
由表1可知,添加不同氮源對各山藥-食藥用真菌發酵的適應性影響各不相同。對于山藥-靈芝體系,不添加氮源的綜合評分為66.87分,添加谷朊粉在一定程度上會降低靈芝對山藥基質的適應性(65.15分),而添加其他氮源能在一定程度上提高靈芝對山藥的適應性,酵母浸粉對山藥-靈芝適應性提高程度最大(提高了11.02分)。對于山藥-蛹蟲草體系和山藥-銀耳體系,不添加氮源的綜合評分分別為52.92分和55.62分,添加各種蛋白粉均會降低菌體對山藥的適應性,最大降低幅度分別為18.81分和16.45分。對于山藥-香菇體系,不添加蛋白粉的綜合評分為35.13分,添加各種氮源均能提高香菇對山藥基質的適應性,玉米蛋白粉對山藥-香菇適應性提高程度最大(提高了28.65分)。
氮源對山藥-食藥用真菌“雙向發酵”適應性的影響是多方面的,不僅影響菌體對基質的利用情況,而且影響菌體的代謝產物,進而影響菌質對自由基的清除能力。因此對添加不同氮源的各山藥-食藥用真菌體系指標進行加權綜合評分,能夠綜合體現氮源對各山藥-食藥用真菌發酵適應性的影響。
3 結論
在山藥-食藥用真菌雙向發酵過程中添加黃豆蛋白粉、玉米蛋白粉、谷朊粉、酵母浸粉、花生蛋白粉五種氮源,對靈芝、蛹蟲草、銀耳、香菇四種食藥用真菌在山藥基質上的適應性影響各不相同。添加氮源對菌絲在山藥基質上的耗時沒有顯著影響(P>0.05),但對菌絲消耗基質以及發酵所得菌質的抗氧化活性(即山藥-食藥用真菌雙向發酵適應性)產生影響。不同氮源對各山藥-食藥用真菌菌質折干率的影響差異均不顯著(P>0.05),對每種山藥-食藥用真菌基質消耗率影響均顯著(P<0.05);對每種山藥-食藥用真菌菌質的抗氧化活性影響極顯著(P<0.01)。根據適應性的綜合評分,添加酵母浸粉使山藥-靈芝適應性提高了11.02分,提高程度最大;蛹蟲草和銀耳則因氮源的添加對山藥基質的適應性均有降低,最大降低幅度分別為18.81分和16.45分;氮源的添加對山藥-香菇適應性均有提高作用,玉米蛋白粉的提高程度最大(提高了28.65分)。根據該實驗結果,山藥-靈芝發酵體系中可以添加酵母浸粉,而山藥-蛹蟲草和山藥-銀耳的體系中不宜添加這五種氮源,山藥-香菇發酵體系中可添加玉米蛋白粉。該結論對山藥-食藥用真菌菌質抗氧化食品的研發具有一定的指導意義。

