SiO2 納米顆粒與十六烷基二甲基乙基溴化銨協同構建CO2/水乳液及其表征
朱夢雅,胡冬冬,包 磊,趙 玲,劉 濤
(華東理工大學 化學工程聯合國家重點實驗室,上海 200237)
超臨界二氧化碳作為一種替代揮發性有機溶劑的綠色溶劑[1],與水構建的微乳液即CO2/水(C/W)乳液體系[2-3]在乳液模板劑制備[4]、原油采收[5]、生物支架[6]、天然氣水合物置換開采[7]等方面具有廣泛應用。乳液的界面自由能較大,要獲得穩定的乳液必須向體系中加入乳化劑。傳統的乳化劑主要包括含氟類[8]、含硅類[9]以及少量碳氫類表面活性劑[10-11]。但它們存在價格昂貴、不易降解或構建的乳液不穩定等缺點,因此尋找一種環境友好、形成乳液穩定性高的乳化劑成為亟待解決的問題。
20 世紀初,Ramsden[12]發現固體顆粒可以構建高穩定性乳液。Worthen 等[13]利用親水型SiO2與辛酰胺丙基甜菜堿協同穩定C/W 泡沫。Zheng等[14]利用月桂基酰胺丙基甜菜堿(LAPB)與SiO2構建了內相體積分數為98%的C/W 泡沫。Guo 等[15]利用親水型SiO2或納米黏土與α-烯烴磺酸鈉及LAPB 協同穩定CO2泡沫。目前對于納米顆粒穩定C/W 乳液的研究局限于如何構建乳液,而關于水溶液中表面活性劑在顆粒表面的吸附情況及其對所構建乳液的穩定性的影響尚未深入研究。
本工作利用SiO2納米顆粒與陽離子表面活性劑十六烷基二甲基乙基溴化銨(EHDAB)協同構建了C/W 乳液,通過破乳時間、Zeta 電位、吸附等溫線、界面張力以及表觀黏度的測定研究了表面活性劑EHDAB 在SiO2顆粒表面的吸附以及所構建乳液的穩定性。
1 實驗部分
1.1 原料
高純CO2:純度99.99%(w),法國液化空氣公司;EHDAB:純度98%,阿拉丁試劑公司;納米SiO2:比表面積200 m2/g,Evonik Degussa 公司;實驗用水均為去離子水。
1.2 EHDAB/SiO2 混合分散體系的制備
配制一定濃度的EHDAB 水溶液,加入SiO2納米顆粒,利用HN-1000D 型(上海汗諾儀器有限公司)超聲分散儀在500 W 功率下超聲處理30 min,得到EHDAB/SiO2混合分散體系,超聲處理的工作時間和休息時間的間隔均設定為3 s,以避免分散體系過熱,然后將該分散體系靜置備用。
1.3 乳液制備及穩定性測試
將定量EHDAB/SiO2混合分散體系置于自主設計搭建的高壓乳化釜中(釜體積為20 mL,最大可承受壓力為40 MPa),控溫20 ℃,通過注射增壓泵緩慢注入高壓CO2至設定壓力10 MPa。通過磁力攪拌設備對乳化釜進行攪拌,直至白色的乳狀液充滿乳化釜,該乳狀液為C/W 乳液,繼續攪拌一定時間后關閉攪拌并開始計時,乳液中析出5 mL液體所需時間記為乳液半衰期。實驗構建體積比為50∶50 的C/W 乳液,穩定時間以半衰期為標準。
1.4 測試表征
將EHDAB/SiO2混合分散體系振蕩分散均勻,利用英國馬爾文儀器有限公司Nano-ZS 型激光散射儀測量分散液中SiO2納米顆粒的電位與粒徑分布,每個試樣至少測量5 次,取平均值。
將EHDAB/SiO2混合分散體系轉移至離心試管中,在10 000 r/min 的轉速下離心分離60 min,取上層清液,采用TOC-VCPN 型(日本島津有限公司)總有機碳分析儀通過有機碳譜(TOC)分析上層清液中EHDAB 的濃度,計算得到EHDAB 在SiO2顆粒表面的吸附量,每個試樣測試5 次后取平均值,測試溫度均為25 ℃。
利用Dataphysics 公司OCA 20 型張力儀通過懸滴法測定不同條件下分散體系的表面張力,測試溫度均為25 ℃,每個試樣測試5 次后取平均值。
乳液的表觀黏度采用自制的高壓落球黏度儀測量[16]。
2 結果與討論
2.1 乳液穩定性
SiO2納米顆粒質量濃度為0.1×10-2g/mL,將其與EHDAB 協同構建體積比為50∶50 的C/W 乳液。乳液半衰期隨EHDAB 含量的變化見圖1。從圖1a 可看出,隨EHDAB 含量的增大,EHDAB 構建的乳液的穩定性先增加后趨于穩定,當EHDAB含量高于0.1×10-2g/mL 時,乳液穩定性達到平臺值,其中,20 ℃時乳液的最長穩定時間為7.5 h,50℃時乳液的最長穩定時間降低至4.6 h。從圖1b 可看出,對于EHDAB/SiO2協同構建的C/W 乳液,當EHDAB 含量低于0.01×10-2g/mL 時,隨EHDAB含量的增加,乳液穩定性增加。當EHDAB 含量為0.01×10-2g/mL 時,乳液穩定性達到最佳值(此時EHDAB 與SiO2的質量濃度比為0.1),其中,20℃時的穩定時間為28 h,50 ℃的穩定時間為25 h。此后隨EHDAB 含量繼續升高,乳液穩定性反而下降。當EHDAB 含量升至0.1×10-2g/mL,乳液穩定性達到平臺值。造成這種現象的原因是由于親水型SiO2納米顆粒帶負電荷,它利用靜電吸引力吸附EHDAB,調節顆粒潤濕性構建乳液。當EHDAB含量較低時,無法形成足夠多的具有合適潤濕性的納米顆粒,此時乳液主要通過EHDAB 穩定;隨著EHDAB 含量的增大,EHDAB 的離子基由于靜電作用吸附在納米顆粒表面,疏水基朝向外側,使納米顆粒表面的疏水性增加,吸附了EHDAB 的納米顆粒更容易轉移至乳液界面,從而提高乳液穩定性;但繼續增加EHDAB 含量,EHDAB 在納米顆粒表面締合形成膠束,此時納米顆粒表面吸附雙層EHDAB,造成納米顆粒從界面脫附進入主體相,乳液又通過EHDAB 穩定,因此乳液穩定性開始降低。對比圖1a 與1b 發現,當EHDAB 含量相同時,EHDAB/SiO2構建的C/W 乳液的穩定性隨溫度的變化較小,說明該乳液具有較好的熱穩定性。
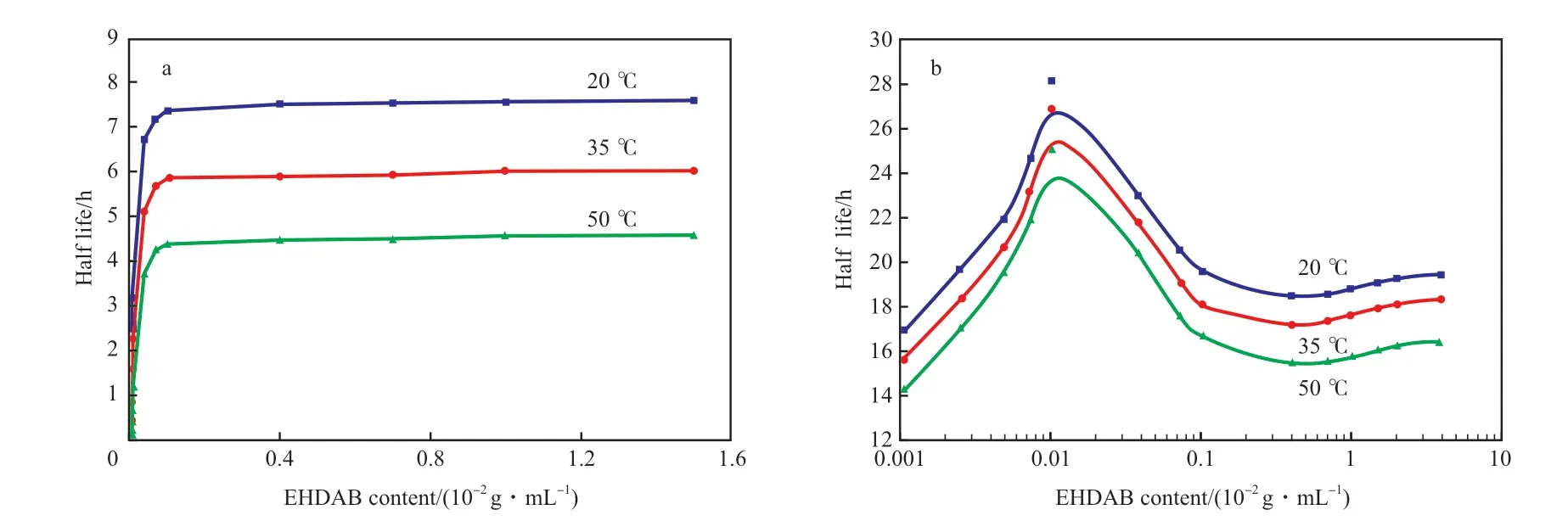
圖1 乳液半衰期隨EHDAB 含量的變化Fig.1 Half-life of emulsion changed with different EHDAB concentration.Condition:SiO2 content 0.1×10-2 g/mL.EHDAB:hexadecyl dimethyl ethyl ammonium bromide.a C/W emulsion stabilized by EHDAB;b C/W emulsion stabilized by EHDAB/SiO2
控制體系壓力10 MPa,采用0.04×10-2g/mL的EHDAB 與0.1×10-2g/mL 的SiO2協同構建C/W乳液,研究分散相體積分數和溫度對乳液穩定性的影響,結果見圖2。
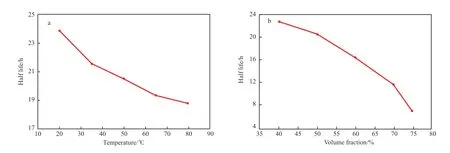
圖2 EHDAB/SiO2 構建的C/W 乳液半衰期隨溫度(a)及分散相體積分數(b)的變化Fig.2 Half-life at different temperatures(a) and dispersed phase volume fraction(b) of C/W emulsion stabilized by EHDAB/SiO2.
從圖2 可看出,隨溫度的升高,乳液穩定性降低,但降幅較小。對于由表面活性劑穩定的乳液,一方面,液滴的熱運動隨溫度的升高而加劇,運動速率的增加使得液滴間碰撞的頻率加大,加速乳液的破乳;另一方面,液滴周圍液膜中的水流失速率也受高溫影響,隨溫度升高,液滴周圍液膜黏度減小,導致水流失速率加快,進一步引起乳液的絮凝和凝聚[17],乳液穩定性變差。而對于EHDAB/SiO2構建的C/W 乳液,固體顆粒在乳液液滴表面緊密排布,形成了一層致密膜,阻隔了乳液液滴之間的碰撞聚并;同時,顆粒乳化劑吸附在液滴表面也增加了乳液液滴之間的相互斥力[18],因此,兩者共同作用使乳液的穩定性隨溫度的變化較小。從圖2b 可看出,隨分散相比的增大,即水體積的減小,形成的乳液變得不穩定。這是由于隨著分散相比的增大,乳液液滴尺寸變大,尺寸分布變寬,液滴單位表面所吸附的SiO2顆粒數目減少,促進乳液的Ostwald熟化,因此乳液穩定性降低。
2.2 SiO2 在EHDAB 溶液中的Zeta 電位與粒徑分布
SiO2在EHDAB 溶液中的Zeta 電位與粒徑分布見圖3。
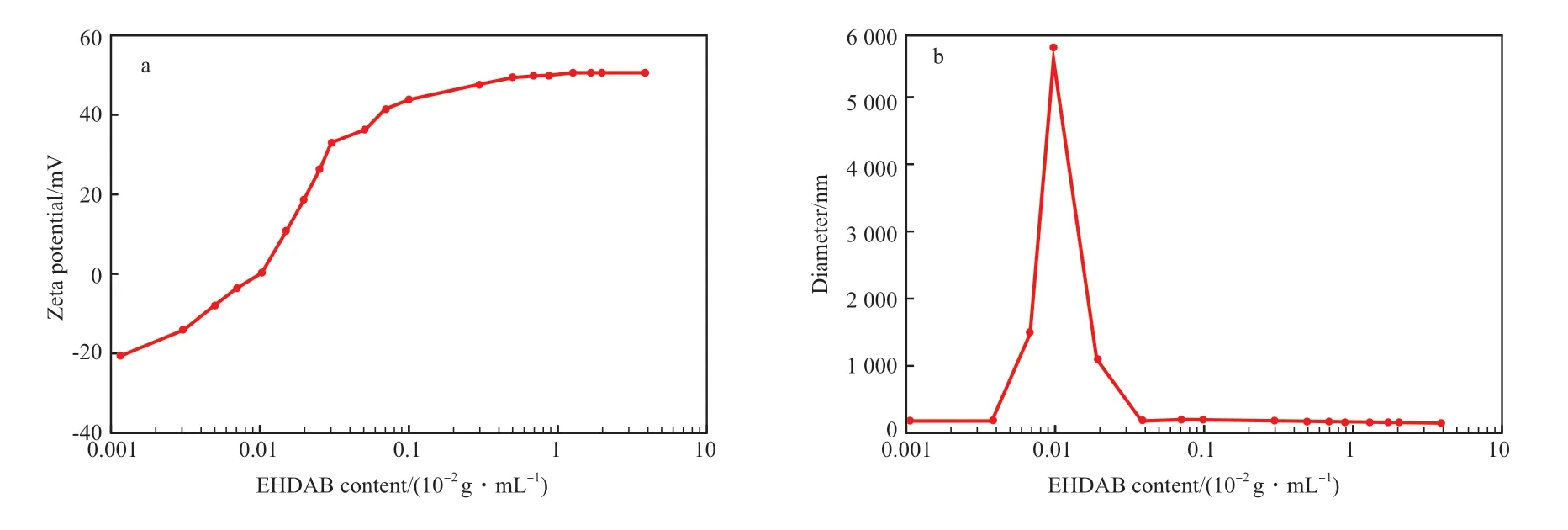
圖3 EHDAB 含量對SiO2 顆粒聚集體Zeta 電位(a)及粒徑(b)的影響Fig.3 The effect of EHDAB concentration on the Zeta potential(a) and the particles diameter(b) of SiO2 particle aggregate.Condition:SiO2 content 0.1×10-2 g/mL.
在不加入EHDAB 時,初始SiO2顆粒分散體系的Zeta 電位為-36 mV,此時顆粒可在體系中穩定分散。從圖3 可看出,在強靜電作用下,隨著EHDAB 含量的增加,分散體系的Zeta 電位迅速增加。當EHDAB 含量為0.01×10-2g/mL,SiO2納米顆粒質量濃度為0.1×10-2g/mL,即EHDAB 與SiO2的質量濃度比為0.1 時,體系到達零電位點,此時,納米顆粒表面電荷完全被所吸附的EHDAB中和,顆粒完全聚集,聚集體尺寸達到最大值。當EHDAB 含量超過0.01×10-2g/mL 時,體系的Zeta 電位隨EHDAB 含量的增大而逐漸轉為正值,顆粒重新分散。這是由于當EHDAB 含量較低時,EHDAB 通過相反電荷之間的靜電作用吸附在SiO2納米顆粒表面,降低了阻止粒子間相互緊密靠近的靜電能壘,從而促進了顆粒的凝聚,分散體的穩定性也隨之降低。進一步增加EHDAB 含量,EHDAB 又轉變為反絮凝劑,EHDAB 的雙層吸附產生了一個與EHDAB 所帶電荷相同的電勢,增加了顆粒間的靜電斥力,促使粒子再分散,分散體系重新變得穩定。
當體系到達零電位點時,乳液穩定性最高,原因在于納米顆粒表面電荷完全被所吸附的EHDAB中和,顆粒之間靜電斥力降為零,更容易吸附于C/W 乳液的界面,而且此時聚集體直徑達到最大值,吸附能也隨之增強,因此所構建的乳液最穩定。
2.3 EHDAB 在SiO2 顆粒表面的吸附量
EHDAB 在SiO2納米顆粒表面上的吸附見圖4。從圖4 可看出,EHDAB 在SiO2顆粒表面上的吸附等溫線基本呈現出兩階段吸附特征,即典型的‘S’形特征,這與雙層吸附模型相吻合。根據雙層吸附理論可知,EHDAB 在SiO2納米粒子表面的吸附主要受靜電力和疏水相互作用的控制。當EHDAB含量低于0.01×10-2g/mL 時,EHDAB 分子通過靜電作用以單個離子形式吸附在顆粒表面形成半膠束,在此階段EHDAB 吸附在納米顆粒表面,其疏水基指向主體相水溶液中,從而在納米顆粒表面形成疏水區。當EHDAB 含量高于0.01×10-2g/mL時,EHDAB 通過疏水相互作用在納米顆粒表面雙層吸附,第2 層EHDAB 分子通過疏水鏈與第1 層EHDAB 的疏水鏈締合,使親水頭指向體相溶液中。當EHDAB 含量高于0.1×10-2g/mL 時,EHDAB在納米顆粒表面的吸附達到飽和,此時吸附平衡曲線達到平臺值。
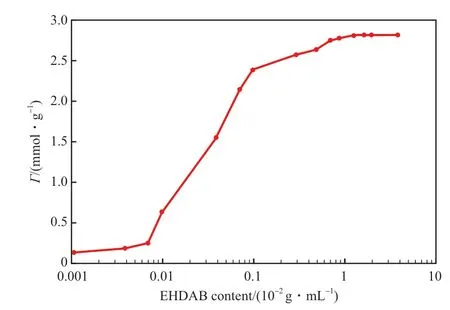
圖4 EHDAB 在SiO2 顆粒表面的吸附等溫線Fig.4 The adsorption isothermal of EHDAB on the surface of SiO2 particles.Γ:difference between the initial concentrations divided by the mass of the silica nanoparticles.
2.4 EHDAB/SiO2 分散體系的表面張力
EHDAB 在SiO2納米顆粒表面發生吸附后,體系中的EHDAB 有效濃度將會降低,因而降低表面張力的能力也會降低。EHDAB 溶液、EHDAB/SiO2分散體系及EHDAB/SiO2分散體系上清液的表面張力見圖5。
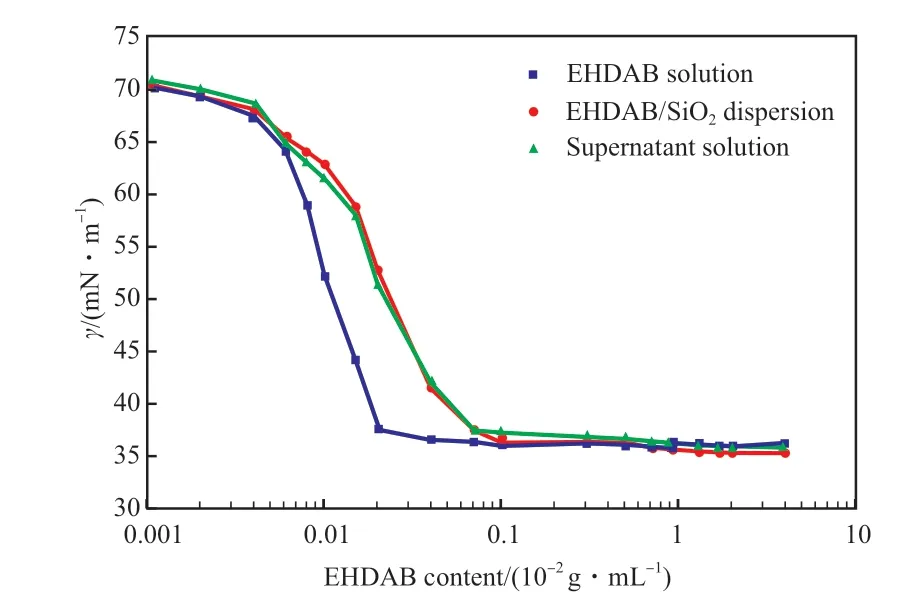
圖5 EHDAB 含量對表面張力的影響Fig.5 The effect of EHDAB concentration on the surface tension(γ).Condition:SiO2 content 0.1×10-2 g/mL.
從圖5 可看出,當EHDAB 含量較低時,SiO2納米顆粒的加入對表面張力的影響不大。隨EHDAB含量的增大,由于EHDAB 吸附在SiO2顆粒表面從而降低了它在體系中的有效濃度,因此EHDAB/SiO2分散體系的表面張力略高于EHDAB 溶液。繼續增加EHDAB 含量,EHDAB 在納米顆粒表面的吸附達到飽和,最終EHDAB 溶液與EHDAB/SiO2分散體系的表面張力相同。EHDAB/SiO2分散體系上清液與EHDAB/SiO2分散體系的表面張力曲線幾乎重合,說明SiO2納米顆粒對體系的表面張力沒有影響,體系的表面張力主要由游離的EHDAB控制。因此,對于EHDAB/SiO2構建的C/W 乳液,EHDAB 主要用于乳液的形成,SiO2納米顆粒主要用于增強乳液的穩定性。
2.5 C/W 乳液的表觀黏度
不同水溶液和乳液的表觀黏度見表1。從表1可看出,SiO2納米顆粒的加入提高了乳液的黏度,增加了乳液的穩定性,而SiO2納米顆粒的加入并不能明顯提高水溶液的黏度。固體顆粒穩定乳液的機理主要包括機械阻隔機理與三維黏彈粒子網絡機理,三維黏彈粒子網絡機理認為顆粒間相互作用形成了三維網絡結構,增加了連續相黏度,導致液滴遷移速率降低。但通過測試連續相的黏度發現,SiO2納米顆粒含量為0.1×10-2g/mL 時,連續相的黏度并沒有明顯提高,說明在連續相中還未形成三維網絡結構,因此認為在納米顆粒濃度較低的情況下,固體顆粒穩定乳液的機理主要為機械阻隔機理。

表1 不同水溶液及乳液的表觀黏度Table 1 The apparent viscosity of different aqueous solutions and C/W emulsions
3 結論
1)EHDAB/SiO2構建的乳液的穩定性比EHDAB 構建的乳液顯著提高。對于EHDAB/SiO2構建的乳液,隨EHDAB 含量的增加,乳液穩定性先增加后降低,然后趨于穩定,而且穩定性隨溫度變化較小。
2)EHDAB 與SiO2的質量濃度比為0.1 時,體系到達零電位點,聚集體直徑達到最大值,EHDAB/SiO2構建的乳液穩定性最高。
3)當SiO2納米顆粒濃度較低時,SiO2納米顆粒與EHDAB 協同構建乳液,EHDAB 主要用于乳液的形成,SiO2納米顆粒則用于增強乳液的穩定性,固體顆粒穩定乳液的機理主要為機械阻隔機理。

掃碼了解更多相關
專題研究信息

