基于網絡藥理學的黃芪和三七主要有效成分配伍抗缺血性腦損傷作用機制研究
唐標 唐文靜 鄧常清
摘要:目的? 采用網絡藥理學方法探討黃芪和三七主要有效成分配伍抗缺血性腦損傷作用機制,為成分篩選提供參考。方法? 文獻檢索結合前期研究確定黃芪和三七抗缺血性腦損傷主要有效成分,通過DRAR-CPI數據庫預測有效成分作用靶點,多數據庫聯合檢索腦缺血相關疾病靶點。采用Cytoscape3.2.1軟件構建有效成分-靶點網絡、作用靶點蛋白相互作用(PPI)網絡及疾病靶點PPI網絡,交叉融合并篩選核心靶點。利用DAVID數據庫對核心靶點進行生物過程和信號通路富集分析。結果? 篩選出的194個核心靶點主要關聯腦缺血凋亡、自噬、神經營養因子的保護作用、血管新生及炎癥反應等多個過程。此外,靶點參與了腦缺血中PI3K-Akt信號通路、MAPK信號通路、神經營養因子信號通路、血管新生途徑及多種炎癥反應途徑。結論? 上述生物過程和通路介導了黃芪和三七主要有效成分抗缺血性腦損傷的潛在機制,可為成分篩選提供參考。
關鍵詞:黃芪;三七;腦缺血;網絡藥理學;靶點;信號通路
中圖分類號:R277.73;R285??? 文獻標識碼:A??? 文章編號:1005-5304(2019)07-0109-05
Abstract: Objective To discuss the mechanism of compatibility of main active components of Astragali Radix and Notoginseng Radix et Rhizoma on cerebral ischemic injury through network pharmacology. Methods Main active components of Astragali Radix and Notoginseng Radix et Rhizoma for the treatment of cerebral ischemic injury were determined through literature search combined with preliminary experimental research. Through the DRAR-CPI database, main active components were predicted and collected, and the targets were associated with cerebral ischemia. In addition, targets for cerebral ischemia-related diseases were retrieved and collected by multiple data bases. Cytoscape 3.2.1 software was used to construct the active component-target network, target protein-protein interaction network and disease-related target protein-protein interaction network, and the two protein networkswere under cross-fusion and screening. The DAVID database was used to analyze the biological processes and pathways of core targets to predict the mechanism of action. Results The screened 194 core targets showed that the targets were associated with apoptosis, autophagy, neurotrophic factor protection, angiogenesis and inflammatory response. Furthermore, the targets were involved in PI3K-Akt signaling pathway, MAPK signaling pathway, neurotrophin signaling pathway, angiogenesis pathway, inflammatory response pathway of cerebral ischemia. Conclusion These biological processes and pathways mediated the underlying mechanisms of the main active components of Astragali Radix and Notoginseng Radix et Rhizoma against cerebral ischemic injury.
Keywords: Astragali Radix; Notoginseng Radix et Rhizoma; cerebral ischemia; network pharmacology; targets; signaling pathways
臨床上,腦卒中以缺血性腦卒中最為常見。黃芪和三七是治療心腦血管疾病的常用有效中藥,黃芪具有補氣升陽作用,三七具有活血散瘀、消腫定痛功效,二者常配伍使用。實驗研究表明,黃芪甲苷是黃芪中具有心腦血管效應的主要藥效組分,三七總皂苷是三七中具有心腦血管效應的主要藥效組分,主要含人參皂苷Rb1、人參皂苷Rg1、和三七皂苷R1,黃芪甲苷和三七總皂苷均有明顯改善腦缺血損傷作用[1-2]。前期研究我們采用中藥組分配伍模式,研究了黃芪甲苷與三七中的人參皂苷Rb1、人參皂苷Rg1和三七皂苷R1配伍的協同增效作用,發現配伍后可通過腦缺血后的多個病理生理環節,協同對抗缺血性腦損傷[3-7]。為進一步揭示黃芪和三七主要有效成分配伍協同抗腦缺血損傷作用機制,本研究采用網絡藥理方法,從分子作用網絡探討黃芪和三七有效成分配伍抗缺血性腦損傷作用靶點及其關聯通路,為成分篩選提供參考。
1? 資料與方法
1.1? 主要有效成分選擇
結合文獻報道和課題組前期研究,選擇黃芪和三七中具有抗缺血性腦損傷作用的主要有效成分黃芪甲苷、人參皂苷Rb1、人參皂苷Rg1、三七皂苷R1為網絡藥理學分析的候選有效成分,通過Pub Chem(有機小分子生物活性數據庫,http://pubchem.ncbi. nlm.nih.gov)檢索有效成分,收集結構和相關信息,建立有效成分數據集。
1.2? 有效成分作用靶點預測與疾病靶點收集
DRAR-CPI數據庫是以CPI(chemical-protein interactome)為方法學的預測數據庫,以小分子為研究對象,基本涵蓋全部上市藥物和全部的人類可藥性蛋白,得到一系列靶藥結合強度的矩陣并形成一個結合譜,用于尋找小分子和FDA所批準藥物間的相似性,進而挖掘“藥物-藥靶”關系,數據庫通過計算輸入化合物與數據庫蛋白的對接情況,預測能與化合物相互作用的靶蛋白。通過DRAR-CPI數據庫(https://cpi.bio-x.cn/drar/)基于反向分子對接方法預測有效成分的作用靶點,在線輸入分子結構后收集和建立作用靶點數據集。將預測到的作用靶點輸入DAVID數據庫(https://david.ncifcrf.gov/),通過輸入靶基因名稱列表并限定物種為人,并將所有靶基因名稱校正為其官方名稱,設定閾值P<0.05進行GO生物學過程富集初步分析和KEGG代謝通路富集初步分析,分析作用靶點的潛在作用。通過TTD(http:// bidd.nus.edu.sg/group/cjttd/)、Drugbank(https://www. drugbank.ca/)、OMIM(http://www.omim.org/)、CTD(http://ctdbase.org/)聯合檢索腦缺血疾病相關靶點,檢索詞為“Brain Ischemia”或“Cerebral Infarction”或“Hypoxia- Ischemia, Brain”或“Cerebral ischemia”,其中TTD數據檢索到18個靶點,Drugbank數據庫檢索到12個靶點,OMIM數據庫檢索到82個靶點,CTD數據庫檢索到有實驗驗證的靶點95個。去除重復靶點,導入Uniprot(http:// www.Uniprot.org/),通過輸入靶基因名稱列表并限定物種為人,剔除非人源靶點,并將所有靶基因名稱校正為其官方名稱,建立疾病相關靶點數據集。
1.3? 網絡構建與分析
采用Cytoscape3.2.1軟件構建有效成分-作用靶點網絡。利用Cytoscape插件Bisogenet3.0.0,根據Bisogenet中的蛋白相互作用(PPI)數據庫構建作用靶點PPI網絡和疾病靶點PPI網絡,輸入靶基因名稱列表并限定物種為人,數據設置選擇蛋白與蛋白的相互作用,方法選擇輸入所有節點和所有的鄰居,輸出選擇基因。網絡中各節點的拓撲學特征通過Cytoscape的插件CytoNCA計算參數來評價,參數分別為度中心性(DC)、中間中心性(BC)、接近中心性(CC),這3個參數是網絡藥理學研究中評價網絡節點重要性的核心參數,值越大說明節點在網絡中越接近網絡中心位置。參照文獻[8]篩選方法,以DC、BC和CC對網絡進行評價和篩選。
1.4? 靶點的生物過程和通路富集分析
基因富集分析是指將基因按照先驗知識,按照基因組注釋信息進行分類。采用DAVID數據庫對篩選出的核心靶點進行基因的生物學過程和代謝通路的初步富集分析[9]。通過基因的富集分析預測有效成分配伍抗缺血性腦損傷的可能機制。
2? 結果
2.1? 靶點預測與收集
通過DRAR-CPI數據庫預測4種有效成分靶點,共收集到80個靶點,其中黃芪甲苷的作用靶點66個,人參皂苷Rb1作用靶點5個,人參皂苷Rg1的作用靶點34個,三七皂苷R1的作用靶點24個。利用DAVID數據庫對作用靶點進行基因的生物學過程和代謝通路的初步富集分析,結果表明,靶點參與的主要生物過程中凋亡的調控(10個,13.5%)和氧化還原反應(9個基因,12.1%)為缺血性腦損傷的核心過程。另外預測靶點主要參與的與腦缺血有關的通路為代謝通路、MAPK信號通路、神經營養因子信號通路、cAMP信號通路、mTOR信號通路、TNF信號通路、Toll樣受體信號通路、AMPK信號通路及凋亡途徑。富集分析結果表明,預測靶點與腦缺血密切關聯,有潛在抗缺血性腦損傷作用。此外,通過多數據聯合關鍵詞檢索的方式檢索到腦缺血疾病相關靶點,包括TTD數據庫18個、Drugbank數據庫12個、OMIM數據庫82個,CTD數據庫檢索到有實驗驗證的95個靶點。剔重后得到腦缺血相關靶點199個。
2.2? 網絡構建與分析
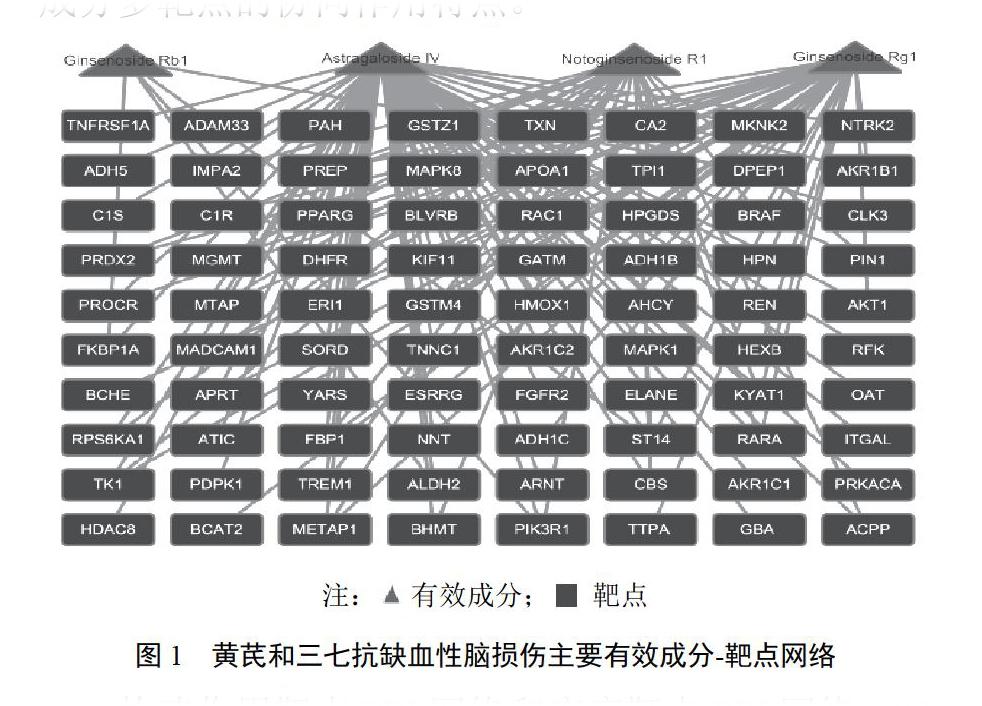
構建的有效成分-作用靶點網絡包含84個節點、129條邊,見圖1。可見1個活性成分可作用于多個靶點,多個活性成分可作用于同一靶點,體現了有效成分多靶點的協同作用特點。
構建作用靶點PPI網絡和疾病靶點PPI網絡。80個作用靶點生成的PPI網絡包含2963個節點、64 362條邊。199個疾病靶點生成的PPI網絡包含4348個節點、102 093條邊。采用Cytoscape的融合工具對2個PPI網絡進行交叉融合,篩選共有網絡,得到的共有網絡包含1723個節點、43 979條邊。采用CytoNCA計算網絡的DC、BC和CC值并進行2次篩選。第一次以DC>68(2倍中位數)作為篩選指標,得到的初篩網絡包含410個節點、15 215條邊。采用DC>66.5、BC>0.001 22、CC>0.543 161進行第二次篩選,得到的核心網絡包含194個節點、6105條邊,194個靶點即為黃芪和三七主要有效成分配伍抗缺血性腦損傷的核心靶點。
2.3? 靶點生物過程和通路富集分析
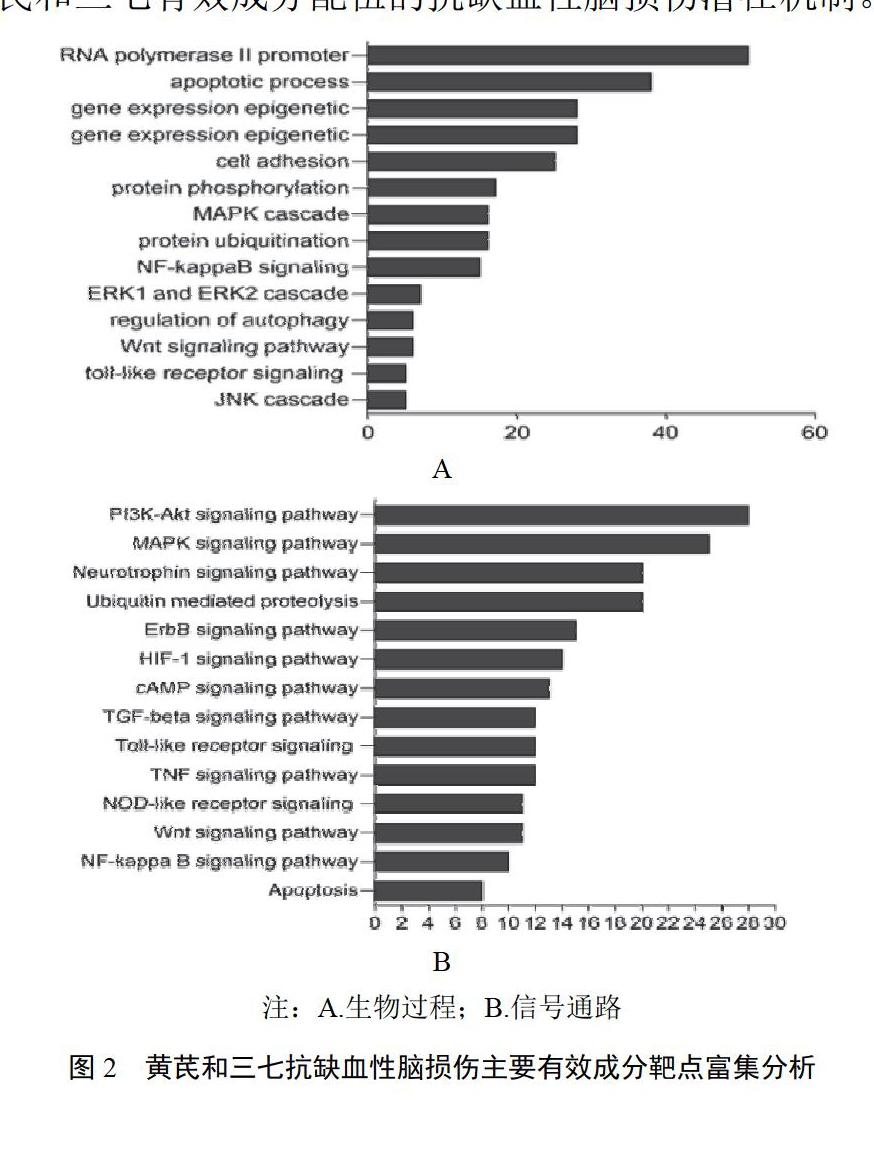
初步富集分析結果表明,靶點參與的生物過程為RNA聚合酶Ⅱ啟動子的調控、凋亡的調控、基因表達、細胞黏附、蛋白磷酸化調控、蛋白泛素化調控、MAPK復合物調控、NF-κB信號通路調控、ERK1和ERK2復合物調控、自噬調控、Wnt信號通路調控、Toll樣受體信號通路調控、JNK復合物調控(見圖2A)。其中凋亡、自噬均為腦缺血損傷的關鍵過程[10],MAPK、ERK、Wnt、Toll樣受體和NF-κB信號通路為腦缺血損傷中的關鍵通路[11]。此外,靶點主要參與了PI3K-Akt信號通路、MAPK信號通路、神經營養因子信號通路、泛素介導的蛋白質降解通路、ErbB信號通路、HIF-1信號通路、cAMP信號通路、TGF-β信號通路、Toll樣受體信號通路、NOD樣受體信號通路、Wnt信號通路、NF-κB信號通路和凋亡途徑(見圖2B)。通路富集具體結果見表1。在這些通路中,PI3K-Akt信號通路和MAPK信號通路為腦缺血的核心通路,可調控腦缺血的多個過程,如氧化應激、自噬、凋亡、炎癥反應[12];神經營養因子信號通路和ErbB信號通路主要調節神經營養因子對腦缺血的保護作用[13];TGF-β信號通路有抗氧化、阻止細胞凋亡、促進腦缺血組織修復的多種作用;Toll樣受體信號通路、NOD樣受體信號通路和NF-κB信號通路為腦缺血中重要炎癥反應通路[14];HIF-1信號通路和Wnt信號通路主要調節腦缺血中血管新生[15]。綜合富集分析結果,預測黃芪和三七有效成分配伍抗缺血性腦損傷的機制主要為:①黃芪和三七有效成分配伍通過調控包括凋亡和自噬在內的多種細胞死亡方式、神經營養因子的保護作用、血管新生、炎癥反應發揮對缺血性腦損傷的保護作用;②PI3K-Akt信號通路、MAPK信號通路、神經營養因子信號通路、血管新生途徑,以及包括Toll樣受體信號通路、NOD樣受體信號通路和NF-κB信號通路在內的炎癥反應途徑介導了黃芪和三七有效成分配伍的抗缺血性腦損傷潛在機制。
3? 討論
網絡藥理學整合了系統生物學、計算生物學、多向量藥理學、網絡分析等學科技術,從整體角度揭示藥物與疾病的關聯,為中藥作用的多靶點、多途徑效應提供了可量化數據,廣泛應用于單味藥多成分或復方作用機制及有效成分配伍研究。
本研究采用網絡藥理學方法對黃芪和三七的4種有效成分進行靶點預測,共收集到80個作用靶點,靶點的初步富集分析表明靶點與腦缺血密切關聯,且在有效成分和作用靶點的對應中,存在1種有效成分對應多靶點、同一靶點對應多種有效成分的現象,體現了黃芪和三七有效成分配伍的多靶點協同作用機制,在一定程度上揭示了二者配伍的科學內涵。此外,通過多數據庫聯合檢索收集到腦缺血的199個疾病靶點,采用Bisogenet構建作用靶點PPI網絡和疾病靶點PPI網絡,并對2個網絡進行交叉融合篩選出共有網絡,進一步采用網絡藥理學篩選方法對共有網絡進行兩次篩選,篩選出核心網絡,得到黃芪和三七有效成分配伍抗腦缺血的194個核心靶點。利用DAVID數據庫對核心靶點進行基因的生物學過程和代謝通路的初步富集分析,通過文獻檢索分析結果與腦缺血的關聯性,預測黃芪和三七有效成分配伍抗缺血性腦損傷的可能機制主要為:①調控腦缺血中包括凋亡和自噬在內的多種細胞死亡方式、神經營養因子的保護作用、血管新生、炎癥反應;②調控腦缺血中的PI3K-Akt信號通路、MAPK信號通路、神經營養因子信號通路、血管新生途徑及多種炎癥反應途徑。
目前認為,缺血性腦損傷的病理機制復雜,涉及多種生物活性分子及細胞內信號轉導通路,如活性氧大爆發、一氧化氮生物利用率減少、細胞內鈣超載、炎癥、細胞凋亡及自噬等。前期研究表明,黃芪和三七主要有效成分配伍可通過NF-κB信號通路抑制炎癥和凋亡[5],通過PI3KⅠ/Akt/mTOR通路調控腦缺血自噬過程[16],這與預測結果相符,為本研究預測機制提供了數據參考,也表明預測結果較準確。此外,預測結果表明,炎癥反應調控是預測機制的核心,而炎癥反應在腦缺血的發生發展中也起到重要作用,炎癥反應參與腦缺血的病理生理學過程,并在腦缺血中起“雙刃劍”作用,在缺血早期加重缺血性腦損傷,又參與組織的修復和再生。研究表明,腦缺血中神經元和膠質細胞死亡的炎癥機制,主要是NOD樣受體信號通路中的炎癥小體介導,且炎癥小體通路接受NF-κB和MAPK通路的調控,實驗研究表明,在腦缺血中,炎癥小體各組成蛋白表達增加,炎癥小體活化產物Caspase-1、白細胞介素-1β和白細胞介素-18水平升高,且NF-κB和MAPK通路介導腦缺血中炎癥小體的活化,抑制NF-κB和MAPK通路及炎癥小體均可減少腦缺血損傷[17-18]。腦缺血中NF-κB和MAPK通路介導的炎癥小體活化可能為黃芪和三七主要有效成分配伍抗腦缺血損傷的重要機制。但黃芪和三七主要有效成分配伍對腦缺血中核心過程和通路的調節作用,還需進一步實驗研究驗證。
綜上,基于網絡藥理學分析黃芪和三七有效成分配伍抗缺血性腦損傷的作用機制,預測了核心靶點及其可能的作用機制,初步揭示了黃芪和三七有效成分配伍抗缺血性腦損傷的多靶點-多途徑作用特點,可為進一步深入研究其作用機制及成分篩選提供參考。
參考文獻:
[1] WANG H L, ZHOU Q H, XU M B, et al. Astragaloside Ⅳ for experimental focal cerebral ischemia:preclinical evidence and possible mechanisms[J]. Oxid Med Cell Longev,2017,2017:8424326.
[2] SON H Y, HAN H S, JUNG H W, et al. Panax notoginseng attenuates the infarct volume in rat ischemic brain and the inflammatory response of microglia[J]. J Pharmacol Sci,2009,109:368-379.
[3] 譚華,黃小平,陳北陽,等.黃芪總苷和三七總皂苷配伍對小鼠腦缺血再灌注腦組織氧化應激的影響[J].中西醫結合學報,2010,8(5):448-451.
[4] 黃小平,譚華,陳北陽,等.黃芪總苷和三七總皂苷配伍對腦缺血再灌注后MMP-9和TIMP-1表達的影響[J].中國中藥雜志,2010,35(16):2187-2191.
[5] 黃小平,鄧常清,邱詠園,等.黃芪甲苷和三七的三種有效成分配伍對小鼠腦缺血再灌注后氧化應激和Nrf2/HO-1途徑的影響[J].中國藥理學通報,2013,29(11):1596-1601.
[6] HUANG X P, QIU Y Y, WANG B, et al. Effects of astragaloside Ⅳ combined with the active components of panax notoginseng on oxidative stress injury and nuclear factor-erythroid 2-related factor 2/heme oxygenase-1 signaling pathway after cerebral ischemia-reperfusion in mice[J]. Pharmacogn Mag,2014,10:402- 409.
[7] HUANG X P, DING H, LU J D, et al. Effects of the combination of the main active components of astragalus and panax notoginseng on inflammation and apoptosis of nerve cell after cerebral ischemia-reperfusion[J]. Am J Chin Med,2015,43:1419-1438.
[8] WANG S, WANG H, LU Y. Tianfoshen oral liquid:a CFDA approved clinical traditional Chinese medicine, normalizes major cellular pathways disordered during colorectal carcinogenesis[J]. Oncotarget,2017,8:14549-14569.
[9] DENNIS G, SHERMAN B T, HOSACK D A, et al. DAVID:database for annotation, visualization, and integrated discovery[J]. Genome Biol,2003,4:R60.
[10] YANG Y, GAO K, HU Z, et al. Autophagy upregulation and apoptosis downregulation in DAHP and triptolide treated cerebral ischemia[J]. Mediators Inflamm,2015,2015:120198.
[11] LIU M, TANG L, LIU X, et al. An evidence-based review of related metabolites and metabolic network research on cerebral ischemia[J]. Oxid Med Cell Longev,2016,2016:9162074.
[12] ZHOU J, DU T, LI B, et al. Crosstalk between MAPK/ERK and PI3K/AKT signal pathways during brain ischemia/reperfusion[J]. ASN Neuro,2015,7:1759091415602463.
[13] TONCHEV A B. Brain ischemia, neurogenesis, and neurotrophic receptor expression in primates[J]. Arch Ital Biol,2011,149:225-231.
[14] VIDALE S, CONSOLI A, ARNABOLDI M, et al. Postischemic inflammation in acute stroke[J]. J Clin Neurol,2017,13:1-9.
[15] WU C, CHEN J, CHEN C, et al. Wnt/β-catenin coupled with HIF-1α/VEGF signaling pathways involved in galangin neurovascular unit protection from focal cerebral ischemia[J]. Sci Rep,2015,5:16151.
[16] HUANG X P, DING H, YANG X Q, et al. Synergism and mechanism of astragaloside Ⅳ combined with ginsenoside Rg1 against autophagic injury of PC12 cells induced by oxygen glucose deprivation/reoxygenation[J]. Biomed Pharmacother,2017,89:124- 134.
[17] FANN D Y, SANTRO T, MANZANERO S, et al. Intermittent fasting attenuates inflammasome activity in ischemic stroke[J]. Exp Neurol,2014,257:114-119.
[18] FANN D Y, LIM Y A, CHENG Y L, et al. Evidence that NF-κB and MAPK signaling promotes NLRP inflammasome activation in neurons following ischemic stroke[J]. Mol Neurobiol,2018,55(2):1082- 1096.

