達氏鱘dmc1基因的克隆及在精子生成中的表達分析
向 浩,葉 歡,李創舉,楊俊琳,3,厲 萍,杜 浩,危起偉
(1.華中農業大學水產學院,湖北武漢 430070;2.中國水產科學研究院長江水產研究所,農業部淡水生物多樣性保護重點實驗室,湖北武漢 430223;3.中國科學院水生生物研究所,湖北武漢 430072)
Dmc1最早發現于酵母中,是大腸桿菌(Escherichia coli)RecA 蛋 白 的 同 源 蛋 白[1]。RecA蛋白的另一個同源蛋白Rad51除了在減數分裂中起重要作用外,還參與有絲分裂重組DNA的修復。Dmc1蛋白和Rad51蛋白共同定位于減數分裂前期Ⅰ的偶線期,為同源染色體配對和交叉重組所必需[2]。1996年發現Dmc1蛋白是哺乳動物細胞減數分裂特異的重組蛋白,僅在哺乳動物處于減數分裂過程的生殖細胞中表達。人的Dmc1蛋白與酵母的Dmc1蛋白的同源性為54%,存在大腸桿菌RecA蛋白家族中保守的第二結構域部分,包括兩個ATP結合位點和兩個DNA結合區[3],表明Dmc1蛋白在進化過程中是高度保守的,同時也反映了Dmc1蛋白結構上的穩定性對生物體功能的重要性。
減數分裂中,染色體的正常分離依賴于合線期同源染色體精確配對形成的二價體,而同源重組和聯會復合體是影響同源染色體配對的主要因素[4-5]。在酵母菌 (Saccharomyces cerevisiae)中,一些減數分裂必需或特異基因如dmc1、rad51和hop1已被克隆[6-8]。研究發現,酵母dmc1基因的突變和敲除都會使減數分裂停滯在偶線期,導致同源染色體聯會失敗,減數分裂細胞內積聚大量的雙鏈斷裂(DSB)重組中間體[9],表明dmc1在減數分裂的同源染色體配對和交叉重組中起著重要的作用[10]。近年來,不同倍性鯽鯉(Carassius auratus×Cyprinus carpio)[11]、日本鰻鱺 (Anguilla japonica)[12]、 蠑 螈 (Cynops orientalis)[13]、牦牛(Bos grunniens)和犏牛(Bos grunniens × Bos taurus)[14]、小 鼠 (Mus musculus)[3,6]、人(Homo sapiens)[3,6,15]等物種中克隆得到 dmc1的同源基因,而有關達氏鱘(Acipenser dabryanus)dmc1基因的研究尚未見報道。小鼠dmc1基因在減數分裂Ⅰ細線期到偶線期中特異表達,為同源染色體聯會配對所必需。若dmc1突變或者被敲除,會導致減數分裂停滯在偶線期,不會出現同源染色體聯會或在少數非同源染色體之間出現聯會異常[16];另外,犏牛睪丸組織dmc1基因低水平表達所表現出的減數分裂障礙與小鼠dmc1基因突變和敲除的表型一致,表明睪丸組織dmc1基因的低表達可能與犏牛的雄性不育有一定的關系,進一步說明dmc1在哺乳動物細胞減數分裂的同源重組過程中起著重要的作用[14]。蠑螈dmc1基因在前細線期高水平表達,并一直持續到精子生成階段[13]。日本鰻鱺中發現dmc1基因僅在減數分裂Ⅰ的早期表達[12],并一直持續到粗線期,但其表達量逐漸減少。在不同倍性鯽鯉中,dmc1基因也只在其早期卵巢或者精巢中特異表達[11],顯示dmc1基因在減數分裂過程中的功能保守性。
鱘魚類是現存最早的脊椎動物之一,已生存超過2億年,具有重要的進化地位。達氏鱘隸屬鱘形目(Acipenseriformes),鱘科(Acipenseridae),鱘屬,又名沙臘子、長江鱘,純淡水定居性魚類,是長江珍稀瀕危魚類,為國家一級保護動物,對其開展種質資源保護研究具有重要意義。目前有關達氏鱘的研究主要集中在生物形態學[17-18]、種群生態學[19-20]、遺傳學及物種鑒定方面[21]。達氏鱘生殖發育相關分子研究進行了dead end[22]、vasa[23]基因的表達特征和功能分析。本研究利用PCR技術克隆得到達氏鱘dmc1基因的編碼區序列,利用生物信息學方法分析達氏鱘dmc1基因編碼區特征和系統進化關系;并采用RT-PCR分析達氏鱘dmc1基因在其不同組織和不同發育時期精巢的表達特征,以期獲得達氏鱘減數分裂特異標記基因,為達氏鱘初級和次級精母細胞的鑒定提供參考。
1 材料與方法
1.1 實驗用魚及樣品
實驗用魚為全人工繁殖1~3齡的子二代達氏鱘,來自中國水產科學研究院長江水產研究所荊州太湖試驗場。分別取試驗魚心、肝、脾、腎、鰓、腸、垂體、下丘腦、精巢和卵巢等組織,在液氮中速凍后,置于-80℃冰箱保存備用。對于不同發育時期的精巢組織,取一部分用Bouin’s試液固定12~16 h后,置于70%乙醇中4℃保存。
1.2 達氏鱘精巢不同發育時期組織學染色
不同發育時期的達氏鱘精巢組織在Bouin’s試液中固定后經酒精脫水、二甲苯透明,石蠟包埋切片,切片的厚度為4μm;用蘇木精-伊紅染色法染色(Carazzi蘇木精、0.2%伊紅水溶液),中性樹膠封片。正置熒光顯微鏡(DM5000B,Leica)觀察并拍照。
1.3 RNA提取及cDNA的制備
使用 RNeasy Plus Mini Kit(Qiagen,Cat No.74134)試劑盒提取各種組織的總RNA,RNA濃度和純度用核酸測定儀(Nanodrop 2000)測定,并用DNaseⅠ(TaKaRa)消化處理總RNA以消除基因組DNA的殘留,最后1.5%瓊脂糖凝膠電泳檢測其完整性。采用 PrimeScript?RT reagent Kit With gDNA Eraser(TaKaRa,Cat No.RR047A)試劑盒合成cDNA第一鏈,操作按照說明書進行。合成的cDNA于-20℃保存備用,用于后續編碼區序列克隆和熒光定量PCR分析。
1.4 達氏鱘dmc1基因編碼區序列的獲得
根據達氏鱘性腺轉錄組數據庫序列設計上、下游引物Dmc1-Fw和Dmc1-Rv(表1),以上述反轉錄獲取的精巢cDNA為模板,擴增出dmc1基因的編碼區序列。PCR擴增體系為25μL:上游引物0.5μL,下游引物0.5μL,模板cDNA 1μL,10×PCR Buffer:2.5μL,MgCl2:2.0μL,dNTP:0.5 μL,Taq酶:0.5μL,ddH2O:18.0μL。擴增條件為:94℃變性4 min;94℃ 30 s,54℃ 30 s,72℃1 min 30 s,38 cycles;72℃延伸 10 min。PCR反應產物用1.5%瓊脂糖凝膠電泳鑒定并回收純化目的片段,然后克隆到pMD19-T載體上,16℃連接過夜。連接產物轉化 Trans5α大腸桿菌(Escherichia coli),經 Ampicillin抗性篩選,挑取陽性菌落,擴大培養后進行菌液PCR鑒定,并由上海生工生物工程股份有限公司進行測序。
1.5 Dm c1序列分析及系統進化樹構建
將測序所得核苷酸序列在NCBI中BLAST進行同源性比對,使用ORF Finder確定開放閱讀框,并推導其相應的氨基酸序列;利用TMHMMServer 2.0對蛋白的跨膜區域進行預測;使用 Signal P 4.1 Server預測信號肽;ExPASy ProtParam對所推測的蛋白質基本物理化學參數進行分析;采用CLUSTAL X軟件對核苷酸和氨基酸序列進行同源性的比對分析;利用MEGA 7.0軟件中Neighbor-joining方法進行系統進化分析,并進行1 000次自展檢驗(Bootstrap)評估進化樹分支可信度。
1.6 達氏鱘dmc1基因的組織表達特征分析
為分析dmc1基因在2齡達氏鱘雌、雄個體不同組織的表達特征,以各種組織cDNA為模板,用dmc1基因特異引物Dmc1-F1和Dmc1-R1(表1)進行RT-PCR檢測,以β-actin為內參。反應體系:1μL cDNA為模板,上游、下游引物各0.5 μL,10×PCR Buffer:2.5μL,MgCl2:2.0μL,dNTP:0.5μL,Taq酶:0.5μL,ddH2O:18μL。擴增條件為:94℃預變性4 min;94℃ 變性30 s,54℃ 復性30 s,72℃延伸20 s,反應進行35個循環,最后72℃延伸10 min。擴增產物使用1.5%的瓊脂糖凝膠電泳檢測。
1.7 達氏鱘dmc1基因在不同發育時期精巢的表達分析
為驗證設計的定量PCR引物Ad Dmc1-qRT-F和Ad Dmc1-qRT-R(表1)的可行性,以達氏鱘精巢cDNA為模板,用ddH2O做連續10倍梯度稀釋,5個濃度梯度,從1到1∶1×104,每個梯度設置3個重復,進行熒光定量PCR來建立標準曲線。20μL熒光定量PCR體系:模板1μL,熒光定量PCR上、下游引物各0.4μL,2×PowerUpTMSYBR?Green Master Mix 10μL,ddH2O 8.5μL。PCR反應程序:95℃預變性2 min;95℃變性15 s,57℃退火 15 s,72℃延伸 15 s,讀板溫度 77℃,讀板時間5 s;40次循環,做熔解曲線分析溫度為60~95℃。根據熒光值的變化規律,系統將自動生成標準曲線和熔解曲線。
以上述逆轉錄獲得的達氏鱘不同發育時期的精巢cDNA為模板,采用qRT-PCR技術分析dmc1基因在不同發育時期精巢的表達情況。20 μL PCR反應體系為:2×PowerUpTMSYBR?Green Master Mix 10μL,上、下游引物各0.4μL,ddH2O 8.5μL。PCR反應程序同制作標準曲線進行的熒光定量PCR反應程序。每個樣品設置3個平行,以達氏鱘β-actin為內參,用滅菌雙蒸水代替模板作為陰性對照。應用2-ΔΔCT法確定dmc1基因mRNA表達量,利用SPSS 22.0統計軟件進行數據分析,當P<0.05時認為差異顯著,P<0.01時認為差異極顯著。
2 結果與分析
2.1 dmc1基因編碼區序列特征分析
獲得達氏鱘Dmc1開放閱讀框(open reading frame,ORF)為 1 029 bp,編碼 342個氨基酸。ExPASy ProtParam分析達氏鱘Dmc1前體蛋白的理化性質,推測達氏鱘 Dmc1的分子式為C2964H4901N1029O1223S255,總共包括10 372個原子,其蛋白質分子量(protein molecular weight,Mr)為82.696 kDa,理論等電點(isoelectric point,pI)為5.04;該蛋白由22種氨基酸組成,其不穩定指數(instability index)為 46.85,屬于不穩定蛋白;親水性平均指數為0.829,屬于疏水性蛋白。
利用SignalP 4.1 Server在線分析,結果顯示該預測蛋白不存在信號肽序列,也未發現跨膜區,表明其不是分泌性蛋白、跨膜蛋白。結構域分析結果顯示:達氏鱘Dmc1蛋白與其它物種一樣都含有大腸桿菌RecA蛋白家族保守的第二結構域(63-342)、Rad51_DMC1_radA,B(103-337)結構域和 recomb_DMC1(26-340)結構域。同時在這些保守區域內還含有兩個嘌呤核苷酸的結合位點(motifs A和B)和兩個DNA結合區(L1和 L2)(圖1)。

表1 PCR相關引物序列Tab.1 Primers used for PCR
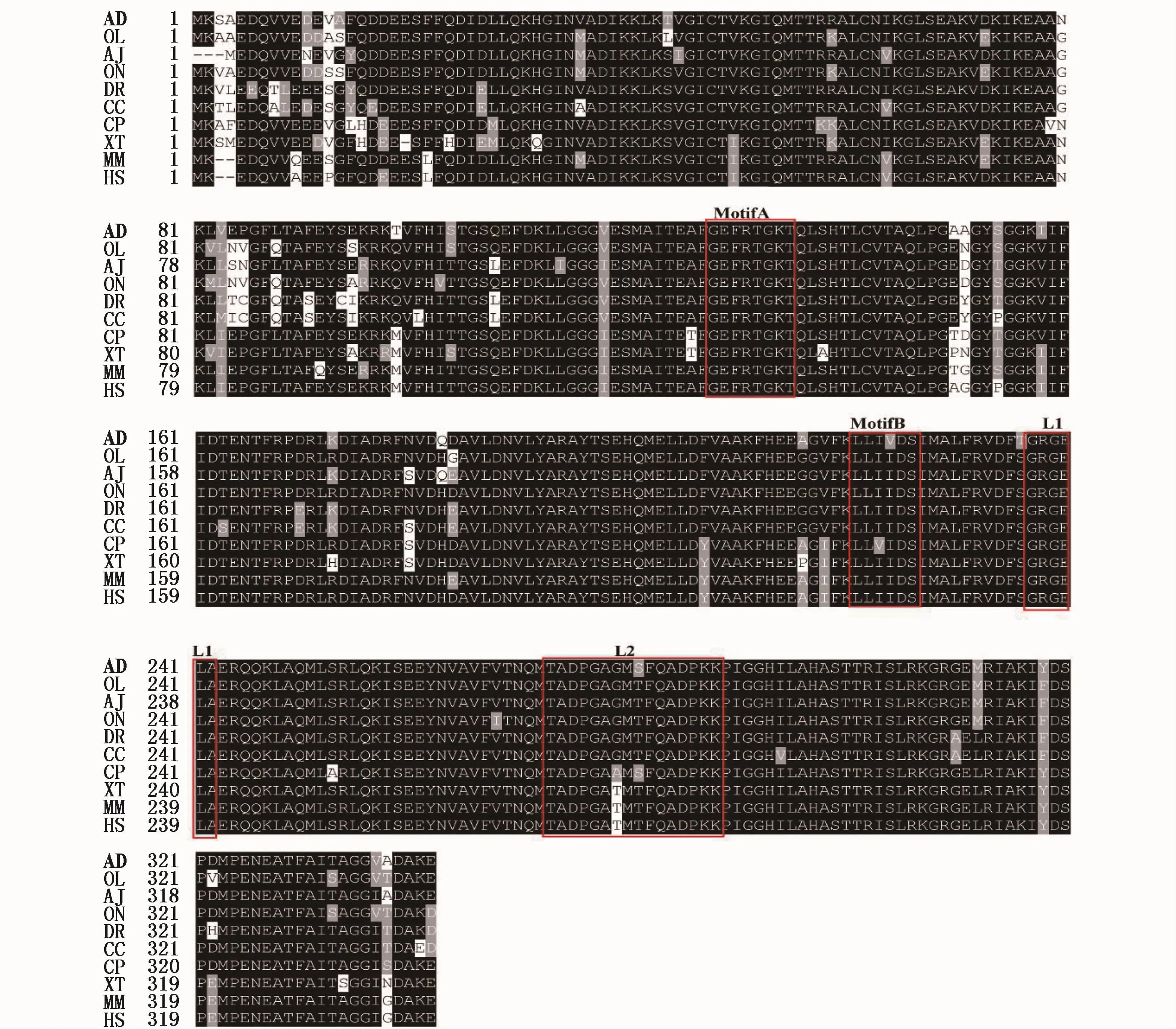
圖1 達氏鱘Dm c1氨基酸序列的預測及與其他物種Dm c1氨基酸序列的比較Fig.1 Predicted Dm c1 am ino acid sequence of Acipenser dabryanus and alignment w ith other species
2.2 達氏鱘dmc1基因同源性分析
利用CLUSTAL X分析達氏鱘Dmc1和已經報道的其他物種Dmc1的氨基酸序列同源性。多重比對達氏鱘、日本鰻鱺、尼羅羅非魚、斑馬魚、鯽鯉、青鱂、蠑螈、爪蟾、小鼠和人的Dmc1氨基酸序列(表2),發現在這些物種中,Dmc1氨基酸序列具有較高的同源性,其中任意兩者的同源一致性都在85%以上,并且都含有兩個可以結合核酸motif(GEFRTGKT和 LLIID),這表明 Dmc1蛋白在進化過程中可能比較保守。系統進化分析顯示(圖2),Ad Dmc1屬于RecA家族Dmc1蛋白分支,且屬于四足動物類分支,與硬骨魚類分支分開。
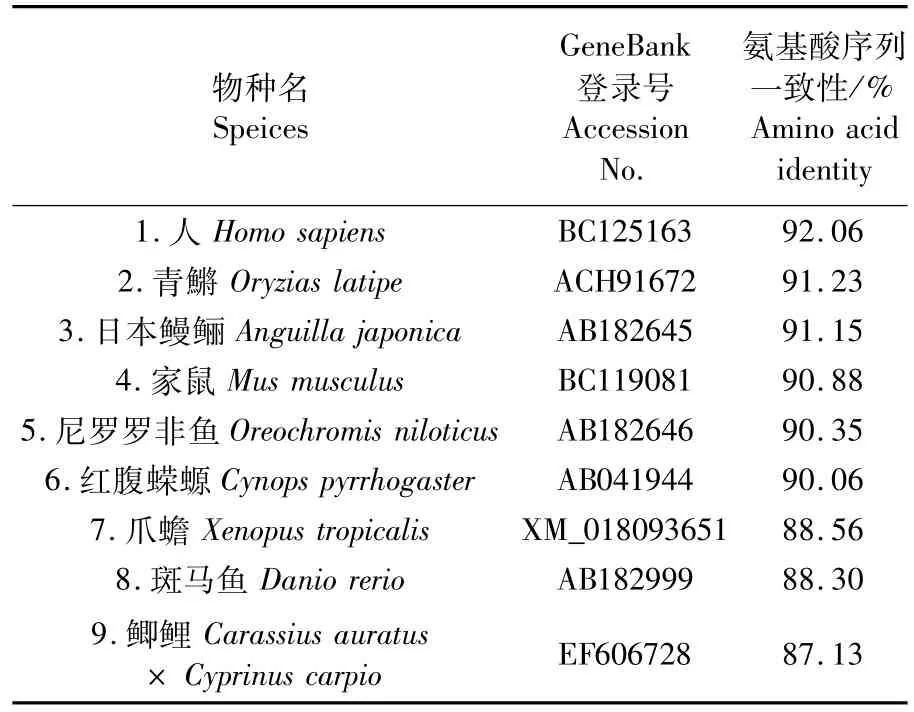
表2 達氏鱘Dm c1氨基酸序列和其他物種的相似性比較Tab.2 Percentage identities in am ino acid sequence of Ad Dm c1 w ith other species
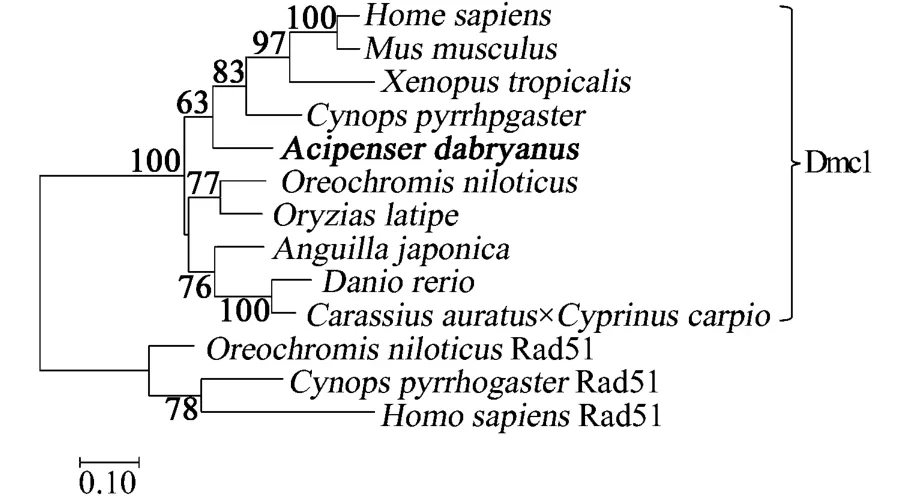
圖2 Dm c1氨基酸序列系統發育樹(達氏鱘Dm c1加粗顯示)Fig.2 Phylogenetic relationship of fish Dm c1 proteins(bold font shows Acipenser dabryanus Dm c1)
2.3 達氏鱘dmc1基因在不同組織中的表達特征
采用RT-PCR方法分析dmc1基因在達氏鱘雌、雄個體9種組織中的表達特征。如圖3所示,在達氏鱘雌雄個體9種組織中,dmc1基因僅在精巢和卵巢中表達;而在心、肝、脾、腎、鰓、腸、垂體和下丘腦中未發現dmc1的表達,表明dmc1基因為達氏鱘性腺特異表達。
2.4 達氏鱘dmc1基因real-time PCR標準曲線的建立
將達氏鱘精巢cDNA模板按10倍倍比稀釋5個濃度梯度,對dmc1基因進行real-time PCR擴增,得到標準曲線、熔解曲線(圖4)并進行分析。可知標準曲線中的拷貝數與CT值兩者基本呈線性反比關系,基因片段回歸方程為:Y=-3.176X+34.531,標準曲線相關系數R2=0.996,表明線性關系良好,擴增效率為106.486%,熔解曲線顯示單一的峰,無非特異性峰,擴增產物單一,無非特異性擴增及引物二聚體形成。符合實驗的要求,可用于后續目的基因片段的定量分析。
2.5 達氏鱘不同發育時期精巢中dmc1基因m RNA的表達水平
根據HE染色結果可將達氏鱘精巢發育分為6個時期:0、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期。0期精巢中,未形成精小囊,可見少量原始生殖細胞(圖5-a);Ⅰ期精巢中,精原細胞增殖,可見大量A型精原細胞(圖5-b);Ⅱ期精巢中出現B型精原細胞,但主要還是以A型精原細胞為主(圖5-c);Ⅲ期精巢中,以初級精母細胞為主,存在著少量次級精母細胞(圖5-d);Ⅳ期精巢中,有大量初級精母細胞、次級精母細胞、精子細胞,還有少量的精子(圖5-e);Ⅴ期精巢中,主要是精子(圖5-f)。
Real-time PCR結果(圖6)顯示,在0期和 I期的精巢中,dmc1基因沒有表達,Ⅱ期精巢中其有微弱表達;在Ⅲ期和Ⅳ期中其表達量急劇增加,并在Ⅳ期達到最高水平;Ⅴ期精巢中其表達量顯著性降低(P<0.05)。

圖3 達氏鱘dmc1基因的組織表達特性Fig.3 Tissue-specfic expression of Addmc1
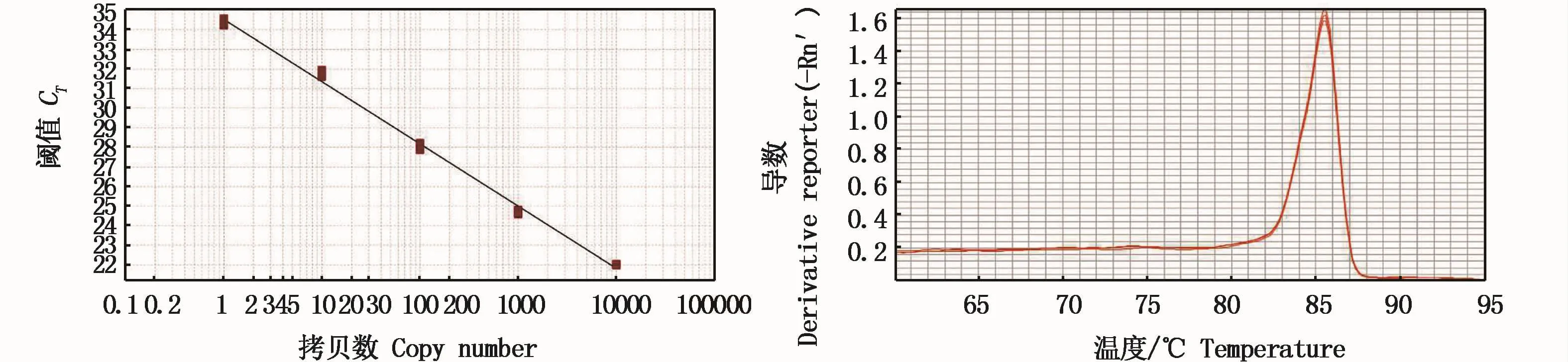
圖4 dmc1基因擴增動力學曲線與熔解曲線Fig.4 Am p lification dynam ics curve and m elting curve of dm c1
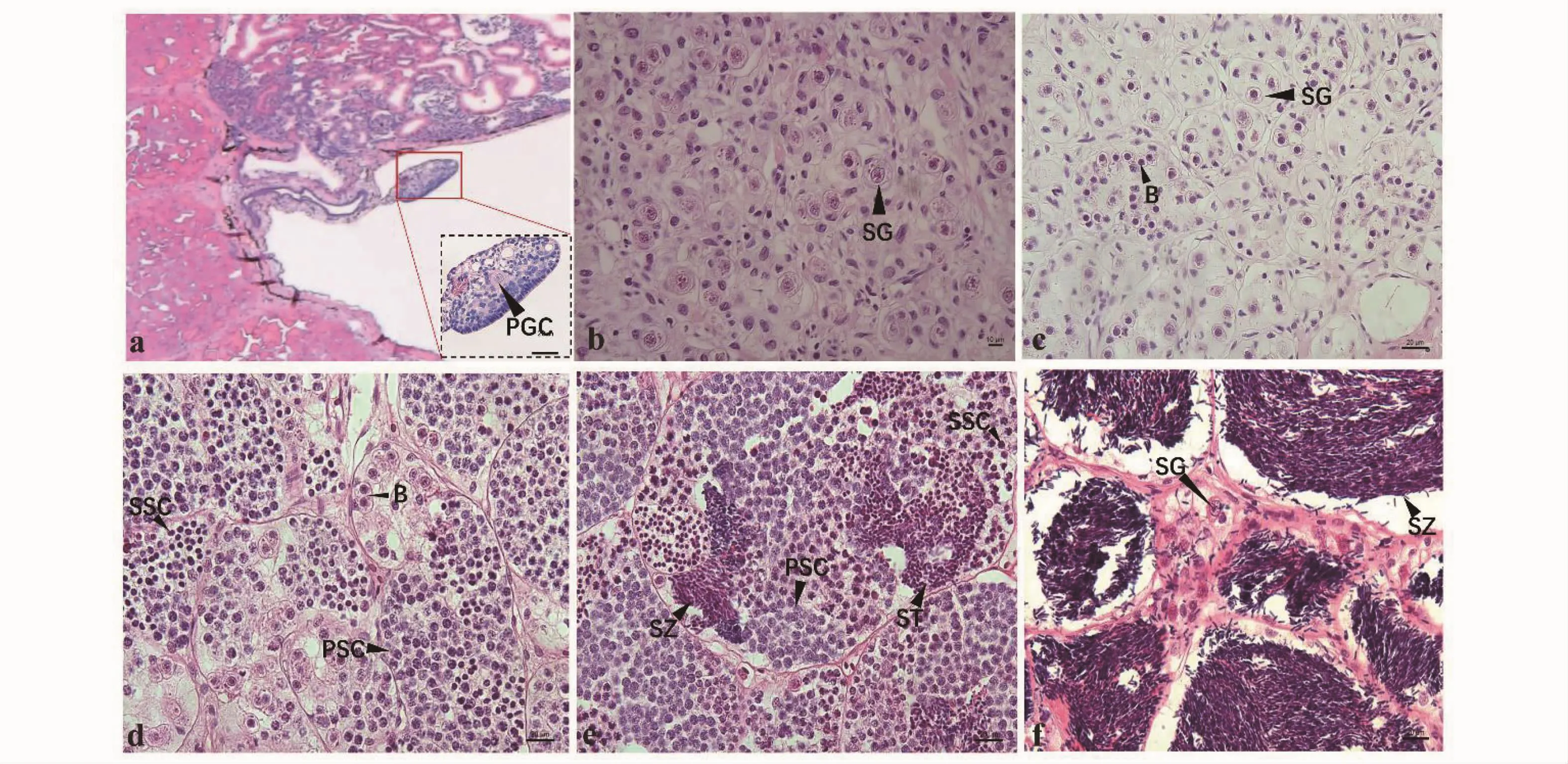
圖5 達氏鱘精巢不同發育時期形態結構Fig.5 M orphological structure of testis of Acipenser dabryanus at different development stages
3 討論
本研究成功克隆了達氏鱘dmc1基因的編碼區序列,獲得開放閱讀框(ORF)為1 029bp,編碼342個氨基酸。與其他魚類Dmc1氨基酸序列進行同源性比較,發現達氏鱘Dmc1與青鱂同源性最高,為91.23%,同時與人類、小鼠也具有較高的相似性,分別為92.06%和90.88%。蛋白預測分析表明,達氏鱘Dmc1與其他物種一樣都含有大腸桿菌RecA蛋白家族保守的第二結構域、recomb_DMC1結構域和Rad51_DMC1_radA,B結構域,并且在這些保守區域內還含有兩個嘌呤核苷酸的結合位點(motifs A和 B)[9]和兩個 DNA結合區(L1、L2),其中motif A(GEFRTGKT)是ATP/GTP結合位點,這個motif廣泛存在于Dmc1及同源蛋白、DNA重組與修復蛋白RecA和Rad51中[15]。根據Dmc1的多重序列比對和系統進化分析發現,Ad Dmc1屬于RecA家族Dmc1蛋白分支,且屬于四足動物類分支,與硬骨魚類分支分開,初步認為本研究克隆得到的序列是達氏鱘dmc1基因。
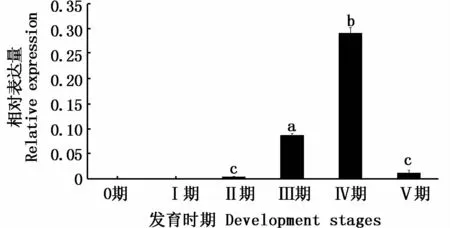
圖6 達氏鱘精巢不同發育時期dmc1基因mRNA的相對表達水平Fig.6 Relativem RNA level of dmc1 gene of testis in Acipenser dabryanus at different development stages
對多種魚類研究發現,dmc1基因在不同組織的表達特征較為保守,即僅在性腺中特異表達。在紅鯽、鯉、四倍體鯽鯉及三倍湘云鯽中[11],dmc1基因只在其早期卵巢或者精巢中特異表達。在第四代雌核發育二倍體鯽鯉中(G4)[24]中,同樣發現dmc1基因只在G4性腺中表達。本研究通過RTPCR分析發現,達氏鱘dmc1基因也只在性腺中特異表達,說明其可能只在性腺中發揮作用。
在達氏鱘不同發育時期精巢的研究結果表明,dmc1基因在0~Ⅰ期精巢中不表達;在Ⅱ、Ⅲ、Ⅳ期精巢中其表達量逐漸升高,并在Ⅳ期精巢中達到最高;在Ⅴ期精巢中,其表達量顯著性下降(P<0.05)。結合HE染色結果發現,0期精巢中未形成精小囊,可見少量原始生殖細胞;Ⅰ期精巢中精原細胞增殖,可見大量A型精原細胞;Ⅱ期精巢中出現B型精原細胞,但主要還是以A型精原細胞為主;Ⅲ期精巢中,以初級精母細胞為主,存在著少量次級精母細胞;Ⅳ期精巢中,有大量初級精母細胞、次級精母細胞、精子細胞,還有少量的精子;Ⅴ期精巢中,主要是精子,初步推斷dmc1基因主要在精母細胞中表達。這與dmc1基因在小鼠中的表達特征類似,小鼠dmc1基因僅在減數分裂I細線期到偶線期的精母細胞中特異表達[9]。然而,在蠑螈的研究中,發現dmc1基因在減數分裂I細線期開始顯著表達,且一直持續至精子生成階段,即dmc1基因不僅在精母細胞中表達,而且在精子細胞中也表達[13],這表明dmc1基因可能在單倍體細胞(如精子細胞)中發揮一定的作用,并非僅調控減數分裂過程中染色體的聯會和重組。日本鰻鱺中,dmc1基因只在減數分裂Ⅰ的早期表達[12],并持續到粗線期,但其表達量逐漸降低。綜上所述,雖然dmc1基因在表達時期存在種間特異性,但其主要在減數分裂過程中起作用。
精子發生是一個復雜的細胞增殖及分化的過程,其中減數分裂又是最為關鍵的步驟。在此過程中,一些基因的存在與否、表達水平對形成具有活性的成熟精子有著至關重要的作用[25]。研究表明,dmc1基因在犏牛睪丸組織中低水平表達所表現出的減數分裂障礙與小鼠dmc1基因突變、敲除的表型一致,表明dmc1基因的低水平表達與犏牛的雄性不育有一定關系[14],這可能對治療雄性不育提供新思路。在酵母中,dmc1基因的突變導致減數分裂中的DSBs修復大幅減少,出現聯會紊亂。而在人和小鼠的雄性個體中,dmc1基因的突變使聯會紊亂,造成精子生成障礙。與哺乳動物不同,青鱂缺失dmc1基因仍會產生少量畸形精子,暗示青鱂中存在 DSBs修復的補償途徑[26]。dmc1基因作為減數分裂過程中的特異表達基因,能標記生殖細胞進行減數分裂的開始,有助于闡述一些物種從有絲分裂到減數分裂的形態轉變機制[13]。經過十多年的發展,魚類生殖細胞移植技術已成功應用到多種魚類,在種質資源保存、增殖放流和物種恢復方面具有重大的應用潛力。近年來有關達氏鱘精原細胞移植的研究已經取得階段性成果,但高效的移植依賴于精原干細胞的體外增殖培養。前期已開展了達氏鱘精原細胞培養方面的工作,但對培養的達氏鱘精原干細胞鑒定還有所欠缺。目前,已鑒定的達氏鱘生殖細胞標記基因有dnd和vasa,但是它們除了在精原細胞表達外,在精母細胞中也有表達。因此,有必要鑒定在特異類型生殖細胞表達的基因。本研究中dmc1基因在精子生成中所表現出的結果,推斷其可能為減數分裂標記基因,將為后續體外培養精原干細胞的鑒定奠定基礎。

