免疫性血小板減少癥患者血小板COX-1和COX-2的表達及意義
葉加建 吳定昌 湯忠秀 李麗麗
(福建省老年醫院檢驗科,福州 350003)
免疫性血小板減少癥(Immune thrombocytopenia purpura,ITP)是一種最常見的自身免疫性出血性疾病,主要臨床表現為血小板數目減少[1]。目前關于ITP發病機制尚未完全清楚,以往研究認為抗原特異性自身抗體介導的血小板破壞從而引起血小板減少癥[2]。ITP患者產生的血小板更大且更不成熟,而多數抗體易與血小板膜糖蛋白GPⅡb/Ⅲa結合[3]。研究表明環氧化酶-1(Cyclooxygenase-1,COX-1)在調節血小板聚集方面發揮重要作用[4]。環氧化酶-2(Cyclooxygenase-2,COX-2)與GPⅡb/Ⅲa及P-選擇素水平變化與血小板活化有關,且血小板濃度與聚集率之間呈正相關[5]。目前關于COX-1、COX-2在ITP患者血小板中表達的研究相對較少,本研究擬通過流式細胞術檢測ITP患者富血小板血漿(Platelet-rich plasma,PRP)中COX-1、COX-2的表達及其意義,為臨床指導個體化抗血小板治療提供一定理論依據。
1 資料與方法
1.1資料
1.1.1主要儀器及試劑 全血自動血細胞分析儀購自美國庫爾特公司,Coulter Epics XL MCL flow cytometer流式細胞儀購自美國Beckman Coulter公司,IsotonⅢ試劑購自美國Beckman Coulter公司,PE-CD42b抗體購自美國Becton Dickinson公司,FITC-COX-1與FITC-COX-2抗體購自美國Cayman Chemical公司,鼠抗人IgG、IgM、IgA一抗購自法國Immunotech公司。
1.1.2臨床資料 選擇2015年3月至2017年2月于我院診治的65例免疫性血小板減少癥患者為研究組,另選取同期于我院進行體檢的健康獻血者61例為對照組。收集兩組受試人員的一般資料包括年齡、性別等。納入標準:①免疫性血小板減少癥患者符合相關診斷標準[6];②ITP患者均未接受過血小板輸注與脾切除治療;③未服用影響凝血功能藥物者;④患者知情且簽署同意書。知情同意書主要內容包括研究背景、目的、不易參與人群、參加研究可能受益項及風險、不良反應及相關費用情況等。排除標準:①自身免疫性疾病患者;②精神病患者;③惡性腫瘤患者;④正在參加其他臨床試驗者;⑤有血液系統疾病史者。兩組研究對象年齡、性別等一般資料比較差異無統計學意義,具有可比性。
1.2方法
1.2.1樣本采集 兩組研究對象均于次日清晨采集空腹靜脈血3 ml并置于3.2%枸櫞酸鈉抗凝管內,1 h內將其置于離心機轉速為200 r/min離心4 min,以此獲得PRP。
1.2.2標記COX-1、COX-2 分別將PRP置于3個EP試管內,每支試管裝25 μl,并將100 μl IsotonⅢ加入其中兩支試管,之后加入PE-CD42b抗體室溫下避光孵育,20 min后加入1%多聚甲醛固定10 min,然后用0.1%TritonX-100破膜,10 min后分別加入5 μl FITC-COX-1與FITC-COX-2抗體并避光孵育,20 min后采用1%多聚甲醛固定10 min,另外一支未加抗體的EP試管作為陰性對照。其中PE-CD42b可特異性識別血小板膜糖蛋白,因而雙陽性檢測結果可特異性反映血小板內COX-1、COX-2表達。
1.2.3標記血小板膜糖蛋白(GPⅡb/Ⅲa)與血小板相關抗體 50 μl血小板懸浮液中分別加入IgG1PEE/IgG1FITC(10 μl)與CD41/CD61(10 μl),并將其置于室溫靜置15 min后上機檢測。IgG、IgM、IgA單克隆抗體5 μl分別加入測定試管中,室溫靜置15 min后加入FITC標記羊抗鼠IgG,PBS清洗后上機檢測。
1.2.4流式細胞儀檢測 將處理好的血標本于2 h內在流式細胞儀上檢測與分析,根據前群及側群的分布確定血小板的位置(門)并對門、電壓及補償進行調整,計數1×104個血小板并記錄其熒光標記抗體的陽性百分比即為COX-1、COX-2表達。
1.2.5觀察指標 運用血細胞自動分析儀檢測抗凝試管內靜脈血的血小板參數并觀察血小板參數的變化,包括血小板計數(PLT)、血小板比積(PCT)、平均血小板體積(MPV)、血小板分布寬度(PDW)。
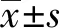
2 結果
2.1兩組臨床資料的比較 研究組PLT、PCT、PDW、GPⅡb/Ⅲa顯著低于對照組(P<0.05),而MPV、PAIgG、PAIgM、PAIgA明顯高于對照組(P<0.05),詳見表1。
2.2兩組血小板COX-1、COX-2表達的檢測結果 兩組血小板COX-1、COX-2表達存在明顯差異,研究組患者血小板內COX-1、COX-2陽性百分比均顯著高于對照組(P<0.05),詳見圖1、表2。

Tab.1 Comparison of clinical data between two groups


ClinicalindicatorsControlgroup(n=61)Researchgroup(n=65)χ2/tPAge47.58±7.9348.02±8.030.3090.758Gender(n)0.3420.559Male2530Female3635Platelet parametersPLT(×109 L-1)125.36±20.0162.58±2.2325.1360.000MPV(fl)6.23±1.0410.21±1.0321.5750.000PCT(%)1.25±0.230.34±0.0431.4040.000PDW15.23±2.0112.72±1.617.7590.000Platelet-associated antibodyPAIgG(%)11.48±3.8229.21±9.7313.3000.000PAIgM(%)9.58±3.1923.57±7.8612.9350.000PAIgA(%)7.54±1.2621.34±7.1114.9370.000GPⅡb/Ⅲa(%)93.27±31.0967.78±22.535.2930.000

圖1 流式細胞術檢測血小板內COX-1和COX-2的表達Fig.1 Flow cytometry to detect the expression of COX-1 and COX-2 in plateletsNote: A,B. The control group and the research group COX-1 respectively;C,D. The control group and the research group COX-2 respectively.
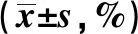


GroupsnCOX-1COX-2Control group6115.21±1.2318.34±2.36Research group6542.35±3.571)66.18±12.671)
Note:Compared with control group,1)P<0.05.
2.3血小板COX-1、COX-2表達與患者臨床指標的關系 Pearson法分析免疫性血小板減少癥患者血小板內COX-1、COX-2表達與患者臨床指標的相關性,結果顯示COX-1、COX-2均與MPV、PAIgG、PAIgM、PAIgA呈正相關,而均與PLT、PCT、GPⅡb/Ⅲa呈負相關,差異均具有統計學意義(P<0.05),詳見表3。
2.4ROC分析血小板COX-1、COX-2對免疫性血小板減少癥的診斷價值 ROC分析結果顯示COX-1的敏感度為69.23%、特異度為90.62%、截斷值為17.63,COX-2的敏感度為78.46%、特異度為84.37%、截斷值為23.95,詳見圖3、表4。
2.5免疫性血小板減少癥發生的相關因素分析 將影響免疫性血小板減少癥發生的相關因素進行Logistic分析,結果顯示MPV、PCT、PAIgG、PAIgA、GPⅡb/Ⅲa、COX-1與COX-2均為免疫性血小板減少癥發生的危險因素,詳見表5。
表3 患者血小板COX-1、COX-2表達與血小板參數的關系
Tab.3 Relationship between expression of COX-1 and COX-2 and platelet parameters in patients with platelets

PlateletparametersCOX-1rPCOX-2rPPLT-0.2720.029-0.3500.004MPV0.5790.0000.7110.000PCT-0.2880.020-0.4440.000PDW-0.1130.372-0.1740.165PAIgG0.3010.0150.4530.000PAIgM0.2680.0310.4970.000PAIgA0.4460.0000.5280.000GPⅡb/Ⅲa-0.5430.000-0.6400.000

圖3 免疫性血小板減少癥血小板COX-1和COX-2的ROC分析Fig.3 ROC analysis of platelet COX-1 and COX-2 in immune thrombocytopenia
表5 影響免疫性血小板減少癥發生的相關因素的多因素分析
Tab.5 Multivariate analysis of factors affecting the occurrence of immune thrombocytopenia

Influencing factorβSEWald/χ2POR95%CIAge0.3040.2122.0500.3761.3551.123~1.634Gender0.4990.3202.4270.2681.6461.347~2.012MPV1.0070.4365.3360.0242.7382.182~3.435PCT0.9730.4285.1650.0372.6451.765~3.964COX-11.0730.4136.7460.0132.9232.124~4.023COX-21.1420.4028.0690.0023.1332.247~4.368PAIgG1.0770.4336.1840.0112.9352.147~4.013PAIgM0.7970.4413.2650.3582.2191.847~2.665PAIgA1.0470.4375.7420.0222.8502.024~4.012GPⅡb/Ⅲa0.7640.3126.0000.0152.1471.748~2.638
表4 免疫性血小板減少癥血小板COX-1和COX-2的ROC分析
Tab.4 ROC analysis of platelet COX-1 and COX-2 in immune thrombocytopenia

IndexAUCStandard errorZ statistics95%CIPCOX-10.8500.03410.260.777~0.907<0.000COX-20.7930.0417.1410.713~0.860<0.000
3 討論
ITP主要由機體多種免疫功能異常導致血小板破壞增加或生成減少所致,嚴重時危及生命安全[7]。以往研究認為血小板活性增強與機體免疫系統紊亂在ITP的發病中發揮重要作用[8,9]。機體免疫系統紊亂導致患者體內抗血小板抗體與血小板結合進而破壞網狀內皮系統并導致血小板數量減少[10]。研究表明抗血小板藥物可促使COX-1乙酰化并減少花生四烯酸代謝產物血栓素A2的產生進而抑制血小板凝集[11]。相關研究顯示,COX-1、COX-2基因多態性在血小板活性增強、抗血小板過程中具有關鍵作用。當前臨床通過排除其他引起的血小板減少癥病因進行ITP診斷,且缺乏敏感性及特異性的診斷指標。因此,本研究分析血小板COX-1、COX-2在免疫性血小板減少癥中的臨床應用價值。
COX-1可在花生四烯酸生物合成前列腺素過程中發揮重要作用,研究表明惡性腫瘤組織中COX-1表達水平顯著升高并可作為診斷疾病的重要指標[13]。原發性血小板增多癥患者COX-1表達與其在健康個體內的表達并無明顯差異[14]。本研究采用流式細胞術檢測所有研究對象血小板內COX-1表達水平,結果顯示研究組患者血小板內COX-1表達顯著高于對照組,這可能是由于ITP患者血小板破壞程度增加所致[15]。血小板參數可反映血小板生成與衰亡,其中PLT是監測凝血狀況的常規指標,PCT與PLT變化基本一致,MPV可反映骨髓中巨核細胞代謝及血小板生成情況,PDW可反映血小板大小的異質性及分布的趨勢[16]。與此相似,本研究結果也顯示研究組患者PLT、PCT、PDW均顯著低于對照組,而MPV顯著高于對照組,此外研究組GPⅡb/Ⅲa顯著低于對照組,而PAIgG、PAIgM、PAIgA明顯高于對照組,進一步進行相關性分析顯示COX-1表達與MPV、PAIgG、PAIgM、PAIgA呈顯著正相關,而與PLT、PCT、GPⅡb/Ⅲa呈顯著負相關,說明COX-1參與ITP疾病發生過程。提示COX-1異常并通過與自身血小板抗原作用促使機體產生相應抗體從而激活B淋巴細胞最終導致ITP患者病情加重。
COX-2是一種誘導酶并可通過MAPK依賴的磷酸化途徑抑制過氧化物酶增殖物激活受體γ(PPAR-γ)表達進而引起Th細胞亞群紊亂[17]。相關研究表明Treg/Th17細胞平衡失調可能引發原發免疫性血小板減少癥并可促進疾病的發生發展[18]。本研究結果顯示研究組患者血小板內COX-2陽性百分比顯著高于對照組,與文獻報道相似[19],說明ITP患者血小板內COX-2呈高表達。分析其原因可能為COX-2高表達可造成細胞免疫功能紊亂,同時可通過T細胞介導的細胞毒作用直接破壞血小板進而導致血小板破壞增加。觀察COX-2表達與ITP患者臨床指標的關系,結果顯示COX-2與MPV、PAIgG、PAIgM、PAIgA呈顯著正相關,而與PLT、PCT、GPⅡb/Ⅲa呈顯著負相關,說明COX-2與ITP發生及血小板代謝密切相關。提示COX-2通過引發機體免疫功能異常并促使抗體水平升高從而促使GPⅡb/Ⅲa減少,并可抑制其黏附、聚集功能導致ITP的發生。
既往檢測COX-1、COX-2多采用酶聯免疫吸附法,或Western blot方法檢測血小板COX-1、COX-2蛋白水平,但對血小板極少的患者檢測結果存在較大偏差,且操作過程中易破壞和激活血小板[20]。本研究通過流式細胞術檢測COX-1、COX-2表達并采用ROC法分析顯示COX-1與COX-2具有較高的靈敏度與特異度,說明COX-1與COX-2在ITP的診斷中具有較高的應用價值,且二者的截斷值可作為陽性診斷界值進而提高ITP診斷的敏感性及特異性。說明COX-1與COX-2共同作用并可反映免疫性血小板減少癥的進展情況,分析原因可能為ITP患者血小板COX-1與COX-2異常表達可促使細胞免疫功能紊亂進而影響血小板的正常代謝。同時本研究將影響ITP疾病發生的相關因素進行Logistic分析,結果顯示COX-1與COX-2均為免疫性血小板減少癥發生的危險因素。本研究結果揭示通過流式細胞技術檢測血小板COX-1、COX-2蛋白水平可有效反映ITP患者的疾病狀態并為臨床疾病診斷提供重要的參考依據。
綜上所述,ITP患者血小板COX-1與COX-2均呈高表達,二者呈顯著正相關關系且共同參與ITP疾病發生及進展過程,血小板COX-1與COX-2表達異常在ITP發病過程中可能發揮重要作用。關于血小板COX-1與COX-2在ITP發病中的作用機制將有待進一步研究。

