南瓜MSAP 體系的優化及引物篩選
江 毅 姜立娜周俊國
(河南科技學院園藝園林學院,河南省園藝植物資源利用與種質創新工程研究中心,河南新鄉 453003)
DNA 甲基化是引起植物表觀遺傳學改變的重要因素,通過檢測甲基化狀態及其改變動態,可以揭示生物體正常狀態下基因表達的時空調控以及因甲基化錯誤造成的發育障礙和疾病。檢測DNA 甲基化的方法有重亞硫酸氫鹽法、甲基化敏感擴增多態性(methylation sensitive amplification polymorphism,MSAP)分析、甲基化檢測芯片技術和甲基化測序等,利用這些技術來確定某個堿基位點的甲基化情況。其中,MSAP 分析因操作簡便、重復性好、費用低等優點被廣泛應用,是植物DNA 甲基化水平檢測的重要技術(Avramidou et al.,2015)。MSAP 技 術 是 在AFLP(amplified fragment length polymorphism)技術的基礎上建立起來的,主要是利用可識別5′-CCGG 序列并且對DNA 甲基化敏感性不同的同裂酶HpaⅡ和MspⅠ,與識別GAATTC 序列的EcoRⅠ配對組合對基因組進行酶切,然后再加上相應的限制性內切酶的接頭,利用接頭序列設計引物,對5′-CCGG 位點甲基化進行特異性擴增。HpaⅡ和MspⅠ對甲基化的敏感程度不同,HpaⅡ不能切割雙鏈內外側甲基化,即不能切割“CmCGG、mCCGG”和“mCmCGG”,但可切割單鏈甲基化的序列;而MspⅠ能切割單鏈或雙鏈 “CmCGG”,不能切割“mCCGG”甲基化序列。MSAP 在全基因組范圍檢測CCGG 位點的胞嘧啶甲基化變化,從而產生不同酶切產物,最終產生可見的具有不同酶切形式的譜帶,以明確DNA甲基化信息。但是,MSAP 技術的局限性是不能完成非CCGG 位點的胞嘧啶甲基化檢測。自Xiong等(1999)首次將MSAP 技術用于檢測DNA 甲基化以來,這項技術已運用于醫學(Shridhar et al.,2015;吳璇 等,2018)、植物(黃韞宇 等,2013;黃豪永,2014)、動物(吳宇,2017;曼則熱 · 朱爾丁 等,2018)等多個領域。
南瓜為葫蘆科南瓜屬(Cucurbita)中的一年生草本植物,起源于美洲大陸,是世界范圍內廣泛栽培的傳統作物。南瓜根系發達,種質資源豐富,有較高的經濟價值和觀賞價值(林德佩,2000)。隨著分子植物育種技術的飛速發展,有研究者運用SSR(朱海生 等,2018)、AFLP(李雪,2014)、SNP(周洋洋 等,2018)等分子標記技術深入分析南瓜果肉、蔓性、果皮顏色等性狀的基因遺傳信息,而關于南瓜MSAP 技術的應用較少(Aliki et al.,2019)。本試驗以南瓜自交系北觀為材料,利用正交設計的方法優化南瓜MSAP 技術中的重要影響因素,并最終篩選出36 對多態性引物,以期為南瓜表觀遺傳分析奠定基礎。
1 材料與方法
1.1 試驗材料與試劑
試驗材料為南瓜高代自交系北觀,系印度南瓜種(Cucurbita maxima),由河南科技學院南瓜育種課題組提供。試驗時間為2018 年10~12 月,試驗地點為河南科技學院分子實驗室。
試驗所用植物基因組DNA 提取試劑盒、限制性內切酶EcoRⅠ(15 U · μL-1)、HapⅡ(HpaⅡ,MspⅠ)(10 U · μL-1)購自北京百泰克生物技術有限 公 司;T4 DNA ligase(350 U · μL-1)、Taq DNA聚合酶(5 U · μL-1)、dNTP Mixture(2.5 mmol · L-1)購自寶生物工程有限公司;試驗所用引物由美國英杰生命技術有限公司合成。
1.2 試驗方法
1.2.1 基因組DNA 的提取及檢測 當南瓜幼苗生長至兩葉一心時,取真葉0.5~1.0 g,分別用SDS 法(劉殿林 等,2002)、CTAB 法(紀元 等,2012)、SDS-CTAB 法(徐彥軍和劉洋,2012)和試劑盒法進行基因組DNA 提取。其中,試劑盒法提取DNA 按照試劑盒說明書進行。提取結果用1%瓊脂糖凝膠電泳檢測,利用核酸蛋白檢測儀測定A260/A280和A260/A230波長下的OD 值以及DNA 的濃度。
1.2.2 MSAP 兩步式酶切時間與酶量的優化 選用
HapⅡ(HpaⅡ,MspⅠ)與EcoRⅠ對基因組DNA進行兩步式酶切。第一步酶切體系為21 μL,包括基 因 組DNA 500 ng,HapⅡ與2.1 μL 10×L Buffer反應液,剩余用ddH2O 補足。其中酶切時間優化設置5 個水平,分別為2、4、6、8 h 和10 h;HapⅡ用量設置3 個水平,即0.5、1.0 μL 和1.5 μL,在PCR 儀中37 ℃酶切。酶切結束后,取酶切產物8 μL,加入2 μL 溴酚藍混合,用1%瓊脂糖凝膠電泳檢測,確定最佳酶切時間和酶量。
第二步酶切體系為25 μL,包括21 μL 第一步酶切產物,2.9 μL 10 × H Buffer,EcoRⅠ不同酶量設置3 個水平,即0.4、0.6 μL 和0.8 μL,剩余用ddH2O 補足。將上述體系于PCR 儀中37 ℃酶切,酶切時間優化設置4 個水平,分別為6、8、10 h和12 h,用1%瓊脂糖凝膠電泳檢測,確定最佳酶切時間和酶量。
1.2.3 MSAP 連接體系的建立 EcoRⅠ接頭合成:取EA1 和EA2 引物干粉,離心后用TE 緩沖液稀釋至濃度為10 μmol · L-1,分別取稀釋液50 μL,在200 μL PCR 管中混勻,在PCR 儀中進行接頭處理:94 ℃ 4 min,65 ℃ 10 min,緩慢冷卻至室溫,4 ℃保存備用。HapⅡ接頭合成同EcoRⅠ接頭的合成。
取 第 二 步 酶 切 產物21 μL 加入T4 DNA Ligase,EcoRⅠ接頭EA1+2、Hap Ⅱ接頭MH1+2(5 μmol · L-1)各1.0 μL,2.8 μL 10×T4 DNA Ligase Buffer,于16 ℃進行連接。其中,T4 DNA ligase的用量分別為0.5、1.0 μL,連接時間優化設置6 個水平,分別為2、4、6、8、10、12 h,用1%瓊脂糖凝膠電泳檢測,確定最佳連接體系。
1.2.4 MSAP 預擴增體系的優化 利用正交設計L16(45)試驗(表1),對MSAP 預擴增體系中的連接產物、Taq 酶、dNTP Mixture、Mg2+和引物5個因素進行篩選,確定預擴增體系的最佳水平。預擴增反應PCR 程序為:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 1 min,72 ℃ 1 min,共20 個循環;72 ℃ 5 min;4 ℃保存;預擴增產物用1%瓊脂糖電泳凝膠檢測,確定最佳擴增體系。
1.2.5 MSAP 選擇性擴增體系 在上述試驗的基礎上,將相應的預擴增產物分別稀釋40、80、120、160 倍進行選擇性擴增,以確定最佳稀釋倍數。
選擇性擴增體系為25 μL,其中預擴增產物稀釋后的模板4.0 μL,其他與預擴增體系相同。選擇性擴增的PCR 程序為94 ℃預變性1 min;94 ℃變性30 s,65 ℃退火30 s,72 ℃延伸1 min,共13個循環(每個循環退火溫度降0.7 ℃);94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸1 min,共23 個循環;72 ℃延伸10 min,4 ℃保存。PCR 擴增產物通過1%瓊脂糖凝膠電泳進行檢測。1.2.6 MSAP 體系驗證及引物篩選 利用優化的體系,對9 個EcoRⅠ引物(E1~E9)和9 個Hap Ⅱ(HpaⅡ,MspⅠ)引物(MH1~MH9)組成的81對引物組合進行篩選(表2),通過6%聚丙烯酰胺凝膠電泳檢測(郭小菲 等,2014),驗證MSAP 體系的可行性。

表1 MSAP 預擴增體系正交設計表 μL

表2 MSAP 分析所用引物
2 結果與分析
2.1 不同方法提取DNA 的比較

圖1 不同DNA 提取方法電泳檢測結果編號1~3 為CTAB 法;4~6 為SDS-CTAB 法;7~9 為SDS 法;10~12 為試劑盒法。
MSAP 分析對基因組DNA 的質量要求較高,本試驗分別使用SDS 法、CTAB 法、SDS-CTAB法和試劑盒法提取基因組DNA,所得DNA 用1%瓊脂糖凝膠電泳檢測。結果如圖1 所示,用CTAB法提取的DNA 沒有DNA 條帶,只有一片彌散;采用SDS-CTAB 法提取的DNA 可以看到明顯的DNA 條帶,但濃度較低且操作流程耗時較長;采用SDS 法提取的DNA 拖帶明顯,無法滿足試驗所用;試劑盒法提取DNA,條帶清晰明亮。結合表3 中測定的基因組DNA 濃度以及A260/A280、A260/A230的數值,最終選擇試劑盒法提取的南瓜基因組DNA 進行后續試驗。
2.2 酶切體系優化
酶切效果對后期試驗結果有較大的影響。用Hap Ⅱ對基因組DNA 進行第一步酶切,由圖2 可以看出,Hap Ⅱ用量和酶切時間對基因組DNA 酶切效果沒有明顯影響,在試驗中為節約時間和成本,故選擇37 ℃酶切2 h,Hap Ⅱ用量0.5 μL。
用EcoRⅠ內切酶進行第二步酶切,經1%瓊脂糖凝膠電泳檢測,結果如圖3 所示,1~6 泳道彌散較為明顯,7~9 泳道彌散隱約可見,10~12 泳道沒有明顯殘留,說明酶切完全;考慮試驗時間和經濟成本,故確定第二步酶切時間為6 h,EcoRⅠ用量為0.4 μL。
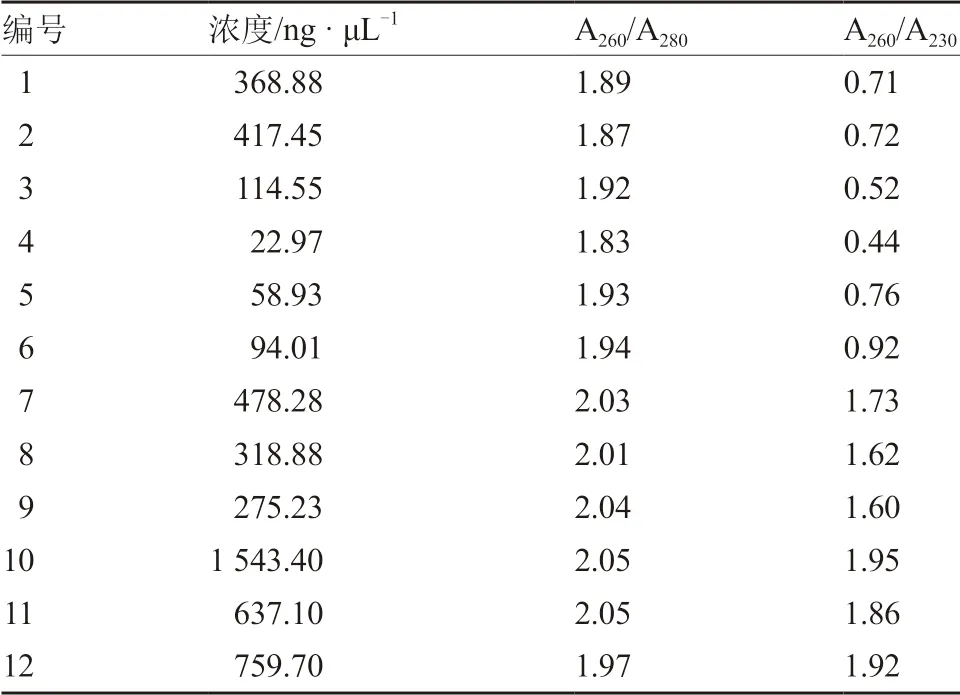
表3 不同DNA 提取方法濃度檢測
2.3 連接體系優化
連接時間對南瓜MSAP 的影響較大。由圖4可以看出,各泳道均有彌散,而11 泳道彌散的連續性較好,說明連接效果較好,故本試驗選擇連接時間為12 h,T4 DNA Ligase 用量為0.5 μL。
2.4 預擴增體系正交優化

圖2 不同酶切時間與HapⅡ用量電泳結果M 為DL 2000;1、2、3 泳道為酶切10 h;4、5、6 泳道為酶切8 h;7、8、9 泳道為酶切6 h;10、11、12 泳道為酶切4 h;13、14、15泳道為酶切2 h;1、4、7、10、13 泳道 Hap Ⅱ用量為0.5 μL,2、5、8、11、14 泳道Hap Ⅱ用量為1.0 μL;3、6、9、12、15 泳道 Hap Ⅱ用量為1.5 μL。

圖3 不同酶切時間與EcoRⅠ用量電泳結果M 為DL 2000;1、2、3 泳道為酶切12 h;4、5、6 泳道為酶切10 h;7、8、9 泳道為酶切8 h;10、11、12 泳道為酶切6 h;其中1、4、7、10 泳道EcoRⅠ用量為0.4 μL;2、5、8、11 泳道EcoRⅠ用量為0.6 μL;3、6、9、12 泳道EcoRⅠ用量為0.8 μL。
對16 個處理的預擴增產物的電泳分析結果表明(圖5),PCR 擴增結果具有較大差異。泳道4、6、8、10、11 彌散較亮,說明預擴增產物濃度較高;2、3、5、7、9、12 泳道彌散隱約可見,其他泳道則無彌散。綜合來看,表1 中6 號處理可作為預擴增反應最佳體系,即1.5 μL 10×PCR Buffer(Mg2+plus),2.0 μL連接產物,0.6 μL Taq 酶,2.0 μL dNTP Mixture,0.4 μL(10 μmol · L-1)上下游引物。

圖4 優化連接體系電泳結果M 為DL 2000;1、2 泳道為連接2 h,T4 DNA Ligase 用量分別為0.5、1.0 μL;3、4 泳道為連接4 h,T4 DNA Ligase 用量分別為0.5、1.0 μL;5、6 泳道為連接6 h,T4 DNA Ligase 用量分別為0.5、1.0 μL;7、8 泳道為連接8 h,T4 DNA Ligase 用量分別為0.5、1.0 μL;9、10 泳道為連接10 h,T4 DNA Ligase 用量分別為0.5、1.0 μL;11、12 泳道為連接12 h,T4 DNA Ligase 用量分別為0.5、1.0 μL。
圖5 正交優化預擴增電泳結果M 為DL 2000;1~16 為不同處理編號,各體系用量對應表1。
2.5 預擴增產物不同稀釋倍數優化
預擴增產物稀釋不同倍數后作為選擇性擴增模板,擴增結束后用1%瓊脂糖凝膠電泳檢測。由圖6 可以看出,泳道3 較其他泳道明亮,條帶清晰,說明擴增產物濃度較高,故將預擴增產物稀釋120倍作為選擇性擴增模板。

圖6 預擴增產物不同稀釋倍數電泳結果M 為DL 2000;泳道1~4 分別為預擴增產物稀釋40、80、120、160 倍。

圖7 MSAP 體系驗證及部分引物篩選電泳結果M 為DL 500;其他泳道為不同引物組合。
2.6 利用聚丙烯酰胺凝膠電泳驗證MSAP 體系及引物篩選
為證明上述試驗的可行性,利用6%聚丙烯酰胺凝膠電泳驗證MSAP 體系,并從81 對引物中篩選出36 對適于南瓜MSAP 分析的引物。試驗結果顯示(圖7),引物條帶清晰豐富,多態性好。
3 結論與討論
MSAP 是利用對DNA 甲基化敏感性不同的同裂酶切割DNA,從而產生不同酶切產物,經過添加接頭、PCR 擴增、PAGE 電泳、銀染,最終產生可見的具有不同酶切形式的譜帶,以明確DNA 甲基化信息。MSAP 分析在操作時需要有較高質量的基因組DNA 為前提,若DNA 中含有酚類、RNA酶類等雜質則會影響后續試驗進度。在本試驗中,利用4 種不同DNA 提取方法進行南瓜基因組DNA的提取,最終確定試劑盒法提取的DNA 條帶單一,濃度適中,更能滿足試驗要求。
MSAP 能夠識別多種生物的甲基化比例,具有普遍性,利用基因組DNA 即可進行遺傳多樣性分析(邱崢艷 等,2012)。在建立南瓜MSAP 體系時,根據預試驗結果綜合考慮每一步因素的體系范圍,利用兩歩式酶切,分別優化酶切時間和酶量,因為這兩個條件是酶切完全的關鍵因素,若酶切不完全會造成甲基化分析不準確,酶切過度則會出現非特異性片段。本試驗對第一步酶切時間優化設置5 個水平,HapⅡ用量優化設置3 個水平,得出當酶切2 h、酶量為0.5 μL 時,酶切較完全;第二步酶切同樣優化酶切時間和EcoR Ⅰ用量,經過電泳檢測證明,酶切時間6 h、酶量為0.4 μL 時效果較好。連接體系是在酶切完全的基礎上添加接頭,因此先要處理接頭,使接頭由單鏈變為雙鏈,在本試驗中連接時間為12 h、T4 DNA Ligase 用量為0.5 μL 的效果較好,這與呂曉婷等(2012)、周萌萌等(2018)優化MSAP 體系的結果不同,若連接時間過短,會造成連接不充分,影響片段擴增。
MSAP 分析擴增反應關系到DNA 全甲基化、未甲基化、半甲基化概率。在預擴增試驗中,由于影響PCR 擴增的因素較多,故利用正交設計優化了5 個主要影響因子,從而為整個試驗節約了成本和時間,優化最佳體系為連接產物2.0 μL,10×PCR Buffer(Mg2+plus)1.5 μL,dNTP Mixture(2.5 mmol · L-1)2.0 μL,Taq DNA 聚合酶(5 U · μL-1)0.6 μL,上下游引物(10 μmol · L-1)各0.4 μL;將預擴增產物作為選擇性擴增體系的模板,稀釋120 倍可以得到清晰的條帶。上述所優化的MSAP 體系,經聚丙烯酰胺凝膠電泳檢測顯示體系穩定,條帶清晰,可重復,同時也篩選出36 對適于南瓜MSAP分析的多態性引物,為后續開展南瓜和其他葫蘆科作物表觀遺傳研究提供一定的理論基礎。

