旱澇交替脅迫對杜鵑花生理特性的影響
李暢 蘇家樂 劉曉青 何麗斯 肖政 陳尚平
摘要:以對旱澇交替脅迫敏感性不同的2個杜鵑花品種為材料,通過對其旱澇交替脅迫下光合參數、丙二醛(MDA)含量、細胞膜相對透性、滲透調節物質及保護酶活性等的測定,研究旱澇交替脅迫對杜鵑花生理特性的影響。結果表明,旱澇交替脅迫下,2個杜鵑花品種葉片凈光合速率(Pn)、蒸騰速率(Tr)、氣孔導度(Gs)、水分利用率(WUE)、PSII最大光化學效率(Fv/Fm)均較處理前顯著下降。隨著旱澇交替脅迫時間的延長,MDA含量、細胞膜相對透性、脯氨酸(Pro)含量呈上升趨勢,可溶性糖含量、POD、CAT活性則先上升后下降。與抗性強的杜鵑花品種狀元紅相比,敏感品種琉球紅在旱澇交替脅迫下Pn、Tr、Gs、WUE、Fv/Fm葉綠素含量下降幅度大,SOD、POD、CAT活性、Pro和可溶性糖含量增加幅度小,MDA含量、細胞膜相對透性增加幅度大。狀元紅在旱澇交替脅迫下能保持葉綠素含量的穩定,維持一定水平的凈光合速率和水分利用率,保持膜系統處于相對完好的狀態,能保持較高的抗氧化酶活性以清除活性氧,保持較高的脯氨酸含量以維持滲透調節系統的穩定性是其抗性強的部分原因。
關鍵詞:杜鵑花;旱澇交替脅迫;生理特性
中圖分類號:S685.21
文獻標識碼:A
文章編號:1000-4440(2019)02-0412-08
旱澇脅迫是植物生長發育中最常遇到的逆境脅迫之一,近年來,中國旱澇災害頻繁發生,特別是長江中下游地區,夏季“旱澇并存、旱澇急轉”現象發生頻次呈上升趨勢,旱澇交替脅迫給植物的正常生長帶來更大程度的影響,經濟損失巨大[1-2]。旱澇災害交替發生使得將耐旱與耐澇一并研究極有必要,以探明植物本身對旱澇交替脅迫下的反應,尋求解決植物水分脅迫的2個極端處理的統籌方案,逐步實現植物旱澇雙抗目標。研究結果表明,植物的抗旱性和抗澇性均是受多因素控制、非常復雜的性狀,各因素之間還存在交叉作用[3-7]。原生質體脫水是植物遭受旱害的核心,液相中含氧量少(即根際缺氧)則是澇害的核心問題,2種脅迫均引發植物形態和生理生化變化[8-9]。不同的植物在對旱、澇脅迫的響應及抗性機制上亦存在差異。
杜鵑花是杜鵑花科(Ericaceae)杜鵑屬(Rhodo-dendron)植物的泛稱,其在中國栽培歷史悠久,是深受國人喜愛的十大傳統名花之一。隨著城市的發展,杜鵑花在園林綠化中應用面積逐年增加[10]。但,杜鵑花根系細且分布淺,對水分反應十分敏感,在野外生長、園林綠化及室內觀賞栽培中,其生長最常受到環境中旱澇因素的影響,故研究其在旱、澇交替脅迫下如何發揮體內的響應機制尤為重要11-12]。目前,針對杜鵑花在水分脅迫下的生理特性研究主要集中在特定逆境下某個或某幾個種類上,且對澇害研究報道極少,對旱澇交替脅迫下杜鵑花生理特性更是缺乏探究[2-1]。故本試驗以對旱澇交替脅迫敏感性不同的杜鵑花為材料,探討旱澇交替脅迫下2類杜鵑花種質在光合系統、抗氧化酶系統、滲透調節系統等方面的差異,在生理生化水平上解釋杜鵑花對旱澇交替脅迫的生理機制,以期為旱澇雙抗型杜鵑花種質的開發提供參考,為探討增強杜鵑花耐澇抗旱性的有效途徑和尋找克服或緩解杜鵑花旱澇危害的方法提供理論依據和技術指導。
1 材料與方法
1.1 試驗材料
選取對水分脅迫響應差異較大的2個杜鵑花品種琉球紅和狀元紅為試驗材料[17]。其中琉球紅為旱澇水分脅迫敏感型,狀元紅為忍耐型。
1.2 試驗方法
試驗在智能玻璃溫室中進行,選用生長勢一致、健壯的3年生實生苗進行盆栽試驗,每盆1株,塑料盆直徑18cm,高16cm。盆土由泥炭和珍珠巖3:1(體積比)混合配成,最大田間持水量55.07%。于2014年7月進行旱澇交替脅迫:先進行重度干旱脅迫處理,即土壤水分含量為最大田間持水量的30%士5%[13],處理時先澆透水后使土壤水分自然消耗,待達到重度干旱脅迫標準后,采用稱質量補水法將土壤水分含量控制在設定范圍內,重度干旱脅迫時長為15d;干旱處理15d后進行旱后的淹水脅迫處理,采用盆栽淹水法,即將花盆置入大的塑料周轉箱中,淹水過土面2~3cem,定時補水以保證水位,持續20d。試驗10盆為1個處理,重復3次,隨機排列。
1.3 測定項目與方法
分別于脅迫處理前(CK,0d)、干旱脅迫15d、旱后淹水脅迫3d和旱后淹水脅迫20d進行光合特性和葉綠素熒光參數的測定,并同時于上午采集植株上部成熟葉片進行生理指標的測定。
1.3.1 光合參數測定采用Li-6400便攜式光合分析儀進行測定。分別于晴天上午9:00-11:00,選取植株上部未被遮擋的成熟葉,在飽和光照度下完成60min的光誘導后,控制光合有效輻射(PAR)為800 μumol/(m2·s),開放氣路測定葉片凈光合速率(Pn)、蒸騰速率(Tr)、氣孔導度(Gs)等光合參數。每個測定重復5次,取平均值。并根據公式WUE=Pn/Tr,計算瞬時水分利用率(WUE)。
1.3.2 葉綠素熒光參數測定采用PAM-2100便攜式熒光儀(德國Walz公司產品)進行測定。選取待測植株上部功能葉,經過30min充分暗適應,用小于0.05 μmol/(m2·s)的測量光照射葉片,測得初始熒光(Fo),隨后施加飽和脈沖光[8000μmol/(m2·s),0.8s],測得最大熒光(Fm)。并由Fo、Fm計算暗適應葉片PSII最大光化學效率(Fv/Fm)[18]。
1.3.3 生理指標的測定葉綠素含量的測定采用乙醇丙酮混合液浸提法[19],丙二醛(MDA)含量的測定采用硫代巴比妥酸法[20],細胞膜相對透性的測定采用電導儀法[20],游離脯氨酸含量的測定采用酸性茚三酮法[20],可溶性糖的測定采用蒽酮比色法[20]超氧化物歧化酶(SOD)活性、過氧化氫酶(CAT)活性、過氧化物酶(POD)活性的測定采用試劑盒法,試劑盒由南京建成生物有限公司提供[21]。oooooo所需上清液均按李合生[20]的方法制備,按試劑盒說明書操作、比色,運用試劑盒提供的公式計算出SOD、POD、CAT活性。
1.4 數據分析
所有測定結果取平均值+標準差,采用SPSS 18.0軟件進行單因素方差分析,使用最小顯著差數法(LSD)比較差異顯著性,使用Excel 2003繪制圖表。
2 結果與分析
2.1 旱澇交替脅迫對杜鵑花葉片光合參數及水分利用率的影響
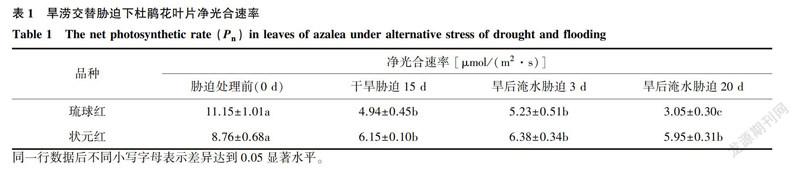
2.1.1 凈光合速率
由表1可以看出,旱澇交替脅迫下,2個杜鵑花品種葉片的凈光合速率均較CK顯著下降。其中,千旱脅迫15d,琉球紅和狀元紅分別較CK降低了55.70%和29.79%,旱后淹水脅迫20d則分別較CK降低了72.64%和32.07%。琉球紅P。下降幅度遠大于狀元紅。說明旱澇交替脅迫顯著抑制了杜鵑花葉片的碳同化能力,且對水分脅迫敏感的琉球紅受抑制程度更高。
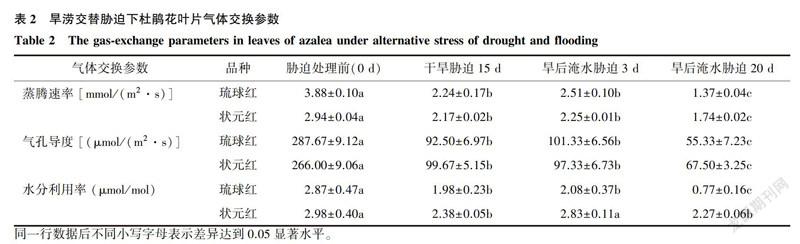
2.1.2 氣體交換參數
旱澇交替脅迫下2個杜鵑花品種葉片蒸騰速率、氣孔導度以及水分利用率的變化如表2所示。除旱后淹水脅迫3d處理下的狀,元紅的WUE外,旱澇交替脅迫下2個杜鵑花品種的Tr、Gs、WUE均顯著低于處理前(CK);均在旱后淹水脅迫20d達到最小值,其中琉球紅和狀元紅Tr,較CK分別降低了64.68%和40.82%,Gs較CK分別降低了80.77%和74.62%,WUE較CK分別降低了73.17%和23.82%。同一處理下3個指標的下降幅度均是琉球紅>狀元紅。說明旱澇交替脅迫抑制了杜鵑花葉片水分的蒸騰和利用效率,氣孔開度變小,使得體內水分運輸和代謝減緩,且隨脅迫時間的延長,對水分脅迫敏感的杜鵑花琉球紅受到的抑制作用更加明顯。
2.2 旱澇交替脅迫對杜鵑花葉片葉綠素熒光參數及葉綠素含量的影響
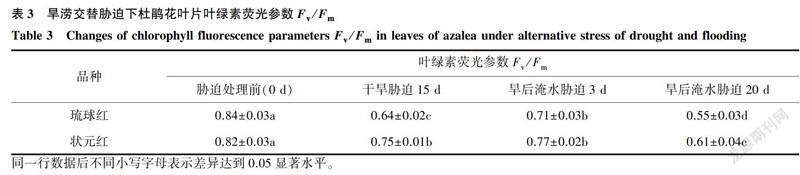
2.2.1 葉綠素熒光參數
最大光化學效率Fv/Fm可反映PSII反應中心捕獲激發能的效率與利用能力[22]。如表3所示,2個杜鵑花品種處理前Fv/Fm值分別為0.84、0.82,這與Genty等l23]報道的Fv/Fm在非脅迫條件下比較恒定,一般介于0.80~0.85相吻合,說明這2個杜鵑花品種生長狀態良好,未受脅迫,也從側面說明了其他熒光指標的可靠性。旱澇交替脅迫下,2個杜鵑花品種隨著脅迫時間的延續Fv/Fm均呈現先顯著下降后小幅度升高最后又顯著下降的趨勢,均與CK差異顯著。相同處理條件下,琉球紅Fv/Fm下降幅度大于狀元紅;旱后淹水脅迫20d,Fv/Fm降至最低,其中琉球紅Fv/Fm僅為對照的65.48%。說明旱澇交替脅迫下,杜鵑花PSII反應中心受到損傷,且隨脅迫時間的加長,PSII反應中心的損傷加大;同時也說明狀元紅較琉球紅而言,在旱澇交替脅迫處理下能維持較強的光化學活性。
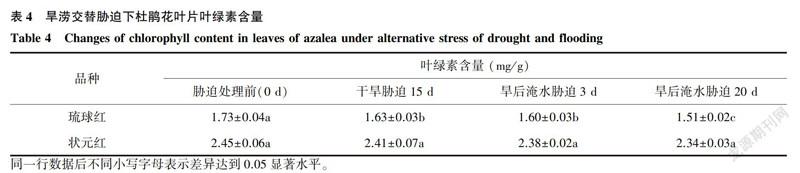
2.2.2 葉綠素含量
對葉綠素含量的測定結果顯示,琉球紅葉片葉綠素含量低于狀元紅(表4)。旱澇交替脅迫下,2個杜鵑花品種葉片葉綠素含量均呈現下降趨勢,但下降的幅度琉球紅>狀元紅。旱澇交替脅迫下琉球紅葉片葉綠素含量均顯著低于處理前,而狀元紅葉綠素含量與處理前差異不顯著。
同一脅迫處理條件下,琉球紅葉綠素含量相對值(即處理/對照)低于狀元紅。說明琉球紅葉片的葉綠素在干旱脅迫15d就開始迅速降解,而狀元紅葉片葉綠素基本不降解,也說明了琉球紅較狀元紅對水分脅迫反應敏感。
2.3 旱澇交替脅迫對杜鵑花葉片MDA含量和細胞膜相對透性的影響
2.3.1 MDA含量
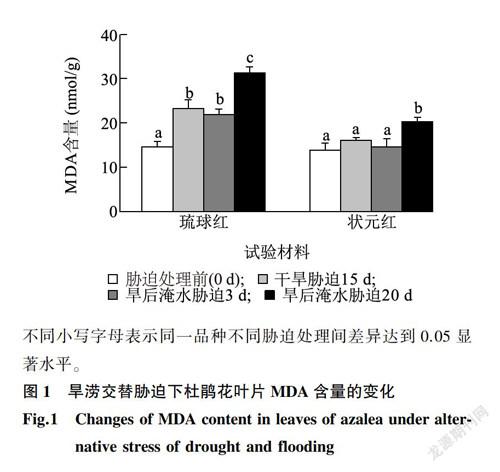
MDA含量的變化可以在一定程度上反映植物體內自由基的動態和細胞的受損程度,在衡量植物對逆境條件反應的強弱中廣泛應用[14]。由圖1可以看出,隨著旱澇交替脅迫時間的延長,2個杜鵑花品種MDA含量變化均呈現在千旱脅迫下增加,旱后淹水脅迫初期略有下降,旱后淹水末期上升的趨勢。琉球紅各處理MDA含量均較處理前顯著升高,而狀元紅則在旱后淹水脅迫末期與處理前差異顯著。相同處理條件下對水分脅迫敏感的杜鵑花琉球紅MDA上升的幅度大于抗性強的狀元紅。旱后淹水脅迫20d,琉球紅MDA含量為處理前的2.15倍,而狀元紅則為1.46倍。說明對水分脅迫敏感的琉球紅葉片細胞膜系統受到損傷的程度高于抗性強的狀元紅。
2.3.2 細胞膜相對透性
逆境條件下,植物葉片細胞膜相對透性常用葉片的相對電導率來表示。如圖2所示,旱澇交替脅迫下2個杜鵑花品種葉片的相對電導率變化趨勢與MDA相同。琉球紅各處理相對電導率均較處理前顯著升高,而狀元紅則在干旱脅迫15d以及旱后淹水脅迫末期與處理前差異顯著。同樣,相同處理條件下對水分脅迫敏感的琉球紅相對電導率上升的幅度大于抗性強的狀元紅。在旱后淹水脅迫20d時,琉球紅相對電導率為處理前的1.77倍,而狀元紅則為1.39倍。說明對水分脅迫敏感的琉球紅細胞膜透性受到的傷害大于抗性強的狀元紅。
2.4 旱澇交替脅迫對杜鵑花葉片有機滲透調節物質含量的影響
2.4.1 脯氨酸含量
脯氨酸是生物體氮代謝過程中產生的具有生物活性的次生代謝物質,作為重要的滲透調節物質,在逆境條件下,植物體內脯氨酸的含量可迅速增加,以增強植物對干旱、濕澇等逆境脅迫的抗性,故其含量的高低是植物抗逆性強弱的指標之一[24]o如圖3所示,旱澇交替脅迫下2個杜鵑花品種脯氨酸含量均隨脅迫時間的延長而增加,均與處理前差異顯著。其中,抗性較強的狀元紅在相同處理條件下脯氨酸較處理前增加的幅度明顯高于琉球紅。在旱后淹水脅迫20d,琉球紅脯氨酸為處理前的1.86倍,而狀元紅則為2.21倍。說明隨著旱澇交替脅迫的持續,狀元紅體內積累了更多的脯氨酸以增強其抗水分脅迫的能力。
2.4.2 可溶性糖含量
可溶性糖是植物體內的重要的有機滲透調節物質之一。如圖4所示,隨著旱澇交替脅迫時間的延長,2個杜鵑花品種葉片可溶性糖含量均呈現先較處理前顯著增加后降低的趨勢。在相同處理條件下對水分脅迫敏感的琉球紅可溶性糖含量上升的幅度均小于抗性強的狀元紅,下降幅度則大于狀元紅。旱后淹水脅迫初期,琉球紅和狀元紅可溶性糖含量均達到最大值,分別為處理前的1.29倍和1.71倍。旱后淹水脅迫末期琉球紅可溶性糖含量迅速下降,顯著低于處理前,而狀元紅可溶性糖含量雖然也呈下降趨勢.但仍顯著高于處理前可溶性糖含量。可見,旱澇交替脅迫下2個杜鵑花品種均可通過增加自身有機滲透調節物質的含量來抵御逆境,且增加量上以抗性強的狀元紅居高。
2.5 旱澇交替脅迫對杜鵑花葉片抗氧化酶活性的影響
2.5.1 SOD活性
如圖5所示,旱澇交替脅迫下2個杜鵑花品種SOD活性變化呈現不同趨勢。對水分脅迫敏感的杜鵑花琉球紅SOD活性均較處理前降低,除了旱后淹水脅迫3d,其他處理SOD活性均與處理前差異顯著。狀元紅SOD活性則隨脅迫時間的延長呈現先增加后降低的趨勢,在旱后淹水脅迫3d SOD活性達到最大,為處理前的1.22倍。說明旱澇交替脅迫下,對水分脅迫忍耐性較強的杜鵑花狀元紅在干旱脅迫和旱后淹水脅迫初期SOD活性顯著提高以清除活性氧,在旱后淹水脅迫后期狀元紅細胞膜雖受到一定的損傷但未超過SOD活性的忍耐限度,SOD仍具有較高的活性來清除氧自由基。
2.5.2 POD活性如圖5所示,2個杜鵑花品種葉片在旱澇交替脅迫下POD活性變化趨勢一致,均隨脅迫時間的增加呈現先上升后下降的趨勢,均在旱后淹水脅迫初期(旱后淹水3d)達到最大值,之后顯著下降。說明隨著旱澇交替脅迫時間延長(旱后淹水20d),POD活性受到了抑制。在相同處理條件下對水分脅迫抗性強的狀元紅POD活性上升的幅度大于敏感型的琉球紅,下降幅度則小于琉球紅,且狀元紅在旱澇交替脅迫試驗時間內POD活性均顯著高于處理前,說明抗性強的狀元紅在旱澇交替脅迫下亦具有較高的POD活性以清除氧自由基,以增強對旱澇交替脅迫的適應性。
2.5.3 CAT活性
如圖5所示,2個杜鵑花品種葉片在旱澇交替脅迫下CAT活性變化趨勢一致,均隨著旱澇交替脅迫時間的延長呈現先顯著上升,在旱后淹水3d達到最大值,之后顯著下降的趨勢。相同處理條件下,琉球紅CAT活性上升幅度低于狀元紅,旱后淹水3d,琉球紅CAT活性達到最大值,較處理前上升了28.31%,低于狀元紅(39.13%)。旱后淹水20d,琉球紅CAT活性下降的幅度(27.21%)大于狀元紅(22.50%),但與處理前差異不顯著,說明在旱澇脅迫后期,細胞膜受到損傷,2個杜鵑花CAT活性下降,但未超過CAT活性的忍耐限度。水分脅迫下,抗性強的狀元紅亦通過增強CAT活性來抵御過量的活性氧自由基造成的傷害。
3 討論
有關水分脅迫下植物光合生理特性的研究已有大量報道,逆境脅迫均導致光合作用下降[25-27]其中氣孔關閉,致使氣孔導度下降是澇害下絕大多數植物光合速率降低的主要原因;而葉綠體片層結構受損,使葉綠素含量下降、光系統II活力下降則是干旱下光合作用下降的主因[28-29]。但由于光合作用對水分脅迫響應存在復雜性,受植物本身基因型、水分脅迫程度的強弱以及其他環境因素的制約,得出的結論不盡相同[29-31]。本研究中,旱澇交替脅迫下,杜鵑花葉片的Pn、Tr、Gs、WUE、Fv/Fm均顯著下降,這與多數研究結果一致[21,30-32]同時,葉片葉綠素含量也呈下降趨勢,下降趨勢與Pn,相似。說明在旱澇交替脅迫下,氣孔因素與非氣孔因素均在2個杜鵑花品種的光合抑制中起作用。當然,關于旱澇交替脅迫下杜鵑花在光合限制中是氣孔因素還是非氣孔因素在先,尚有待于設置更細化的時間變量以及脅迫強度來證實。研究中,狀元紅葉片Pn、Tr、Gs、WUE、Fv/Fm和葉綠素含量較對照的下降幅度均小于琉球紅,說明在脅迫下保持葉綠素含量的穩定,維持一定水平的凈光合速率,有效保持PSII功能的相對完整性和相對較高的水分代謝能力,是旱澇雙抗型杜鵑花品種狀元紅抗性強的原因之一。
從遺傳角度看,植物的抗滲透脅迫功能是一種數量性狀,是由多基因控制的綜合反映,例如,在旱澇脅迫下,植物在遭受脅迫時膜脂過氧化導致MDA積累,膜流動性降低,膜透性增強,同時植物體內會通過積累一些可溶性糖、脯氨酸等可溶性物質來進行滲透調節[33]。本研究中,旱澇交替脅迫下,MDA含量和細胞膜相對透性較對照升高,可溶性糖含量隨脅迫時間先上升后下降,脯氨酸含量持續增加,這與前人研究結果相似[21,31]。相同脅迫條件下,狀元紅MDA含量和細胞膜透性增加的幅度顯著低于琉球紅,可溶性糖、脯氨酸含量增加幅度大,說明水分脅迫下抗性強的杜鵑花品種受到膜質過氧化傷害小,可積累較多的有機滲透調節物質,來調節植物細胞內滲透壓與外界平衡,維持滲透平衡和體內水分,以減輕脅迫所造成的傷害。
水分脅迫可誘導活性氧離子積累,導致植物體內活性氧代謝系統失去平衡,而植物在長期進化過程中形成了包括SOD、POD和CAT在內的膜脂抗氧化酶防御系統,可清除活性氧,以維持細胞膜的穩定性,保護細胞免受膜脂過氧化作用引起的傷害[11,21,31]。本研究中,3種抗氧化酶對旱澇交替脅迫的響應存在差異,說明杜鵑花在旱澇交替脅迫危害下各氧化酶防御系統之間存在協同作用的同時又有復雜的內在關系。相同脅迫條件下,琉球紅抗氧化酶活性上升的速度和幅度小于抗性強的狀元紅,下降幅度大于抗性強的狀元紅,說明在旱澇交替脅迫下,抗性強的杜鵑花品種通過保持膜系統處于相對完好的狀態,保持較高的抗氧化酶活性而增強植株的抗水分脅迫能力。
綜上所述,旱澇交替脅迫對杜鵑花葉片光合系統、抗氧化酶系統、滲透調節系統產生不同程度傷害,抗性弱的杜鵑花品種琉球紅受抑制程度更大;同時,杜鵑花也會通過一系列的生理特性的改變來主動適應逆境,以使旱澇脅迫對杜鵑花的抑制損傷降到最低。旱澇雙抗型杜鵑花品種狀元紅在脅迫下能保持葉綠素含量的穩定,維持一定水平的凈光合速率,保持膜系統處于相對完好的狀態,能保持較高的抗氧化酶活性以清除活性氧,較高的脯氨酸含量以維持滲透調節系統的穩定性是其抗性強的部分原因。因此,實際生產中可根據旱澇交替脅迫下光合系統抗氧化酶系統、滲透調節系統指標來選育旱澇雙抗性杜鵑花品種,并可通過提高杜鵑花葉片的Pn、葉綠素含量、脯氨酸含量、抗氧化酶活性等來提高旱澇交替脅迫條件下杜鵑花的耐受性。
參考文獻:
[1]吳志偉.長江中下游夏季風降水“旱澇并存、旱澇急轉"現象的研究[D].南京:南京信息工程大學,2006.
[2]閃麗潔,張利平,張艷軍,等.長江中下游流域旱澇急轉事件特征分析及其與ENSO的關系[J].地理學報,2018,73(1):25-40
[3]賴金莉,李欣欣,薛磊,等.植物抗旱性研究進展[J].江蘇農業科學,2018,46(17):23-27.
[4]謝宏偉,徐慶國,李陽.黑麥草高溫脅迫抗性與抗旱性遺傳育種研究進展[J].作物研究,2011,25(1):89-94.
[5]何靜丹,文仁來,田樹云,等.抽雄期干旱脅迫與復水對不同玉米品種生長及產量的影響[J].南方農業學報,2017,48(3):408-415.
[6]張麗麗,徐碧玉,劉菊華,等.MaASRI基因通過乙烯途徑提高擬南芥抗旱性的作用機制[J].江蘇農業學報,2018,34(3):511-519.
[7]生利霞,王倩,孟祥毅,等.植物耐澇分子機理研究進展[J].分子植物育種,2017,15(7):2823-2828.
[8]王忠.植物生理學[M].北京:中國農業出版社,2000.
[9]甄博,郭相平,陸紅飛,等.分蘗期旱澇交替脅迫對水稻生理特性的影響[J].灌溉排水學報,2017,36(5):36-40.
[10]劉曉青,蘇家樂,李暢,等.杜鵑在園林中的應用[J].現代園林,2013,10(10):37-40.
[11]張長芹.杜鵑花[M].北京:中國建筑工業出版社,2003.
[12]李波,吳月燕,崔鵬.水分脅迫對2種基因型杜鵑生理生化特性的影響[J].浙江農業學報,2011,23(5):988-994.
[13]柯世省,楊敏文.水分脅迫對云錦杜鵑抗氧化系統和脂類過氧化的影響[J].園藝學報,2007,34(5):1217-1222.
[14]黃承玲,陳訓,高貴龍.3種高山杜鵑對持續干旱的生理響應及抗旱性評價[J].林業科學,2011,47(6):48-55.
[15]李暢,蘇家樂,劉曉青,等.干旱脅迫對鹿角杜鵑種子萌發和幼苗生理特性的影響[J].西北植物學報,2015,35(7):1421-1427.
[16]高曉寧,趙冰,劉旭梅,等.4個杜鵑花品種對干旱脅迫的生理響應及抗旱性評價[J].浙江農林大學學報,2017,34(4):597-607.
[17]胡肖肖,唐字力,賈梅,等.干旱脅迫對13個杜鵑品種生理特性的影響[J].江蘇農業科學,2017,45(6):101-105.
[18]KOOTEN O V,SNELJ F H.The use of chlorophyll fluorescence nomenclature in plant stress physiology[J].Photosynthesis Research,1990,25:147-150.
[19]李暢,蘇家樂,劉曉青,等.一品紅不同品種葉片葉綠素熒光特性比較[J].園藝學報,2009,36(10):1519-1524.
[20]李合生.植物生理生化試驗原理和技術[M].北京:高等教育出版社,2006.
[21]白鵬,冉春艷,謝小玉.干旱脅迫對油菜蕾薹期生理特性及農藝性狀的影響[J].中國農業科學,2014,47(18):3566-3576.
[22]PAPAGEORGIOU E,GOVINDJEE G C.Chlorophyll a fluorescence:a signature of photosynthesis[J].Jourmal of Plant Physiology,2016,163(6):689-690.
[23]GENTY B,BRIANTAISJ M,BAKER N R.The relationship be-
tween the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochimica Biophysica Acta,1989,990:87-92.
[24]周軍,武金翠,杜寶明,等.4種藤本植物的抗旱性比較[J].江蘇農業學報,2016,32(3):674-679.
[25]尤超,沈虹,張營營,等.油桃生理特性對水分脅迫的響應[J].江蘇農業科學,2018,46(16):98-101.
[26]吳正花,喻理飛,嚴令斌,等.三葉木通葉片解剖結構和光合特征對干旱脅迫的響應[J].南方農業學報,2018,49(6):1156-1163.
[27]孔曉君,王恒,莊美琪,等.水分脅迫對茶樹葉片二氧化碳響應的影響[J].山東農業科學,2018,50(5):55-58,63.
[28]SHARP R E,POROYKO V,HEJLEK L G,et al.Root growth maintenance during water deficits:physiology to functional genomics[J].Journal of Experimental Botany,2004,55(407):2343-2351.
[29]柯世省,楊敏文.水分脅迫對云錦杜鵑光合生理和光溫響應的影響[J].園藝學報,2007,34(4):959-964.
[30]張斌斌,馬瑞娟,蔡志翔,等.3個桃砧木品種對淹水的光合生理響應特征[J].西北植物學報,2013,33(1):146-153.
[31]路之娟,張永清,張楚,等.不同基因型苦蕎苗期抗旱性綜合評價及指標篩選[J].中國農業科學,2017,50(17):3311-3322.
[32]劉廣勤,朱海軍,周蓓蓓,等.旱澇脅迫對薄殼山核桃光合特性和葉綠體超微結構的影響[J].江蘇農業學報,2012,28(6):1429-1433.
[33]SAKRARR K,DAS A.Changes in antioxidative enzymes and antioxidnats in relation to flooding tolerance in rice[J].Journal ofPlant Biology,2000,27(3):307-311.

