基于模型認知對溶液pH概念建構的教學探索
琚凱

【摘要】? 通過建立強弱電解質溶液微觀模型,幫助學生理解pH值與物質的量濃度這兩個概念之間的區別與聯系。
【關鍵詞】? 游戲教學 可視化教學 模型認知
【中圖分類號】? G633.8 ? ? ? ? ? ? ? 【文獻標識碼】? A ? ? 【文章編號】? 1992-7711(2019)21-169-02
溶液pH是人教版選修四第三章中一個非常重要的概念,單看pH的含義及計算公式,難度不大,但是一旦與弱電解質的概念結合,再與物質的量濃度概念攪和在一起,則學生特別容易混淆。究其原因,是由于學生沒有領悟弱電解質的電離特點、缺乏對pH含義的深刻理解、加上pH與物質的量濃度又都有表示濃度的相似點,導致學生學習起來困難重重。在這三點原因之中,最主要的還是學生對強弱電解質電離特點沒有理解透徹,如果再深究原因,是由于強弱電解質的電離方式只能通過實驗現象加推理得知,過程抽象,不夠直觀。
如何以恰當的教學方法和策略,克服化學知識的抽象性,突破學生的認知障礙,讓微觀變化可視化,是每一位化學教師要經常思考的問題。模型方法作為思維方法和行為方式,蘊涵著很高的認知價值,學生一旦將模型方法內化為自己的認知圖式,就能獲得認知水平的躍進。可視化教學增加了課堂教學中“視覺”比重,強調了對視覺的刺激,從學生單純地“聽課”,變為聽、看、動相結合,從教師單純地“講”,變為多種形式調動學生思維。因此,若能幫助學生建立強弱電解質電離微觀模型,使得微觀變化可視,則可以大大降低學生學習時的抽象思維的成分,同時又為學生對弱電解質電離的深度理解及抽象思維的形成奠定了基礎。
一、建立強弱電解質電離的微觀模型
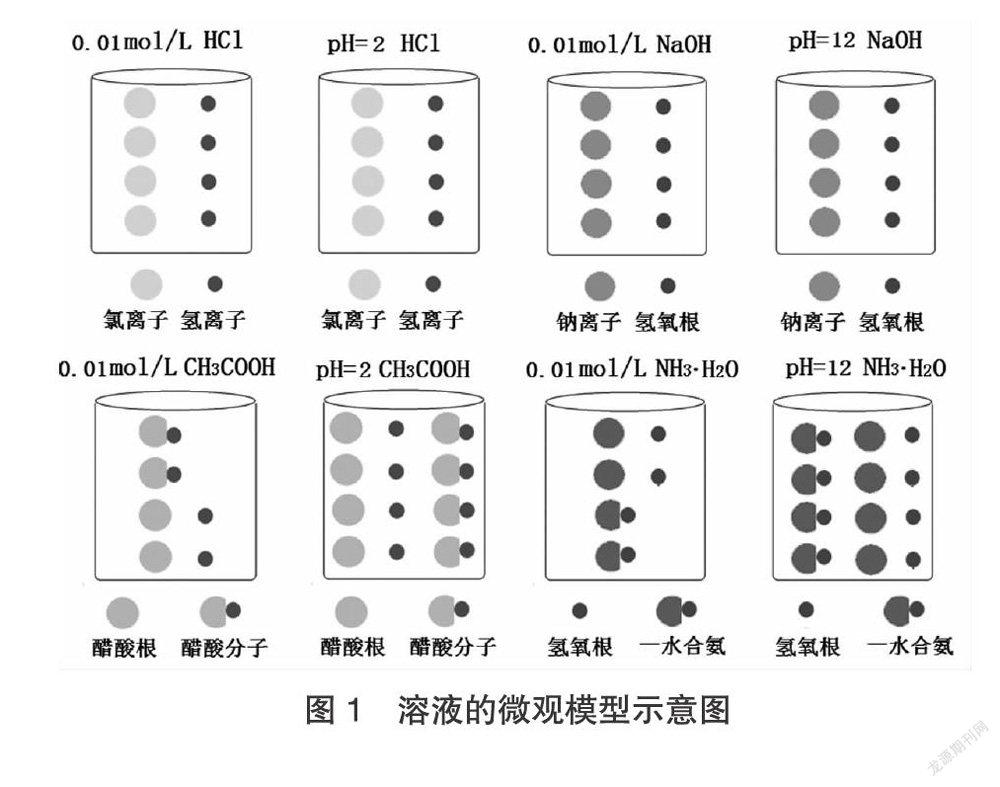
分別以室溫下的HCl,CH3COOH,NaOH,NH3·H2O溶液為例,建立與濃度、pH相關的電離模型,用圓圈表示溶液中的微觀粒子,電離模型如圖1。
為了學生更好的理解模型內涵,教師在闡述微觀模型的圖像中微粒所表達的意義后,要善于抓住核心概念,設置如下問題,引導學生思考交流。
問題1:對比0.01mol/LHCl與0.01mol/LCH3COOH的微觀模型,談談你對HCl與CH3COOH濃度理解;
問題2:對比pH=2的CH3COOH與0.01mol/LCH3COOH的微觀模型,談談你對pH的理解;
在問題1中,需要引導學生理解整體與局部之間的關系。鹽酸的濃度是0.01mol/L,若給出溶液體積為1L,讓學生計算HCl的物質的量,則學生很容易算出n(HCl)=0.01mol,因為學生在處理計算時,將HCl作為一個整體來思考;若是告知鹽酸溶液中C(H+)=0.01mol/L,C(Cl-)=0.01mol/L,問溶液中C(HCl)=?此時會有部分學生回答出0.02mol/L。說明學生沒有理清整體與局部之間的關系,對物質的量濃度概念的理解沒有深入到微觀層面。對于醋酸物質的量濃度的理解,較鹽酸又多了一個變量:部分電離。如果在此處不將濃度概念梳理清楚,學生會認為0.01mol/LCH3COOH代表的是溶液中未發生電離的CH3COOH濃度。在問題2中,學生雖然知道pH的計算公式為:pH=-lgC(H+),但是學生對公式中C(H+)的含義理解不夠透徹,學生理不清pH計算公式中的C(H+)的含義,盡管課堂上教師會強調這一點,但是學生腦海中對已電離的H+和未電離的H+缺乏模型認知,依然會分不清楚。這也說明,基于模型認知的教學非常有必要。
二、微觀模型再建與診斷
溶液微觀模型的建立,可以幫助學生從微觀視角去理解弱電解質溶液電離特點、溶液物質的量濃度與pH的含義,但目的不是停留于此,而應進一步幫助學生形成學會從微觀視角看待變化過程,最終是要讓學生從對模型的理解上升到抽象思維能力的形成。因此,引導學生從溶液的微觀角度出發建立溶液的微觀模型,這個過程不僅是對上面內容的理解與輸出,也能對學生微粒觀意識的形成起到推波助瀾的作用,同時,通過觀察學生建立的模型來診斷學生對弱電解質的電離、溶液的物質的量濃度與pH的認知水平。
因此,設置如下建模內容,如表1,其中pH=2CH3COOH、pH=12NH3·H2O的溶液微觀模型參考圖1,其余物質的微觀模型的建立以此為參考。
為了增強課堂教學的趣味性,可以把模型建立設計成教學游戲,小組比賽建模,再讓學生對彼此模型進行相互評價,以此驅動學生積極性,鍛煉學生的合作精神和溝通能力,培養學生實踐和創新能力。值得一提的是,上面的建模涉及到硫酸,需要引導學生從模型角度理解pH=2與物質的量濃度為0.01mol/LH2SO4之間的區別。
三、從有“型”到無“型”,完成對認知的飛躍
模型的建立是為了幫助理解過程的變化并解決實際問題,只有當學生將自己對原理的理解應用到實際問題的解決過程中,學生的思維才得以發展。從觀看微觀模型,到建立微觀模型,最終是要做到心中有“型”而紙上無需有“型”。最后一步轉變即是飛躍,也是本節課的最具升華價值的部分,教師應當為學生的思維發展設置好階梯。因此,設置如下例題,要求學生根據自己的理解,完成下列習題。
例題1:①等物質的量濃度的CH3COOH和HCl,分別與同濃度的NaOH中和,消耗NaOH的體積誰多?
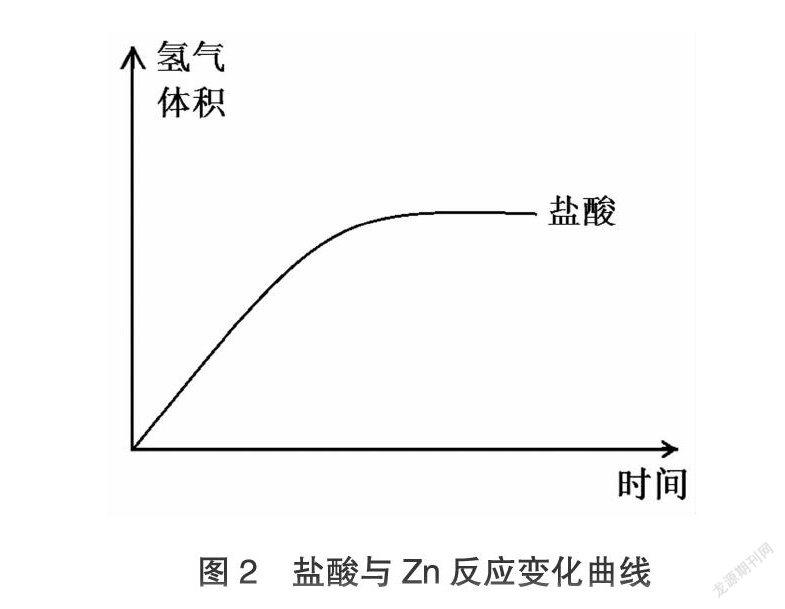
②等體積、等濃度的鹽酸與醋酸與足量的Zn反應,其中鹽酸與Zn反應生成氫氣的變化圖像如圖2,請畫出醋酸與Zn反應的變化曲線。
例題2:①等pH的CH3COOH和HCl,分別與同濃度的NaOH中和,消耗NaOH的體積誰多?
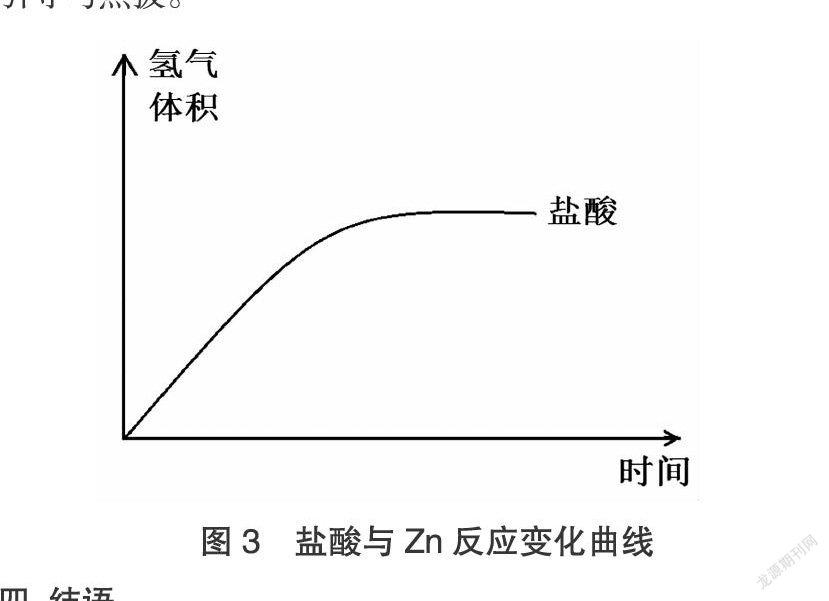
②等體積、等pH的鹽酸與醋酸與足量的Zn反應,其中鹽酸與Zn反應生成氫氣的變化圖像如圖3,請畫出醋酸與Zn反應的變化曲線。
例題3:室溫下,pH=2的CH3COOH和pH=12的NaOH反應后呈現中性,消耗CH3COOH體積為V1,消耗NaOH體積為V2?,則V1? ? ? ? ? ?V2(填“>”、“<”或“=”)。
在上面的習題中,除了微觀模型幫助學生建立的思維外,還涉及到了弱電解質在反應過程中電離平衡不斷的變化,這就是變化觀念與平衡思想,這是試題所包含的核心素養,教學時需要教師引導與點撥。
四、結語
通過微觀模型,讓學生感受微觀模擬真實情景,通過教師引導形成學生自己的認知方式,再用化學語言將變化反饋出來,并用于實際問題的解決,這正是化學學科核心素養想要傳達的精神。
但是溶液的微觀模型,歸根結底還是模型,不能代表真實的溶液,以醋酸為例,模型中醋酸的電離度高達50%,而實際上遠沒有這么大;其次溶液微觀模型中的粒子全部用圓圈表示,其大小比例以及形狀都和真實情況有區別。這些都要和學生說明。最后,運用模型進行教學,目的是要幫助學生最終形成抽象思維,但是模型帶給學生理解便利的同時也會限制他們的思維發展,這與模型的建立是否恰當有密切關系,所以在教學中選擇恰當的模型至關重要。
本文系廣東省教育學會2018年度教育科研規劃小課題《“三一”教學策略在高考備考中的應用研究》(立項號/結題號:GDXKT16337)的研究成果。
[ 參? 考? 文? 獻 ]
[1]張天民.微觀表征的可視化嘗試與思考[J].中學化學教學參考,2018(10):78.
[2]吳克勇,蔡子華.模型認知釋讀[J].中學化學教學參考,2017(17):11-14.
[3]陳維,張紅俊.高中化學可視化教學例談[J].化學教與學,2017(09):28-29.

