苯并噁唑衍生物PO-296對樹突狀細胞分化及相關指標的影響
朱薪穎 楊苗 徐燦 彭旭 段佳毅 劉丹 王衍堂
摘 要 目的:探討苯并噁唑衍生物2-(氯苯并噁唑基-2基)-4,5,6,7-四氫-二氫-吲唑-3-醇(PO-296)對小鼠骨髓來源樹突狀細胞(DC)分化及其特異性表面分子、炎癥細胞因子等相關指標的影響。方法:分離小鼠骨髓核細胞,以重組小鼠粒細胞巨噬細胞集落刺激因子和重組小鼠白細胞介素4刺激獲取未成熟DC(imDC);經低、中、高劑量(1、5、25 μmol/L)PO-296預處理后,以脂多糖誘導獲取DC。應用流式細胞術檢測DC特異性表面分子[即Ⅱ類主要組織相容性復合物(MHC Ⅱ)、CD80、CD86和趨化因子受體7(CCR7)陽性細胞比例]的表達以及imDC吞噬能力(即葡聚糖陽性細胞比例)和DC存活情況(即存活細胞比例),采用酶聯免疫吸附測定法檢測DC培養液中炎癥細胞因子[白細胞介素10(IL-10)、IL-12、腫瘤壞死因子α(TNF-α)]水平。結果:與imDC組比較,空載組MHC Ⅱ、CD80、CD86陽性細胞比例均顯著升高(P<0.05)。與空載組比較,PO-296各劑量組細胞培養液中IL-10水平均顯著升高,陽性組以及PO-296中、高劑量組細胞MHC Ⅱ、CD80、CD86陽性細胞比例以及各給藥組細胞培養液中IL-12、TNF-α水平均顯著降低(P<0.05);而各給藥組CCR7陽性細胞、葡聚糖陽性細胞和存活細胞比例與空載組比較,差異均無統計學意義(P>0.05)。結論:PO-296無明顯的細胞毒性,亦不影響imDC的吞噬功能;同時,該化合物可抑制DC特異性表面分子的表達,調控其炎癥細胞因子的分泌。
關鍵詞 PO-296;樹突狀細胞;特異性表面分子;炎癥細胞因子;吞噬功能;細胞毒性
ABSTRACT? ?OBJECTIVE: To investigate the effects of benzoxazole derivative 2-(chlorobenzoxazolyl-2-yl)-4,5,6,7-tetrahydro- dihydro-indazole-3-ol (PO-296) on the differentiation of murine bone marrow-derived dendritic cells(DC) and their related indexes as specific surface molecules and inflammatory cytokines. METHODS: Bone marrow nuclear cells of mice were isolated, and immature DC (imDC) was obtained by recombinant mice granulocyte macrophage colony-stimulating factor and recombinant mice IL-4. After pretreated with low-dose, medium-dose and high-dose (1, 5, 25 μmol/L) of PO-296, DC was obtained by lipopolysaccharide induction. Flow cytometry was used to detect the expression of DC specific surface molecules [i.e. the proportion of class Ⅱ major histocompatibility complex (MHC Ⅱ), CD80, CD86 and chemokine receptor 7 (CCR7) positive cells], imDC phagocytosis (i.e. the proportion of dextran positive cells) and DC survival (i.e. the proportion of survival cells). ELISA method was used to detect the levels of inflammatory cytokines (IL-10, IL-12 and TNF-α) in cell culture medium. RESULTS: Compared with imDC group, the proportion of MHC Ⅱ, CD80 and CD86 positive cells were increased significantly in non-loading group (P<0.05). Compared with non-loading group, the levels of IL-10 in cell culture medium were increased significantly in PO-296 groups. The proportions of MHC Ⅱ, CD80 and CD86 positive cells in positive group and PO-296 medium-dose and high-dose groups as well as the levels of IL-12 and TNF-α in cell culture medium in administration groups were decreased significantly (P<0.05). There was no statistical significance in the proportion of CCR7 positive cells, dextran positive cells and survival cells in administration groups, compared with non-loading group (P>0.05). CONCLUSIONS: PO-296 has no obvious cytotoxicity and does not affect the phagocytic function of imDC. At the same time, the compound can inhibit the expression of DC specific surface molecules and regulate the secretion of inflammatory cytokines.
KEYWORDS? ?PO-296; Dendritic cell; Specific surface molecules; Inflammatory cytokines; Phagocytic function; Cytotoxicity
樹突狀細胞(Dendritic cell,DC)作為機體內功能最強的抗原呈遞細胞,在表型和功能上均具有較強的可塑性,可直接活化幼稚T細胞,在誘導T細胞免疫應答或免疫耐受的過程中發揮了十分重要的作用[1-2]。有研究指出,DC表型、成熟度及功能的異質性是免疫反應平衡和免疫耐受的重要因素,其中成熟DC可表達高水平的共刺激分子,分泌T細胞刺激因子[如白細胞介素6(IL-6)、IL-12、IL-15、IL-18等],選擇性激活相應受者的T細胞,從而誘發免疫反應;而未成熟DC(imDC)則可表達低水平的共刺激分子,通過誘導T細胞無能、免疫偏離、T細胞凋亡或者調節性T細胞(Treg細胞)產生等途徑而形成免疫耐受[3]。藥物誘導的調節性樹突狀細胞(DCreg)更為穩定,不會因脂多糖(LPS)等抗原刺激而分化成熟,其經典表型和功能與imDC相似,可正常表達DC特征性抗原CD11c,而低水平表達共刺激分子;同時,其炎癥細胞因子IL-12、腫瘤壞死因子α(TNF-α)分泌水平降低,抗炎細胞因子IL-10分泌水平升高[4-5]。如,干擾素β(IFN-β)可干預體外培養的imDC分化成熟,抑制或減少其IL-12、干擾素γ(IFN-γ)的分泌,進而對輔助性T細胞1型(Th1)的極化起到負向調控作用;同時,IFN-β可刺激Treg細胞的增殖,該作用也是其對多發性硬化癥有效的原因之一[6]。目前,國內外研究團隊以過繼轉移自身抗原負載的DCreg干預膠原誘導的關節炎、實驗性自身免疫性腦脊髓炎以及炎性腸病等自身免疫性疾病動物模型為對象進行相關研究,發現DCreg可明顯減輕上述模型動物體內炎癥細胞浸潤程度以及炎癥活動度[7-10]。由于干預自身免疫性疾病動物模型所需DCreg的用量較大(約為1×107個/只)[11],因此建立獲取大量DCreg的有效方法無疑是其臨床應用的重要前提和基礎。本課題組前期通過對一系列小分子化合物的高通量篩選發現,苯并噁唑衍生物2-(氯苯并噁唑基-2基)-4,5,6,7-四氫-二氫-吲唑-3-醇(PO-296,結構式見圖1)可經Janus激酶3/信號轉導及轉錄激活因子5(Jak3/Stat5)信號通路顯著抑制活化的人T細胞增殖[12]。而近期研究發現,Jak3是DC成熟分化的關鍵調控因子,該因子缺陷的DC將無法在混合淋巴細胞反應中有效刺激抗原特異性T細胞的增殖[13-14]。因此,本研究擬初步探討PO-296是否可經Jak3/Stat5信號通路調控DC成熟分化、誘導DCreg的產生;同時,建立骨髓來源的DC體外誘導模型,在予以不同劑量的PO-296預處理后,檢測其特異性表面分子[Ⅱ類主要組織相容性復合物(MHC Ⅱ)、CD80、CD86、趨化因子受體7(CCR7)]以及炎癥細胞因子(IL-12、IL-10、TNF-α)的表達水平,以期為后續PO-296誘導DCreg對自身免疫疾病動物模型的體內干預研究提供更為完善和可靠的實驗依據。
1 材料
1.1 儀器
ACEA NovoCyte型流式細胞儀[艾森生物(杭州)有限公司];PowerWave XS型全波長酶標儀(美國BioTek公司);371型CO2培養箱、Sorvall型臺式高速離心機(美國Thermo Fisher Scientific公司);IX71型倒置顯微鏡(日本Olympus公司);Mini MACSTM型磁珠分選系統(德國Miltenyi公司);5424R型小型高速離心機(德國Eppendorf公司)。
1.2 藥品與試劑
PO-296原料藥(地奧集團成都藥業股份有限公司,批號:1711012-296,純度:≥98%);托法替尼對照品(陽性對照,美國Sigma公司,批號:PZ0017,純度:≥98%);重組小鼠粒細胞巨噬細胞集落刺激因子(rmGM-CSF)、重組小鼠白細胞介素4(rmIL-4)(美國Peprotech公司,批號分別為315-03、214-14);LPS、異硫氰酸熒光素(FITC)- 葡聚糖(美國Sigma公司,批號分別為L4516、53379);鏈霉親和素微球(德國Miltenyi公司,批號:130-048-102);熒光素標記的大鼠抗小鼠流式檢測抗體Brilliant violet 421-MHCⅡ(BV 421-MHCⅡ)、FITC- CD80、藻紅蛋白(PE)-CD86、Alexa Fluor 647-CCR7以及紅細胞裂解液(美國BioLegend公司,批號分別為107632、561954、553692、560766、420301);生物素(Biotin)-CD11c染色試劑、IL-10試劑盒、7-氨基放線菌素(7AAD)/PE-膜聯蛋白Ⅴ(Annexin Ⅴ)凋亡檢測試劑盒(美國BD Pharmingen公司,批號分別為117303、555157、559763);IL-6、TNF-α試劑盒(美國eBioscience公司,批號分別為BMS603-2、BMS607-3);RPMI 1640培養基(美國HyClone公司,批號:SH30809.01);胎牛血清(澳大利亞Bovogen公司,批號:50615);其余試劑均為分析純,水為雙蒸水。
1.3 動物
SPF級C57BL/6小鼠,雄性,6~8周齡,體質量21~23 g,由成都醫學院SPF實驗動物中心提供,動物使用許可證號:SYXK(川)2015-196。
2 方法
2.1 DC分離與培養
取雄性C57BL/6小鼠,以脫臼法處死,分離其雙側股骨,用磷酸鹽緩沖液(PBS,pH 7.2)反復吹打,制得骨髓細胞懸液,經200目篩網濾過后,以300×g離心5 min,棄去上清液,沉淀用紅細胞裂解液裂解,計數后用含10%胎牛血清、20 ng/mL rmGM-CSF、10 ng/mL rmIL-4的RPMI 1640培養基(以下簡稱“完全培養基”)重懸,調整細胞密度至1×106個/mL,接種于100 mm平皿(接種體積:10 mL)內,置于37 ℃、5%CO2培養箱(下同)中培養。于培養的第3、5天使用上述完全培養基進行半量換液(即吸出原培養基5 mL,再加入新培養基5 mL)。于培養的第7天收集細胞,加入Biotin-CD11c染色,結合鏈霉親和素微球后,借助磁珠分選系統篩選、純化后得到CD11c陽性imDC(CD11c+imDC)(經流式細胞儀檢測CD11c陽性細胞比例超過95%)。將上述經純化的CD11c+imDC重懸于完全培養基中,以1×106個/mL的密度按1 mL/孔重新接種于24孔板中,用最終質量濃度為0.1 μg/mL的LPS刺激24 h后,即得成熟DC(成熟DC在顯微鏡下呈現樹突樣特征,且經流式細胞儀檢測其MHCⅡ、CD80、CD86呈高表達)。
2.2 DC特異性表面分子檢測
采用流式細胞術檢測。取“2.1”項下經純化的CD11c+imDC適量,以1×106個/mL的密度按1 mL/孔接種于24孔板中,將細胞隨機分為imDC組、空載組、陽性組(托法替尼,1 μmol/L;劑量設置參考既往研究[14],為最大安全、有效劑量)以及PO-296低、中、高劑量組(1、5、25 μmol/L;劑量設置參考本課題組前期預試驗結果),每組設3個復孔。吸棄上清液,imDC組和空載組加入完全培養基1 mL,各給藥組加入含相應藥物的完全培養基1 mL。培養6 h后,除imDC組外,其余各組均加入最終質量濃度為0.1 μg/mL的LPS刺激24 h。收集細胞,以300×g離心5 min后,棄去上清液,沉淀用4 ℃預冷的PBS 1 mL清洗,以300×g離心5 min,沉淀分別加入BV 421-MHC Ⅱ、FITC-CD80、PE-CD86、Alexa Fluor 647-CCR7適量,于4 ℃避光孵育30 min,用4 ℃預冷的PBS 1 mL清洗,以300×g離心5 min,棄去上清液。細胞用PBS 200 μL重懸后,使用流式細胞儀檢測MHC Ⅱ、CD80、CD86和CCR7陽性細胞比例。上述試驗重復3次,數據采用NovoExpress 1.3.0軟件分析。
2.3 imDC吞噬功能檢測
采用流式細胞術檢測。取“2.1”項下經純化的CD11c+imDC適量,以1×106個/mL的密度按1 mL/孔接種于24孔板中,將細胞隨機分為空載組、陽性組以及PO-296低、中、高劑量組(劑量設置同“2.2”項),每組設3個復孔。吸棄上清液,空載組加入完全培養基1 mL,各給藥組加入含相應藥物的完全培養基1 mL。培養48 h后,各組均加入FITC-葡聚糖適量(使后者最終質量濃度為1 mg/mL),孵育60 min,經4 ℃預冷的PBS清洗后,采用流式細胞儀檢測imDC的抗原攝取能力(即其吞噬功能,以葡聚糖陽性細胞比例表示)。上述試驗重復3次,數據采用NovoExpress 1.3.0軟件分析。
2.4 DC存活情況檢測
采用流式細胞術檢測。取“2.1”項下經純化的CD11c+imDC適量,以1×106個/mL的密度按1 mL/孔接種于24孔板中,按“2.3”項下方法分組、給藥,培養6 h后,各組均加入最終質量濃度為0.1 μg/mL的LPS刺激48 h。收集細胞,按照7AAD/PE-Annexin Ⅴ凋亡檢測試劑盒說明書操作,采用流式細胞儀檢測存活DC細胞的比例(即7AAD/PE-Annexin Ⅴ雙陰性活細胞的比例)。上述試驗重復3次,數據采用NovoExpress 1.3.0軟件分析。
2.5 DC培養液中炎癥細胞因子水平檢測
采用酶聯免疫吸附測定法(ELISA)檢測。取“2.1”項下經純化的CD11c+imDC適量,以1×106個/mL的密度按1 mL/孔接種于24孔板中,按“2.3”項下方法分組、給藥,培養6 h后,各組均加入最終質量濃度為0.1 μg/mL的LPS刺激24 h。收集細胞培養液,參照相關試劑盒說明書,采用ELISA法以全自動酶標儀檢測各組細胞培養液中IL-10、IL-12、TNF-α水平。上述試驗重復3次。
2.6 統計學方法
采用Graphpad Prism 6.0軟件對數據進行統計分析。計量資料均以x±s表示,組間比較采用Dunnett’s t檢驗。P<0.05為差異有統計學意義。
3 結果
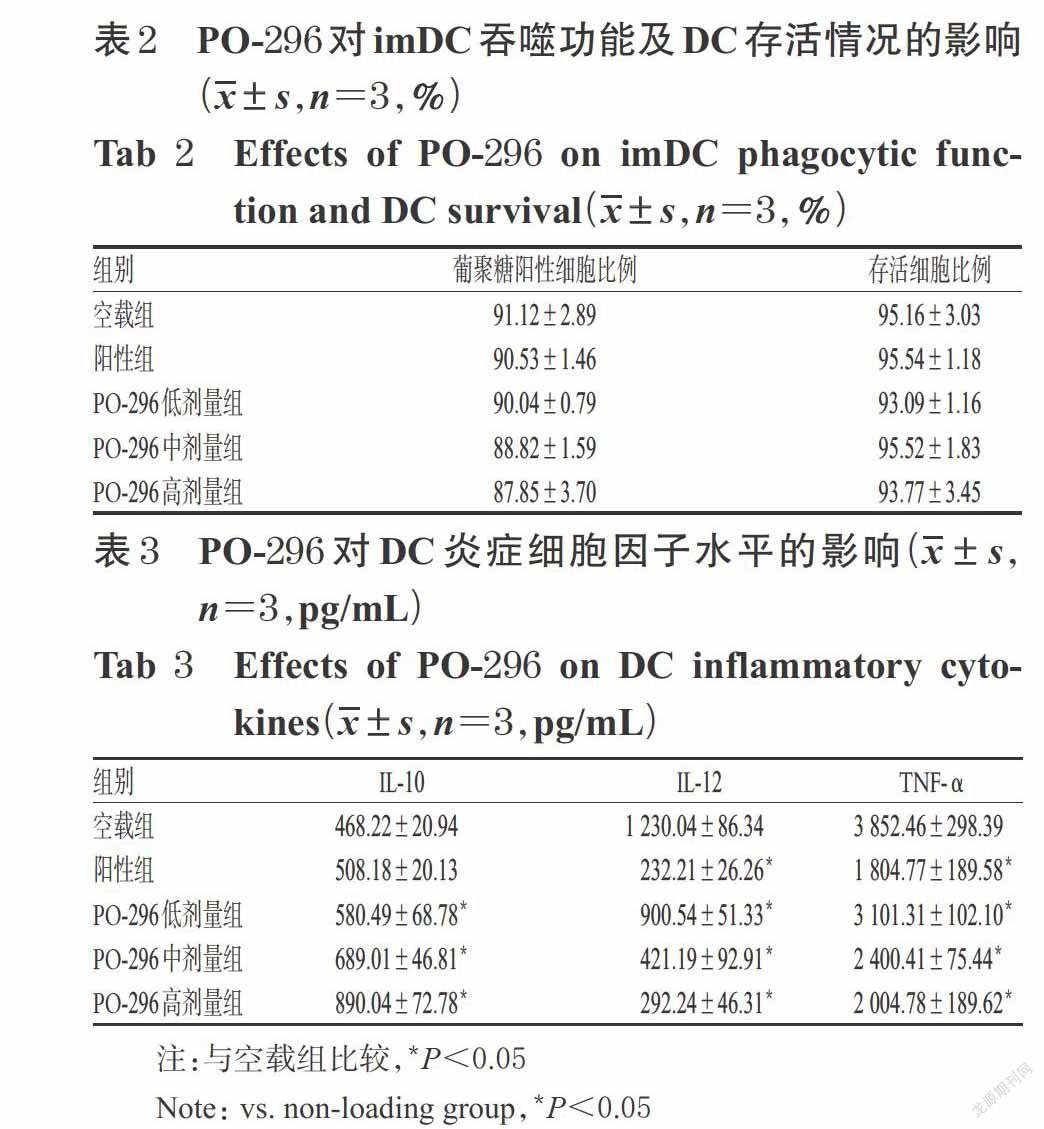
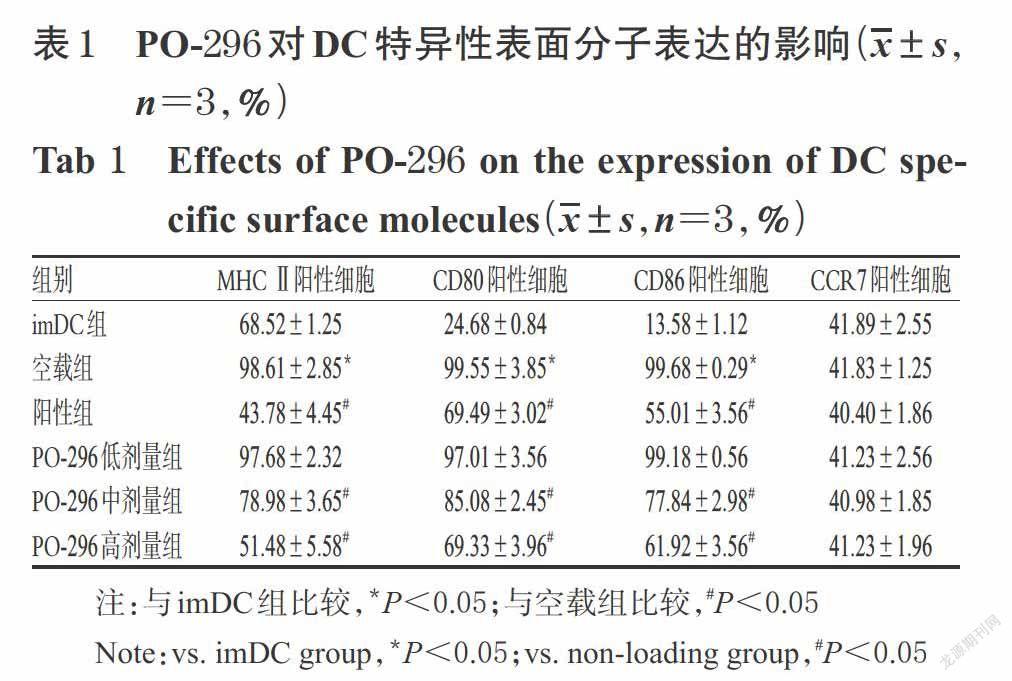
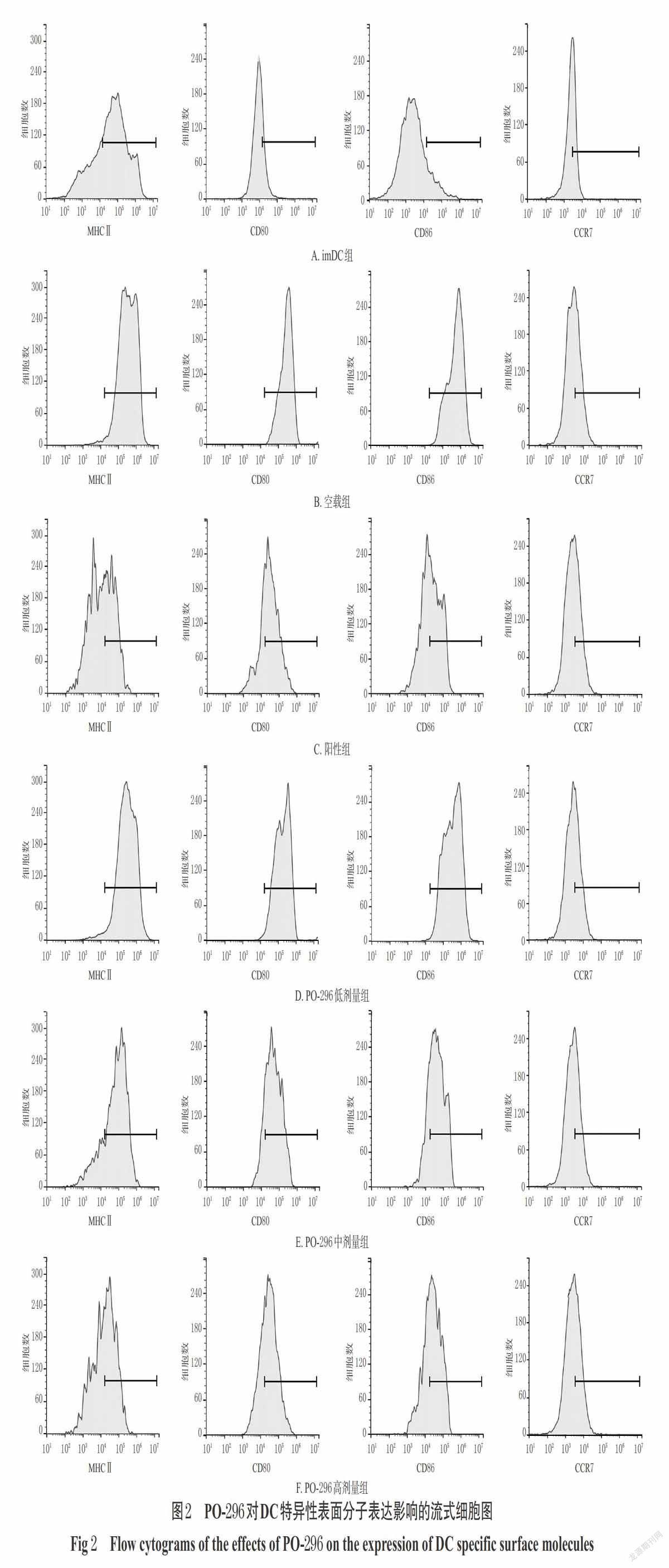
3.1 PO-296對DC特異性表面分子表達的影響
與imDC組比較,空載組MHC Ⅱ、CD80、CD86陽性細胞比例均顯著升高,差異均有統計學意義(P<0.05)。與空載組比較,陽性組以及PO-296中、高劑量組MHC Ⅱ、CD80、CD86陽性細胞比例均顯著降低,差異均有統計學意義(P<0.05);而空載組CCR7陽性細胞比例與imDC組比較,PO-296低劑量組MHC Ⅱ、CD80、CD86陽性細胞比例以及各給藥組CCR7陽性細胞比例與空載組比較,差異均無統計學意義(P>0.05),詳見圖2、表1。
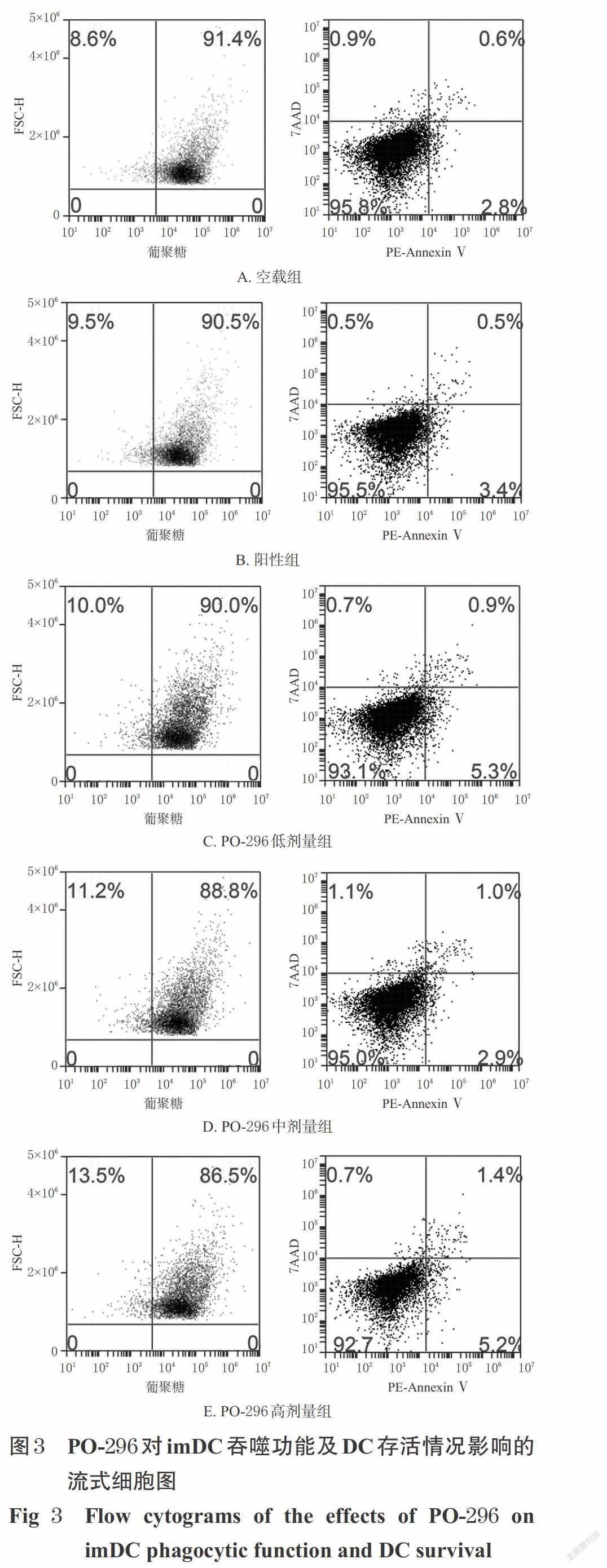
3.2 PO-296對imDC吞噬功能及DC存活情況的影響
各給藥組葡聚糖陽性細胞比例以及存活細胞比例與空載組比較,差異均無統計學意義(P>0.05),詳見圖3、表2。
3.3 PO-296對DC炎癥細胞因子水平的影響
與空載組比較,PO-296各劑量組細胞培養液中IL-10水平均顯著升高,各給藥組細胞培養液中IL-12、TNF-α水平均顯著降低,差異均有統計學意義(P<0.05),詳見表3。
4 討論
近年來,隨著細胞免疫治療在感染性疾病、自身免疫性疾病、腫瘤等領域的快速發展,DC已逐漸成為過繼轉移治療研究的熱點。因自身免疫性疾病相關的自身抗原尚不明確,在臨床試驗中DCreg不能負載有效的自身抗原,從而誘導自身抗原特異性T細胞耐受,因此無法重復DCreg對動物疾病模型的干預效果[4,15]。而新近發現和鑒定的自身抗原(如尋常性天皰瘡相關的Desmoglein-3;多發性硬化相關的B-crystallin、Anoctamin 2和KIR4.1等)為DCreg過繼轉移治療自身免疫性疾病帶來了新的希望[16-17]。繼往獲取DCreg的主要手段包括免疫抑制劑類藥物誘導[18]、細胞凋亡分子表達[19]、細胞因子培養體系建立[20]以及基因工程技術等[21],但現有臨床試驗的某些免疫抑制類誘導藥物(如阿司匹林、N-乙酰半胱氨酸以及環孢素A等)誘導的DCreg特異性較差,細胞毒性較大,且上述方法存在研究成本較高、周期較長等缺點,導致其后續深入研究受到了一定的限制[22]。因此,亟需尋找安全、高效的DCreg新型小分子誘導藥物。
本課題組前期對抑制T細胞增殖的小分子化合物進行了篩選,發現了一系列具有抑制活性的苯并噁唑衍生物。其中,PO-296可經Jak3/Stat5信號通路有效抑制人T細胞增殖,是一種新型的免疫抑制劑[12]。而近期國外研究發現,Jak3在DC的分化成熟過程中非常重要,當胞外配體與DC膜受體結合后可激活Jak3,繼而引起Stat5的酪氨酸磷酸化,啟動下游的一系列炎癥細胞因子(如IL-10、IL-12、TNF-α)和共刺激分子(如,即特異性表面分子MHC Ⅱ、CD80和CD86)的轉錄,從而發揮對T細胞增殖的抑制作用[13-14]。因此,本課題組推測PO-296有可能經Jak3/Stat5信號通路調控DC的成熟分化,并誘導免疫耐受的發生。托法替尼由美國Pfizer公司研發,并于2012年11月獲美國FDA批準上市,對Jak3/Stat5信號通路具有明顯的抑制作用,故本研究將其作為陽性對照藥物[14]。
本研究以骨髓來源的DC體外誘導模型為對象,初步探討了經PO-296預處理后DC特異性表面分子MHC Ⅱ、CD80、CD86、CCR7以及炎癥細胞因子IL-10、IL-12、TNF-α的表達情況。其中,MHC Ⅱ是DC向輔助T細胞呈遞自身抗原肽的關鍵分子,CD80、CD86則是DC活化自反應性T細胞的重要共刺激分子,三者的表達水平在DC成熟分化后均明顯升高,是DC成熟分化的重要標志物[4]。CCR7是成熟DC和imDC重要的趨化因子受體,與DC的歸巢以及其向非淋巴組織的遷移密切相關[3]。此外,成熟DC通過分泌IL-12、TNF-α等炎癥細胞因子來調控Th1的分化以及自身免疫性炎癥反應的發生[6]。而IL-10則是重要的免疫負調控因子,可抑制單核巨噬細胞炎癥細胞因子的分泌以及自身免疫性T細胞的增殖活化[23]。本研究結果顯示,空載組MHC Ⅱ、CD80、CD86陽性細胞比例均較imDC顯著升高;經藥物預處理后,PO-296各劑量組細胞培養液中IL-10水平均較空載組顯著升高,陽性組以及PO-296中、高劑量組細胞MHC Ⅱ、CD80、CD86陽性細胞比例以及各給藥組細胞培養液中IL-12、TNF-α均較空載組顯著降低;而各給藥組CCR7陽性細胞比例均未見顯著差異。這提示該化合物誘導的DC呈現出經典的DCreg表型[4-5],且所得DCreg在抗原呈遞及共刺激作用明顯增強的同時,其趨化因子受體的表達并未受到明顯影響,該DCreg可正常趨化轉移至炎癥組織以發揮免疫調控作用[3]。
本研究還考察了PO-296對imDC吞噬功能(imDC表達低水平的共刺激因子,刺激T細胞免疫應答的能力較低,但具有極強的抗原吞噬能力,因此吞噬功能的考察主要以imDC為主[3])及DC存活情況的影響。結果顯示,經不同劑量PO-296預處理后,DC葡聚糖陽性細胞比例以及存活細胞比例與空載組比較差異均無統計學意義。這提示不同劑量的PO-296不會影響imDC的吞噬功能,且無明顯細胞毒性,證實PO-296對DC成熟分化的干預作用與藥物影響DC抗原攝取和細胞毒性無關。
綜上所述,苯并噁唑衍生物PO-296無明顯的細胞毒性,亦不影響imDC的吞噬功能,同時其可抑制特異性表面分子的表達,調控炎癥細胞因子的分泌,繼而誘導DCreg的形成。這一發現為PO-296誘導的DCreg在負載自身抗原后對自身免疫性疾病動物模型的干預研究提供了實驗依據。未來本課題組將深入探討PO-296誘導的DCreg干預自身免疫性疾病發生發展的過程,以及其免疫調控作用的具體機制,為其在免疫耐受以及自身免疫性疾病治療中的應用奠定基礎。
參考文獻
[ 1 ] SOZZANI S,DEL PRETE A,BOSISIO D. Dendritic cell recruitment and activation in autoimmunity[J]. J Autoimmun,2017. DOI:10.1016/j.jaut.2017.07.012.
[ 2 ] HUBER A,DAMMEIJER F,AERTS JGJV,et al. Current state of dendritic cell-based immunotherapy:opportunities for in vitro antigen loading of different DC subsets? [J]. Front Immunol,2018. DOI:10.3389/fimmu.2018.02804.
[ 3 ] BU N,WU HQ,ZHANG GL,et al. Immature dendritic cell exosomes suppress experimental autoimmune myasthenia gravis[J]. J Neuroimmunol,2015. DOI:10.1016/j.jneuroim.2015.04.009.
[ 4 ] RA?CH-REGUé D,GLANCY M,THOMSON AW. Regulatory dendritic cell therapy:from rodents to clinical application[J]. Immunol Lett,2014,161(2):216-221.
[ 5 ] MASCARELL L,AIROUCHE S,BERJONT N,et al. The regulatory dendritic cell marker C1q is a potent inhibitor of allergic inflammation[J]. Mucosal Immunol,2017,10(3):695-704.
[ 6 ] CHEN M,CHEN G,DENG S,et al. IFN-β induces the proliferation of CD4+CD25+Foxp3+ regulatory T cells through upregulation of GITRL on dendritic cells in the treatment of multiple sclerosis[J]. J Neuroimmunol,2012. DOI:10.1016/j.jneuoim.2011.10.014.
[ 7 ] JAUREGUI-AMEZAGA A,Cabezón R,Ramírez-Morros A,et al. Intraperitoneal administration of autologous tolerogenic dendritic cells for refractory Crohn’s disease:a phase Ⅰ study[J]. J Crohns Colitis,2015,9(12):1071-1078.
[ 8 ] STOOP JN,HARRY RA,VON DELWIG A,et al. Therapeutic effect of tolerogenic dendritic cells in established collagen-induced arthritis is associated with a reduction in Th17 responses[J]. Arthritis Rheum,2010,62(12):3656- 3665.
[ 9 ] GROSS CC,JONULEIT H,WIENDL H. Fulfilling the dream:tolerogenic dendritic cells to treat multiple sclerosis[J]. Eur J Immunol,2012,42(3):569-572.
[10] NING B,WEI J,ZHANG A,et al. Antigen-specific tolerogenic dendritic cells ameliorate the severity of murine collagen-induced arthritis[J]. PLoS One,2015. DOI:10.1371/journal.pone.0131152.
[11] PRICE S. Therapeutic effects of tolerogenic dendritic cells[J]. Nat Rev Rheumatol,2010. DOI:10.1038/nrrheum.2010.
184.
[12] LUO XY,ZHOU H,WANG SY,et al. A benzoxazole derivative PO-296 inhibits T lymphocyte proliferation by the JAK3/STAT5 signal pathway[J]. J Cell Biochem,2019,120(6):9193-9202.
[13] RIVAS-CAICEDO A,SOLDEVILA G,FORTOUL TI,et al. Jak3 is involved in dendritic cell maturation and CCR7-dependent migration[J]. PLoS One,2009. DOI:10.1371/journal.pone.0007066.
[14] ZHOU Y,LENG X,LUO S,et al. Tolerogenic dendritic cells generated with tofacitinib ameliorate experimental autoimmune encephalomyelitis through modulation of Th17/treg balance[J]. J Immunol Res,2016. DOI:10.1155/2016/5021537.
[15] KHAN S,GREENBERG JD,BHARDWAJ N. Dendritic cells as targets for therapy in rheumatoid arthritis[J]. Nat Rev Rheumatol,2009,5(10):566-571.
[16] BRICKSHAWANA A,HINSON SR,ROMERO MF,et al. Investigation of the KIR4.1 potassium channel as a putative antigen in patients with multiple sclerosis:a comparative study[J]. Lancet Neurol,2014,13(8):795-806.
[17] ELLEBRECHT CT,BHOJ VG,NACE A,et al. Reengineering chimeric antigen receptor T cells for targeted therapy of autoimmune disease[J]. Science,2016,353(6 295):179-184.
[18] HACKSTEIN H,THOMSON AW. Dendritic cells:emerging pharmacological targets of immunosuppressive drugs[J]. Nat Rev Immunol,2004,4(1):24-34.
[19] BUONOCORE S,FLAMAND V,GOLDMAN M,et al. Bone marrow-derived immature dendritic cells prime in vivo alloreactive T cells for interleukin-4-dependent rejection of major histocompatibility complex class Ⅱ antigen-disparate cardiac allograft[J]. Transplantation,2003,75(3):407-413.
[20] GAO J,WANG X,WANG Y,et al. Murine sertoli cells promote the development of tolerogenic dendritic cells:a pivotal role of galectin-1[J]. Immunology,2016,148(3):253-265.
[21] ROHN TA,BOES M,WOLTERS D,et al. Upregulation of the CLIP self peptide on mature dendritic cells antagonizes T helper type 1 polarization[J]. Nat Immunol,2004,5(9):909-818.
[22] YOSHIMURA S,BONDESON J,BRENNAN FM,et al. Role of NF-κB in antigen presentation and development of regulatory T cells elucidated by treatment of dendritic cells with the proteasome inhibitor PSI[J]. Eur J Immunol,2001,31(6):1883-1893.
[23] ZHOU Y,LENG X,LI H,et al. Tolerogenic dendritic cells induced by BD750 ameliorate proinflammatory T cell responses and experimental autoimmune encephalitis in mice[J]. Mol Med,2017. DOI:10.2119/molmed.2016.
?(收稿日期:2019-01-07 修回日期:2019-06-14)
(編輯:張元媛)

