二苯乙烯苷對岡田酸致NG108-15細胞Tau蛋白磷酸化的影響
譚俊杰 吳文雪 廖艷花 蘇彥兆 李振中 黃健 黃忠仕


摘 要 目的:觀察二苯乙烯苷(TSG)對岡田酸(OA)誘導致NG108-15細胞Tau蛋白磷酸化的影響,探討該化合物抗阿爾茨海默病(AD)的可能機制。方法:以OA誘導NG108-15細胞復制AD細胞模型,采用MTT法檢測經TSG低、中、高劑量(50、100、200 μmol/L)預處理后的細胞存活率,采用吖啶橙/溴乙錠雙染色法檢測細胞凋亡情況,采用Western blotting法和逆轉錄-聚合酶鏈反應法檢測細胞周期蛋白依賴性激酶5(CDK5)、糖原合成酶激酶3β(GSK3β)蛋白及其mRNA以及Tau、磷酸化Tau(p-Tau)蛋白的表達情況,采用免疫熒光法檢測CDK5、GSK3β、Tau蛋白的分布情況。結果:正常對照組細胞形態正常,未見或少見CDK5、GSK3β、Tau蛋白分布。模型組可見固縮或圓珠狀的早期凋亡細胞,且CDK5、GSK3β、Tau蛋白分布明顯增多,其細胞存活率顯著降低,CDK5、GSK3β蛋白及其mRNA的相對表達量以及p-Tau與Tau相對表達量的比值(p-Tau/Tau)均顯著升高(P<0.05或P<0.01)。經TSG預處理后,各給藥組早期凋亡細胞和CDK5、GSK3β、Tau蛋白分布均有所減少,其細胞存活率均顯著升高,中、高劑量組細胞CDK5蛋白、p-Tau/Tau以及各劑量組細胞CDK5 mRNA、GSK3β蛋白及其mRNA的相對表達量均顯著降低(P<0.05)。結論:TSG對AD模型細胞具有一定的保護作用,這種作用與其提高細胞存活率,下調磷酸激酶CDK5、GSK3β的蛋白表達和基因轉錄水平,抑制Tau蛋白的磷酸化有關。
關鍵詞 二苯乙烯苷;NG108-15細胞;阿爾茨海默病;Tau蛋白;磷酸化;周期蛋白依賴性激酶5;糖原合成酶激酶3β
ABSTRACT? ?OBJECTIVE: To observe the effects of stilbene glycosidec (TSG) on okadaic acid (OA)-induced Tau protein phosphorylation in NG108-15 cells, and to investigate the potential anti-Alzheimer’s disease (AD) mechanism of this compound. METHODS: AD model of NG108-15 cells was induced by OA. The survival rate of NG108-15 cells was observed by MTT assay after pretreated with low-dose, medium-dose and high-dose of TSG (50, 100, 200 μmol/L). The apoptosis of NG108-15 cells was detected by AO/EB double fluorescence staining. The protein and mRNA expression of CDK5 and GSK3β, and the protein expression of Tau and p-Tau were detected by Western blotting assay and RT-PCR. The distribution of CDK5, GSK3β and Tau protein were detected by immunofluorescence. RESULTS: The normal morphology of NG108-15 cells was observed in normal control group, but CDK5, GSK3β and Tau protein were not found or few was found. Contracted or globular early apoptotic cells were observed in model gorup; the distribution of CDK5, GSK3β and Tau protein was increased, while survival rate of the cells was decreased; protein and mRNA expression of CDK5 and GSK3β as well as ratio of the relative expression of p-Tau to that of Tau (p-Tau/Tau) were all increased significantly (P<0.05 or P<0.01). After pretreatment of TSG, the distribution of early apoptotic cells as well as CDK5, GSK3β and Tau protein were all decreased to some extent in administration groups, while survival rates of the cells were increased significantly. Protein expression of CDK5 and p-Tau/Tau in medium-dose group and high-dose group as well as mRNA expression of CDK5, protein and mRNA expression of GSK3β in administration group were decreased significantly (P<0.05). CONCLUSIONS: TSG can protect against AD model cells, the effects of which may be associated with improving survival rate of the cells, down-regulating the protein expression and gene transcription level of phosphokinase CDK5 and GSK3β, inhibiting Tau protein phosphorylation.
KEYWORDS? ?Stilbene glycoside; NG108-15 cells; Alzheimer’s disease; Tau protein; Phosphorylation; CDK5; GSK3β
阿爾茨海默病(Alzheimer’s disease,AD)亦稱老年性癡呆,是一種以近期記憶障礙為主要臨床癥狀,β淀粉樣蛋白沉積致老年斑、Tau蛋白過度磷酸化致神經元纖維纏結以及神經元丟失伴膠質細胞增生為特征性病理改變的一種進行性神經退行性疾病[1]。其中,Tau蛋白為一種磷酸蛋白,其磷酸化程度是體內多種磷酸化特異性蛋白激酶和脫磷酸化蛋白磷酸酶相互作用平衡的結果[2]。在正常情況下,大部分Tau蛋白是不會被磷酸化的,但在AD或其他Tau病變(如進行性核上性麻痹、慢性創傷性腦病[3-4]等)患者大腦中,Tau蛋白被過度磷酸化[5]。由此可見,Tau蛋白磷酸化異常在AD的發病機制中發揮了重要的作用,調節Tau蛋白表達及其磷酸化水平可能成為干預AD進展的有效手段之一。
2,3,5,4′-四羥基二苯乙烯-2-O-β-D-葡萄糖苷是一種多羥基酚類化合物,簡稱二苯乙烯苷(TSG)。該化合物分子式為C20H22O9,分子量為406.39,是中藥何首烏的主要生物活性成分[6]。有研究指出,TSG具有保護神經、提高學習記憶力、抗衰老、防治AD、舒張血管、保護肝臟、降血脂、抗炎、抗腫瘤等藥理活性[7]。本研究通過岡田酸(OA)誘導致NG108-15細胞Tau蛋白異常磷酸化,模擬AD的發病機制以建立AD細胞模型,考察了TSG對AD發病關鍵物質Tau蛋白及其磷酸化水平的影響,以期揭示該化合物抗AD的作用機制,為其臨床應用提供實驗依據和理論支持。
1 材料
1.1 儀器
3111型CO2細胞培養箱、Nanodrop3000型微量核酸蛋白分析儀、Micro17R型高速冷凍離心機(美國Thermo Fisher Scientific公司);Spectra Max Plus 384型連續光譜掃描式酶標儀(香港分子儀器公司);7300型實時熒光定量聚合酶鏈反應(PCR)儀(美國ABI公司);CKX-41型熒光倒置顯微鏡(日本Olympus公司);Odyssey SA型雙色紅外熒光掃描成像系統(美國LI-COR公司)。
1.2 藥品與試劑
TSG對照品(批號:#017M4703V,純度:≥98%)、OA(批號:#SLBS1501V)均購自美國Sigma公司;DMEM高糖培養基(美國Gibco公司,批號:8116486);胎牛血清(澳大利亞AusGenex公司,批號:FBSSA00418-2);MTT試劑(合肥白鯊生物科技有限公司,批號:2016106);兔源Tau多克隆抗體(批號:00036062)、兔抗小鼠周期蛋白依賴性激酶5(CDK5)單克隆抗體(批號:00032730)、兔抗小鼠糖原合成酶激酶3β(GSK3β)單克隆抗體(批號:00041503)、兔抗小鼠β-肌動蛋白(β-actin)單克隆抗體(批號:00057922)均購自美國Proteinech Group公司;兔抗小鼠磷酸化Tau(p-Tau)單克隆抗體(美國Cell Signaling公司,批號:1);山羊抗兔IgG二抗(美國Thermo Fisher Scientific公司,批號:C70620-05);Western一抗稀釋液(批號:082118180821)、Western二抗稀釋液(批號:061418180703)均購自碧云天生物技術公司;Trizol試劑(批號:AA7101-1)、PCR試劑盒(含TBⅡ? Premix Ex TaqⅡ、ROX Reference Dye等試劑,批號:AI1777A)、逆轉錄試劑盒(批號:AI12361A)均購自寶生物工程(大連)有限公司,CDK5、GSK3β、甘油醛-3-硫酸脫氫酶(GAPDH)擴增引物均由寶生物工程(大連)有限公司設計、合成;十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)蛋白上樣緩沖液(上海雅酶生物科技有限公司,批號:2017042415);磷酸酶抑制劑(北京康為世紀生物科技公司,批號:20351);抗熒光淬滅封片劑[生工生物工程(上海)股份有限公司,批號:D105FA0005];青鏈霉素混合液(批號:20170929)、胰蛋白酶消化液(批號:20181109)、RIPA高效快速裂解液(批號:20171021)、苯甲基磺酰氟(PMSF)(批號:20161025)、吖啶橙/溴乙錠(AO/EB)染色試劑(AO、EB試劑體積比為1 ∶ 1,批號:20161029)、Triton X-100試劑(批號:524A0510)、封閉用山羊血清(BSA,批號:1206C052)、4′,6-聯脒-2-苯基吲哚(DAPI)試劑(批號:20170927)均購自北京索萊寶科技有限公司;其余試劑均為分析純,水為純化水。
1.3 細胞
大、小鼠神經瘤混合細胞NG108-15購自廣州新晉生物科技有限公司。
2 方法
2.1 細胞培養與傳代
將NG108-15細胞用含10%胎牛血清、1%青鏈霉素混合液的DMEM高糖培養基(以下簡稱“完全培養基”)于37 ℃、5%CO2培養箱中培養(培養條件下同),每天觀察細胞生長狀態。待細胞融合至85%后,用胰蛋白酶消化、吹打,以800 r/min離心5 min,棄去上清液,沉淀加入完全培養基適量,反復吹打使之成為單細胞懸液,并分裝至2~3個培養瓶中,繼續培養。
2.2 AD細胞模型復制
采用OA誘導。取對數生長期的NG108-15細胞適量,以適宜密度接種至培養板中,培養24 h。吸棄上清液,用磷酸鹽緩沖液(PBS,pH 7.4,下同)清洗3次后,加入以完全培養基配制的80 nmol/L OA溶液(濃度根據本課題組前期預試驗結果確定),繼續培養24 h以復制AD細胞模型。
2.3 細胞增殖情況檢測
采用MTT法檢測。取對數生長期的NG108-15細胞適量,以6×104個/孔接種于96孔板中,培養24 h。將細胞隨機分為正常對照組、模型組和TSG低、中、高劑量組(50、100、200 μmol/L,劑量設置參考本課題組前期預試驗結果),每組設5個復孔。吸棄各孔上清液,正常對照組加入完全培養基1 mL,各給藥組加入含相應藥物的完全培養基1 mL,繼續培養24 h。除正常對照組外,其余各組均按“2.2”項下方法復制AD細胞模型。隨后每孔加入5 mg/L的MTT溶液10 μL,避光孵育4 h,棄去上清液,每孔加入二甲基亞砜100 μL,室溫振蕩10 min,使用連續光譜掃描式酶標儀于490 nm波長處檢測各孔的光密度(OD)值,并計算細胞生存率,生存率(%)=(試驗組細胞平均OD值/正常對照組細胞平均OD值)×100%。上述試驗重復3次。
2.4 細胞凋亡情況檢測
采用AO/EB雙染色法檢測。取對數生長期的NG108-15細胞適量,以4×105個/孔接種于6孔板中,培養24 h。按“2.3”項下方法分組,每組設3個復孔。正常對照組加入完全培養基5 mL,各含藥組加入含相應藥物的完全培養基5 mL,繼續培養24 h。除正常對照組外,其余各組均按“2.2”項下方法復制AD細胞模型。隨后用PBS清洗2次,每孔加入AO/EB染色試劑20 μL和PBS 1 mL,混勻,避光孵育2~5 min后,使用熒光倒置顯微鏡觀察細胞凋亡情況,并拍照[活細胞(VE):核染色質著綠色,且結構正常;早期凋亡細胞(VA):核染色質著綠色,呈固縮或圓珠狀]。
2.5 CDK5、GSK3β、Tau、p-Tau蛋白表達情況檢測
采用Western blotting法檢測。取對數生長期的NG108-15細胞適量,以6×105個/孔接種于6孔板中,培養24 h。按“2.3”項下方法分組,每組設5個復孔。正常對照組加入完全培養基1 mL,各含藥組加入含相應藥物的完全培養基1 mL,繼續培養24 h。除正常對照組外,其余各組均按“2.2”項下方法復制AD細胞模型。隨后吸棄上清液,用PBS清洗2次,加入蛋白裂解液(RIPA高效快速裂解液、PMSF、磷酸酶抑制劑按體積比100 ∶ 1 ∶ 1配制)150 μL,于冰上裂解30 min,收集上清液,于4 ℃下以12 000 r/min離心15 min,取上清液,使用微量核酸蛋白分析儀測定蛋白濃度。蛋白經5×SDS-PAGE蛋白上樣緩沖液稀釋后,于95~100 ℃變性5 min。取變性蛋白適量行SDS-PAGE,電泳結束后濕法轉移至PVDF膜上,用5%脫脂奶粉室溫封閉1 h,用TBST溶液清洗5 min×3次,加入相應一抗[內參(β-actin)的稀釋度為1 ∶ 5 000,其余蛋白的稀釋度均為1 ∶ 1 000],4 ℃孵育過夜;用TBST溶液清洗5 min×3次,加入二抗(稀釋度為1 ∶ 10 000),37 ℃搖床避光孵育2 h,用TBST溶液清洗5 min×3次后,采用雙色紅外熒光掃描成像系統成像并使用ImageJ V1.48u軟件進行定量分析,以相應蛋白與內參條帶的灰度值比值表示該蛋白的相對表達量。上述試驗重復3次。
2.6 CDK5、GSK3β mRNA表達情況檢測
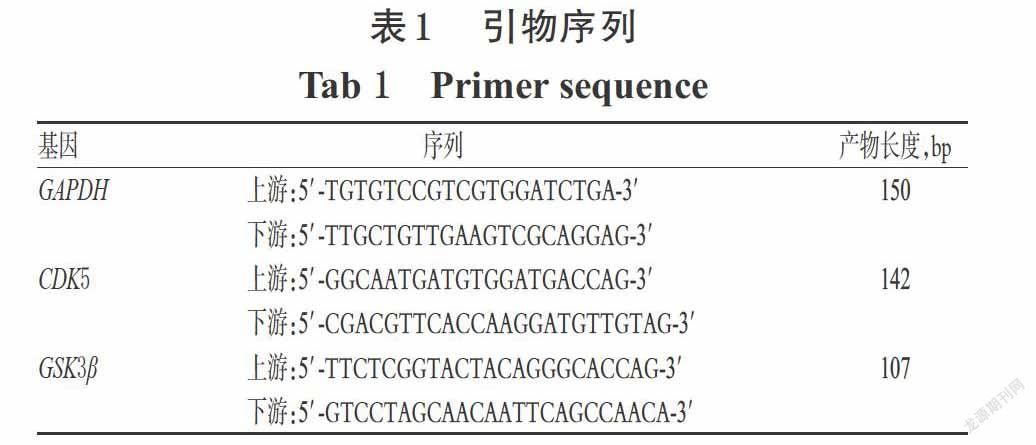
采用逆轉錄-聚合酶鏈反應法(RT-PCR)檢測。取對數生長期的NG108-15細胞適量,以6×105個/孔接種于6孔板中,培養24 h。按“2.3”項下方法分組,每組設3個復孔。正常對照組加入完全培養基1 mL,各含藥組加入含相應藥物的完全培養基1 mL,繼續培養24 h。除正常對照組外,其余各組均按“2.2”項下方法復制AD細胞模型。隨后采用Trizol法抽提細胞總RNA,使用微量核酸蛋白分析儀檢測RNA濃度及純度(即A260 nm/A280 nm;當A260 nm/A280 nm為1.8~2.1,表明RNA的純度較高),將提取的RNA按試劑盒步驟進行去DNA和逆轉錄后,采用兩步法以實時熒光定量PCR儀進行擴增。反應體系(共20 μL):上/下引物(引物序列見表1)各0.8 μL、模板cDNA 2 μL、2×TBⅡ? Premix Ex Taq Ⅱ 10 μL、50×ROX Reference Dye 0.4 μL、無酶水6 μL。反應條件:95 ℃預變性30 s;95 ℃變性5 s,60 ℃延伸31 s,共40個循環。以GAPDH為內參,采用2-ΔΔCt法計算各目的mRNA的相對表達量(Ct表示每個反應管內熒光信號強度達到設定閾值時所經歷的循環數)。上述試驗重復3次。
2.7 CDK5、GSK3β、Tau蛋白分布情況檢測
采用免疫熒光法檢測。取對數生長期的NG108-15細胞適量,以4×105個/孔接種于6孔板中(培養板中有玻片),培養24 h。按“2.3”項下方法分組,每組設3個復孔。正常對照組加入完全培養基1 mL,各含藥組加入含相應藥物的完全培養基1 mL,繼續培養24 h。除正常對照組外,其余各組均按“2.2”項下方法復制AD細胞模型。隨后吸棄各孔上清液,用PBS清洗5 min×3次。將細胞置于4%多聚甲醛溶液中固定20 min,用PBS清洗5 min×3次,于0.2%Triton X-100試劑中靜置5 min,用PBS清洗5 min×3次,用5%BSA-PBS混合溶液封閉30 min,把裝有玻片的培養板放于自制濕盒中,室溫孵育1 h后,吸棄多余液體。在玻片上滴加相應一抗(CDK5、GSK3β、Tau的稀釋度分別為1 ∶ 500、1 ∶ 300、1 ∶ 200),4 ℃孵育過夜,用PBS清洗5 min×3次,加入二抗(稀釋度為1 ∶ 1 000),室溫避光孵育1 h,用PBS清洗5 min×3次,加入DAPI試劑50 μL,室溫避光孵育5 min。取出玻片,晾干,加入抗熒光淬滅封片劑適量,于熒光倒置顯微鏡下觀察目標蛋白的分布情況(目標蛋白呈綠色熒光,細胞核呈藍色熒光)。
2.8 統計學方法
采用SPSS 22.0軟件對數據進行統計分析。計量資料以x±s表示,組間比較采用單因素方差分析(One-way ANOVA)。P<0.05表示差異有統計學意義。
3 結果
3.1 TSG對AD模型細胞存活情況的影響
與正常對照組比較,模型組細胞的存活率顯著降低,差異有統計學意義(P<0.01);與模型組比較,TSG各劑量組細胞的存活率均顯著升高,差異均有統計學意義(P<0.05),詳見表2。
3.2 TSG對AD模型細胞凋亡情況的影響
正常對照組可見大量VE,呈綠色,且形態未見異常。模型組可見部分VA,呈固縮或圓珠狀;經TSG預處理后,各給藥組VA均有所減少,詳見圖1(圖中,“圓圈”表示VE,“箭頭”表示VA)。
3.3 TSG對AD模型細胞CDK5、GSK3β、Tau、p-Tau蛋白表達的影響
與正常對照組比較,模型組細胞CDK5、GSK3β的相對表達量以及p-Tau與Tau相對表達量的比值(p-Tau/Tau)均顯著升高,差異均有統計學意義(P<0.05)。與模型組比較,TSG中、高劑量組細胞CDK5的相對表達量和p-Tau/Tau以及各劑量組細胞GSK3β的相對表達量均顯著降低,差異均有統計學意義(P<0.05),詳見圖2、表3。
3.4 TSG對AD模型細胞CDK5、GSK3β mRNA表達的影響
與正常對照組比較,模型組細胞CDK5、GSK3β mRNA的相對表達量均顯著升高,差異均有統計學意義(P<0.05);與模型組比較,TSG各劑量組細胞CDK5、GSK3β mRNA的相對表達量均顯著降低,差異均有統計學意義(P<0.05),詳見表4。
3.5 TSG對AD模型細胞CDK5、GSK3β、Tau分布的影響
正常對照組細胞中,未見或少見CDK5、GSK3β、Tau蛋白分布。模型組細胞中,CDK5、GSK3β、Tau蛋白分布明顯增多。經TSG預處理后,各給藥組細胞中CDK5、GSK3β、Tau蛋白的分布均有不同程度的減少,詳見圖3~圖5(圖中,“箭頭”表示目標蛋白)。
4 討論
AD作為一種進行性神經退行性疾病,其主要的神經病理性特征包括β淀粉樣蛋白沉積所導致的老年斑、Tau蛋白過度磷酸化造成的神經元纖維纏結以及神經元丟失伴膠質細胞增生[1]。現有研究證實,AD的發生與β淀粉樣蛋白、Tau蛋白有關,且后者的異常磷酸化可導致AD患者的認知障礙[8-9]。因此,抑制和調控Tau蛋白的磷酸化可能是預防和治療AD的關鍵。
TSG是我國傳統中藥何首烏的主要活性成分。研究表明,該化合物具有抗氧化、抗衰老、防治AD、提高DNA修復功能等作用[6-7]。本課題組前期以淀粉樣前體蛋白(APP)/早老蛋白1(PS1)雙轉基因AD模型小鼠為對象,發現TSG能有效改善其學習記憶功能,但具體機制尚不清楚[10]。NG108-15細胞是神經瘤細胞,具有與神經元細胞相似的生理結構和形態特點,能較好地模擬AD的病理過程[11]。因此,本研究通過OA誘導NG108-15細胞Tau蛋白異常磷酸化以建立AD模型,初步探討TSG對Tau蛋白磷酸化水平的影響及可能機制。
Tau蛋白的異常磷酸化是AD的重要病理特征之一,可引發神經毒性反應,從而破壞神經元細胞骨架的正常生理功能[12]。在病理狀態下,Tau聚集可導致神經元死亡進而造成認知障礙[13]。本研究結果顯示,模型組可見固縮或圓珠狀的VA和聚集的Tau蛋白,其細胞存活率較正常對照組顯著降低,p-Tau/Tau較正常對照組顯著升高,提示OA可導致神經細胞Tau蛋白的異常磷酸化,增加Tau蛋白的聚集,最終造成細胞凋亡。經TSG預處理后,各給藥組VA和Tau蛋白均有不同程度的減少,各劑量組細胞的存活率均較模型組顯著升高,中、高劑量組細胞p-Tau/Tau均較模型組顯著降低,提示TSG可抑制OA誘導的Tau磷酸化,并減少Tau蛋白的聚集和細胞的凋亡。
CDK5和GSK3β已被確定為引發神經退行性疾病Tau蛋白異常磷酸化的主要蛋白激酶[14-15]。其中,CDK5是調控Tau蛋白磷酸化的重要激酶,可引起Tau蛋白11個磷酸化位點的磷酸化,與神經元遷移、細胞黏附、突觸活化、多巴胺傳遞等信號通路底物作用有關,是神經系統發育及功能維持的必需蛋白之一[16];GSK3β可加重神經系統炎癥反應,增加β淀粉樣蛋白的生成,并降低AD患者體內乙酰膽堿的合成,造成神經元丟失,與Tau蛋白磷酸化過程、細胞凋亡及患者記憶障礙密切相關[17-19]。本研究結果顯示,正常對照組細胞未見或少見CDK5、GSK3β蛋白分布。經OA誘導后,模型組細胞CDK5、GSK3β蛋白分布明顯增多,CDK5、GSK3β蛋白及其mRNA的相對表達量均較正常對照組顯著升高,提示細胞Tau磷酸化異常可能與CDK5、GSK3β蛋白表達增強有關。經TSG預處理后,各給藥組細胞CDK5、GSK3β蛋白分布有所減少,中、高劑量組細胞CDK5蛋白以及各劑量組CDK5 mRNA、GSK3β蛋白及其mRNA的相對表達量均較模型組顯著降低,提示TSG對Tau磷酸化的調控作用可能是通過抑制CDK5、GSK3β蛋白的表達及其mRNA的轉錄來實現的。
綜上所述,TSG可下調相關磷酸激酶的蛋白表達和基因轉錄水平,抑制Tau蛋白的磷酸化,提高細胞存活率,對AD模型細胞具有一定的保護作用。但TSG與Tau蛋白磷酸化相關蛋白磷酸激酶間的相互作用機制尚有待后續研究進一步完善。
參考文獻
[ 1 ] JONES DT,GRAFF-RADFORD J,LOWE VJ,et al. Tau,amyloid,and cascading network failure across the Alzheimer’s disease spectrum[J]. Cortex,2017. DOI:10.1016/j.cortex.2017.09.018.
[ 2 ] CáRDENAS-AGUAYO MDEL C,GóMEZ-VIRGILIO L,DEROSA S,et al. The role of tau oligomers in the onset of Alzheimer’s disease neuropathology[J]. ACS Chem Neurosci,2014,5(12):1178-1191.
[ 3 ] MOSZCZYNSKI AJ,STRONG W,XU K,et al. Pathologic Thr175 Tau phosphorylation in CTE and CTE with ALS[J]. Neurology,2018,90(5):e380-e387.
[ 4 ] 馮楓,張熙,王魯寧.全腦膠質細胞Tau蛋白病的研究進展[J].中華內科雜志,2018,57(10):763-765.
[ 5 ] PASCOAL TA,MATHOTAARACHCHI S,MOHADES S,et al. Amyloid-β and hyperphosphorylated Tau synergy drives metabolic decline in preclinical Alzheimer’s disease[J]. Mol Psychiatry,2017,22(2):306-311.
[ 6 ] 任紅微,魏靜,高秀梅,等.何首烏及其主要化學成分藥理作用及機制研究進展[J].藥物評價研究,2018,41(7):1357-1362.
[ 7 ] 趙明宇.何首烏化學成分和藥理作用[J].北方藥學,2018,15(3):192-193.
[ 8 ] 申瀟竹,董燕,汪玲玲,等.廣泛性腦萎縮者血漿Tau蛋白、磷酸化Tau蛋白水平與認知功能的關系[J].中國神經精神疾病雜志,2017,43(10):608-611.
[ 9 ] 申瀟竹,董燕,汪玲玲,等.老年低血糖患者血漿Tau蛋白、p-Tau蛋白與認知功能關系的研究[J].中國糖尿病雜志,2018,26(7):559-562.
[10] 劉寧,廖艷花,賴術,等.二苯乙烯苷對淀粉樣前體蛋白/早老蛋白1雙轉基因小鼠腦組織半胱氨酸天冬氨酸蛋白酶3和淀粉樣前體蛋白表達的影響[J].中國全科醫學,2017,20(15):1854-1859.
[11] 朱美娥. Aβ片段神經毒性誘導NG108-15細胞創建老年性癡呆細胞模型的作用[C]//《中國醫院藥學雜志》學術年會論文集. 昆明:中國醫院藥學雜志編輯部,2016:246.
[12] POOLER AM,POLYDORO M,MAURY EA,et al. Amyloid accelerates Tau propagation and toxicity in a model of early Alzheimer’s disease[J]. Acta Neuropathol Commun,2015. DOI:10.1186/s40478-015-0199-x.
[13] MELIS V,ZABKE C,STAMER K,et al. Different pathways of molecular pathophysiology underlie cognitive and motor tauopathy phenotypes in transgenic models for Alzheimer’s disease and frontotemporal lobar degeneration [J]. Cell Mol Life Sci,2015,72(11):2199-2222.
[14] LEE S,HALL GF,SHEA TB. Potentiation of Tau aggregation by CDK5 and GSK3β[J]. J Alzheimers Dis,2011,26(2):355-364.
[15] 于艷紅,許杰,李文彬,等. Tau蛋白磷酸化在阿爾茨海默病中所處的地位[J].現代生物醫學進展,2015,15(8):1573-1576.
[16] BHOUNSULE AS,BHATT LK,PRABHAVALKAR KS,et al. Cyclin dependent kinase 5:a novel avenue for Alzheimer’s disease[J]. Brain Res Bull,2017. DOI:10.1016/j.brainresbull.2017.05.006.
[17] 劉晏伊,陳超,李志鵬,等. Tau蛋白的磷酸化對阿爾茨海默病影響的相關研究[J].中國老年保健醫學,2016,14(5):8-11.
[18] DUAN J,MARCELLUS KA,QIN X,et al. Cystatin C promotes Tau protein phosphorylation and causes microtubule instability by inhibiting intracellular turnover of GSK3β in neurons[J]. Mol Cell Neurosci,2018. DOI:10.? ? ? 1016/j.mcn.2018.03.009.
[19] KAMARUDIN MN,MOHD RAFLEE NA,HUSSEIN SS,et al. (R)-(+)-α-lipoic acid protected NG108-15 cells against H2O2-induced cell death through PI3K-Akt/GSK-3β pathway and suppression of NF-κB-cytokines[J]. Drug Des Devel Ther,2014. DOI:10.2147/DDDT.S67980.
(收稿日期:2018-12-23 修回日期:2019-06-28)
(編輯:張元媛)

