基于QbD理念的茶堿凝膠骨架緩釋片處方工藝設計與優(yōu)化
姜希偉 費云揚 連桂玉 項榮武 翟菲 蔣宇琨 車鑫

摘 要 目的:基于“質量源于設計”(QbD)理念設計并優(yōu)化茶堿親水凝膠骨架緩釋片(簡稱為“自制緩釋片”)的處方工藝。方法:確定稀釋劑類型、片徑、黏合劑性質(即不同黏合劑種類的占比)、黏合劑用量作為關鍵工藝參數(shù)(CPPs),將自制緩釋片與市售參比制劑溶出曲線的相似因子以及其在不同時間點的累積釋放度作為關鍵質量屬性(CQAs),采用L18(34)正交表進行設計和試驗;對試驗結果建立二次多項式回歸模型,利用Modde 12.0軟件通過最優(yōu)模型進行計算并獲得設計空間及其可接受范圍(PAR),以確定自制緩釋片的最優(yōu)處方工藝,并對所得工藝進行驗證試驗和蒙特卡洛模擬驗證。結果:獲得吻合度、精確度、有效性、重現(xiàn)性均較好的最優(yōu)模型,能較好地擬合CQAs和CPPs之間的關系;進一步計算獲得設計空間及其PAR值[稀釋劑最優(yōu)值為乳糖;片徑為9.07~9.33 mm,最優(yōu)值為9.20 mm;羥丙基甲基纖維素(HPMC)K4M占HPMC總量的比例為0.50~0.83,最優(yōu)值為0.80;HPMC總量為0.036 0~0.041 3g/片,最優(yōu)值為0.038 7 g/片],并確定其優(yōu)處方工藝為茶堿質量占比50%、HPMC K4M質量占比15.48%、HPMC K100M質量占比3.87%,其余部分使用乳糖作為稀釋劑,制片后片徑為9.20 mm。驗證結果顯示,所制備的茶堿緩釋片與參比制劑具有相似的體外釋放行為;模擬產生的95%以上的結果都在上、下限范圍內。結論:基于QbD理念建立的茶堿緩釋片處方工藝能夠符合制劑設計要求,而且在PAR范圍內調整CPPs所制備的產品能夠符合CQAs的要求,表明QbD理念用于緩控釋制劑處方工藝的設計和優(yōu)化具有科學性和有效性。
關鍵詞 茶堿;親水凝膠骨架緩釋片;質量源于設計;關鍵質量屬性;關鍵工藝參數(shù);正交試驗;設計空間;處方;工藝;優(yōu)化
ABSTRACT? ?OBJECTIVE: To design and optimize the formulation and technology of Theophylline hydrophilic gel matrix sustained-release tablets (self-made sustained-release tablets for short) based on the concept of “Quality by Design” (QbD). METHODS: Diluent type, tablet diameter, the property of adhesive (ratio of different adhesive types), the amount of adhesive were regarded as critical process parameters (CPPs). Similarity factor of dissolution curves of self-made Theophylline sustained-release tablets and reference preparation and its accumulative release rate at different time points were regarded as critical quality attributes (CQAs). L18(34) orthogonal tablet was adopted for design and trial, and secondary polynomial regression model was established. By using Modde 12.0 software, the design space and its acceptable range (PAR) were calculated through the optimal model. The optimal formulation and technology of Theophylline sustained-release tablets was determined, and validation test and Monte Carlo simulation verification were conducted. RESULTS: The optimal model with good coincidence, accuracy, validity and reproducibility was obtained, which could better fit the relationship between CQAs and CPPs. The design space and PAR value were obtained by further calculation (The optimum value of diluent was lactose; tablet diameter was 9.07-9.33 mm, and the optimal value was 9.20 mm; ratio of HPMC K4M to HPMC was 0.50-0.83, and the optimal value was 0.80; total amount of HPMC was 0.036 0-0.041 3 g per tablet, and the optimal value was 0.038 g per tablet). The optimal formulation and technology included that ratio of theophylline, HPMC K4M and HPMC K100M were 50%, 15.48% and 3.87%, respectively; the rest was filled with lactose and the diameter of the tablet was 9.20 mm. The results of validation confirmed that self-made Theophylline sustained-release tablets had similar in vitro release behavior compared with reference preparation. CONCLUSIONS: Based on the concept of QbD, the formulation and technology of Theophylline sustained-release tablets can meet the requirements of design, and the CPPs can be adjusted within the PAR range to meet the requirements of CQAs. This shows that the QbD concept is scientific and effective in the design and optimization of the formulation and technology of sustained and controlled release preparations.
KEYWORDS? ?Theophylline; Hydrophilic gel matrix sustained-release tablets; Quality by design; Critical quality attributes; Critical process parameters; Orthogonal test; Design space; Formulation; Technology; Optimization
“質量源于設計”(Quality by Design,QbD)理念最早于2004年由美國FDA提出,其旨在通過處方工藝設計生產,從而確定影響產品關鍵質量屬性(Critical quality attributes,CQAs)的關鍵工藝參數(shù)(Critical process parameters,CPPs),并通過控制CPPs的范圍,使生產出來的藥品達到預定的質量標準[1]。QbD強調產品質量來源于其生產前設計,而非對已有產品的檢測。在傳統(tǒng)的產品設計生產理念下,產品質量極度依賴產品的檢測把控,而QbD的理念則很好地克服了上述問題[2]。目前,QbD理念在一些傳統(tǒng)劑型的工藝篩選和處方優(yōu)化中已有應用,但將其用于對釋放性能要求較嚴格的緩控釋制劑生產罕見報道。
茶堿(Theophylline)是一種甲基嘌呤類藥物,在治療支氣管擴張、抗炎、調節(jié)免疫等方面具有確切的效果[3]。臨床常用的劑型為氨茶堿片(100 mg/片),每日需服用3次,頻繁給藥常導致患者體內血藥濃度波動大、療效不穩(wěn)定等現(xiàn)象[4];而且,當茶堿的血藥濃度超過20 μg/mL時,還會引起如惡心、心悸、心律失常等不良反應[5],因此有必要采用緩控釋劑型給藥。將傳統(tǒng)藥物設計成緩控釋制劑可延長有效血藥濃度的持續(xù)時間,減輕藥物突釋帶來的不良反應,提高患者服藥依從性[6]。緩控釋骨架片劑是市售口服緩控釋劑型的重要組成,其處方組成相對簡單且易生產,常采用親水凝膠骨架作為釋放載體。為此,本研究以市售茶堿緩釋片為參比制劑,運用QbD理念設計并制備其仿制制劑——茶堿凝膠骨架緩釋片(以下簡稱“自制緩釋片”),為基于QbD理念的處方工藝優(yōu)化和仿制藥研發(fā)提供方法學參考。本研究通過風險評估確定稀釋劑類型、片徑、黏合劑性質及用量為CPPs,以自制緩釋片與參比制劑釋放曲線的相似因子以及其在不同時間點的藥物釋放度為CQAs,采用正交試驗設計進行處方工藝篩選,并采用二項式回歸分析和設計空間確定最優(yōu)處方工藝,最終制備獲得與參比制劑體外溶出行為相似的自制緩釋片,旨在進一步探究QbD理念用于緩控釋制劑處方工藝設計的科學性和有效性。
1 材料
1.1 儀器
FA2004B型電子天平[奧豪斯儀器(常州)有限公司];LSP50型單沖壓片機(揚州市諾亞機械有限公司);UV-1000型紫外-可見分光光度計[翱藝儀器(上海)有限公司];RC806D型溶出試驗儀(天津市天大天發(fā)科技有限公司)。
1.2 藥品與試劑
市售茶堿緩釋片(參比制劑,白云山光華制藥有限公司,批號:H44020002,規(guī)格:0.1 g/片);無水茶堿對照品(中國食品藥品檢定研究院,批號:100121-201805,純度:99%);乳糖(天津市大茂化學試劑廠);無水茶堿原料藥(批號:157744,純度:99%)、微晶纖維素、羥丙基甲基纖維素(HPMC)K4M、HPMC K100M(上海阿拉丁生物科技有限公司);磷酸氫鈣、微粉硅膠(本溪普智醫(yī)藥科技有限公司);其余試劑均為分析純,水為去離子水。
2 方法與結果
2.1 自制緩釋片的制備
擬定自制緩釋片的片質量為200 mg,采用濕法制粒法制備。取無水茶堿原料藥,過80目篩,取20 g,按相應處方比例加入黏合劑(HPMC K4M、HPMC K100M)和相應稀釋劑(乳糖/微晶纖維素/磷酸氫鈣),采用等量遞加法混合均勻;加入80%乙醇20 mL制備軟材,過20目篩制粒;于60 ℃烘干,過16目篩整粒,加入1%微粉硅膠,混勻;采用單沖壓片機以6 t的壓力進行壓片,即得。
2.2 茶堿的含量測定
參照2015年版《中國藥典》(四部)通則0401“紫外-可見分光光度法”[7]測定茶堿含量。
2.2.1 檢測波長的選擇 精密稱取干燥至恒質量的無水茶堿對照品7 mg,加水配制成7 μg/mL的對照品溶液,采用紫外-可見分光光度計在200~400 nm波長范圍內掃描,結果在272 nm波長處有最大吸收;同法測定其余輔料,結果在272 nm波長下均無吸收。因此,本研究選擇272 nm為茶堿的檢測波長。
2.2.2 線性關系考察 精密稱取干燥至恒質量的無水茶堿對照品16 mg,加水配制成160 μg/mL的對照品貯備液;精密吸取該貯備液,加水稀釋制成質量濃度分別為1、2、4、8、10、16 μg/mL的系列線性對照品溶液,分別在272 nm波長處測定吸光度。以茶堿質量濃度(c,μg/mL)為橫坐標、吸光度(A)為縱坐標進行線性回歸,得回歸方程為A=0.049c+0.001(R2=0.999 9)。結果表明,茶堿檢測質量濃度的線性范圍為1~16 μg/mL。
2.2.3 檢測限和定量限考察 精密稱取乳糖、微晶纖維素、磷酸氫鈣各3 000 mg,HPMC K4M、HPMC K100M各500 mg,加水配制成1 000 mL溶液,再以水稀釋100倍,制得空白輔料溶液,在272 nm波長處測定吸光度,記錄噪音波動范圍。另取無水茶堿對照品1 g,以空白輔料溶液1 000 mL溶解并梯度稀釋,在272 nm波長處測定吸光度,分別以3、10倍噪音值對應的藥物質量濃度作為檢測限和定量限。結果顯示,茶堿的檢測限和定量限分別為15、50 ng/mL。
2.2.4 精密度試驗 取“2.2.1”項下7 μg/mL的對照品溶液,在272 nm波長處連續(xù)測定6次吸光度。結果,吸光度值的RSD為0.96%(n=6),表明儀器精密度良好。
2.2.5 重復性試驗 取無水茶堿原料藥適量,按“2.2.1”項下方法制備溶液(7 μg/mL),平行6份,在272 nm波長處測定吸光度,并按標準曲線法計算樣品含量。結果,茶堿含量的RSD為1.82%(n=6),表明方法重復性良好。
2.2.6 穩(wěn)定性試驗 取無水茶堿原料藥適量,按“2.2.1”項下方法制備溶液(7 μg/mL),于常溫、避光的條件下分別放置0、1、2、3、4 h時,在272 nm波長處測定吸光度。結果,吸光度值的RSD為0.83%(n=5),表明對照品溶液在上述條件下4 h內穩(wěn)定性良好。
2.3 自制緩釋片的累積釋放度測定及與參比制劑的相似因子計算
按照2015年版《中國藥典》(四部)通則0931第二法(漿法)[7]測定自制緩釋片的累積釋放度。以水900 mL為溶出介質,設置轉速為50 r/min、溫度為37 ℃,分別于0.5、1、2、4、6、8、12 h時取溶出液5 mL,并及時補加等溫度、等體積溶出介質。取樣液經0.22 μm微孔濾膜濾過后,分別精密量取濾液4、4、2、1.5、1.5、1、1 mL置于10 mL量瓶中,加水稀釋并定容。按“2.2”項下紫外-可見分光光度法,以水為空白對照,在272 nm波長處分別測定上述稀釋溶液的吸光度,根據“2.2.2”項下回歸方程計算其各時間點累積釋放度:累積釋放度=[(吸光度值-0.01)×溶液體積/0.049]×100%。
2.4 自制緩釋片處方工藝篩選
2.4.1 CPPs的確定 綜合考慮所有當前試驗條件下可控的、可能造成影響的變量,通過查詢相關文獻[8-10]和預試驗評估各變量風險,最終確定CPPs,詳見表1。
2.4.2 自制緩釋片處方工藝的篩選 保持低風險因素不變,即設置試驗溫度為25 ℃、濕度為50%,采用適量微粉硅膠作為潤滑劑,按原料藥占比為50%(即質量比,下同)進行制片。從表1中選擇風險度高的1個定性變量(稀釋劑種類)和3個定量變量[片徑、黏合劑性質(即HPMC K4M和HPMC K100M不同配比)、黏合劑用量(即每片中2種HPMC總量)]為CPPs,考察其對自制緩釋片體外釋放行為的影響。以上述4個CPPs為自變量[稀釋劑種類(X1)、片徑(X2)、HPMC K4M占2種HPMC總量比例(簡稱為“HPMC K4M比例”,X3)、HPMC總量(X4)],以自制緩釋片和參比制劑的相似因子(Y1,本研究為仿制藥研發(fā),故優(yōu)先考慮相似因子)以及自制緩釋片在2、4、6、12 h時的累積釋放度(分別為Y2、Y3、Y4、Y5)這5個CQAs作為因變量,根據L18(34)正交表進行設計和試驗。各變量及水平見表2,正交試驗設計及結果見表3[注:2015年版《中國藥典》(二部)中該制劑項下考察的是2、6、12 h時的累積釋放度[11],故對4 h時的累積釋放度未作明確要求,也未作后續(xù)建模及評價;正交試驗中含3次中心點平行試驗]。
對正交試驗數(shù)據進行方差分析,結果見表4。由表4中顯著性檢驗結果可知,在當前試驗條件下除了X2對Y5及X3對Y5的影響不具有統(tǒng)計學意義(P>0.05)外,其他因素的影響均有統(tǒng)計學意義(P<0.05)。
2.5 自制緩釋片最優(yōu)處方工藝的確定
建立CQAs和CPPs之間的二次多項式回歸模型,以使模型預測值趨近于實測值。根據所建模型預測獲得各工藝參數(shù)組合下的質量屬性,并計算得到設計空間,然后根據設計空間確定最優(yōu)處方工藝。
2.5.1 回歸模型的建立 采用Modde 12.0軟件建立因變量-自變量的二次多項式回歸模型,其表現(xiàn)形式為y=b0+b1x1+b2x2+b3x3+b12x1x2+b13x1x3+b23x2x3+b11x12+b22x22+b33x32。其中,y是與每個CQA相關聯(lián)的響應值,b0是截距,b1~b33等是各模型項的回歸系數(shù),x1~x3等為線性效應項,x1x2、x1x3、x2x3等為交互作用項,x12~x32等為二次效應項。
以R2、Q2、模型有效性和重現(xiàn)性對二次多項式進行回歸擬合效果評價以優(yōu)化模型,其中R2表示模型結果與觀測結果的吻合度,Q2表示模型對試驗結果進行預測的精確度。當R2≥0.8、Q2≥0.6、模型有效性指標>0.2、模型重現(xiàn)性指標>0.85時,則表明所建模型擬合效果較好[12]。通過Modde 12.0軟件計算獲得上述4個模型評價參數(shù)值,并按上述模擬效果評價標準篩選出了最優(yōu)模型:(1)Y1對應的模型為y=b0+b1x1+b2x2+b3x3+b4x4+b12x1x2;(2)Y2對應的模型為y=b0+b1x1+b2x2+b3x3+b4x4+b12x1x2x1+b14x1x4x1+b23x2x3+b24x2x4+b22x22+b33x32+b44x42;(3)Y3對應的模型為y=b0+b1x1+b2x2+b3x3+b4x4+b12x1x2x1+b14x1x4x1+b23x2x3+b24x2x4+b22x22+b33x32+b44x42;(4)Y4對應的模型為y=b0+b1x1+b2x2+b3x3+b4x4+b14x1x4x1+b23x2x3+b24x2x4+b33x32+b44x42;(5)Y5對應的模型為y=b0+b1x1+b2x2+b3x3+b4x4+b14x1x4x1+b23x2x3+b24x2x4+b33x32+b44x42。最優(yōu)模型對試驗實際檢測結果的擬合更為精確,通過該模型預測的試驗結果也與實際值更接近,故通過該最優(yōu)模型可以計算得到各CPPs設定值組合下的CQAs預測值。
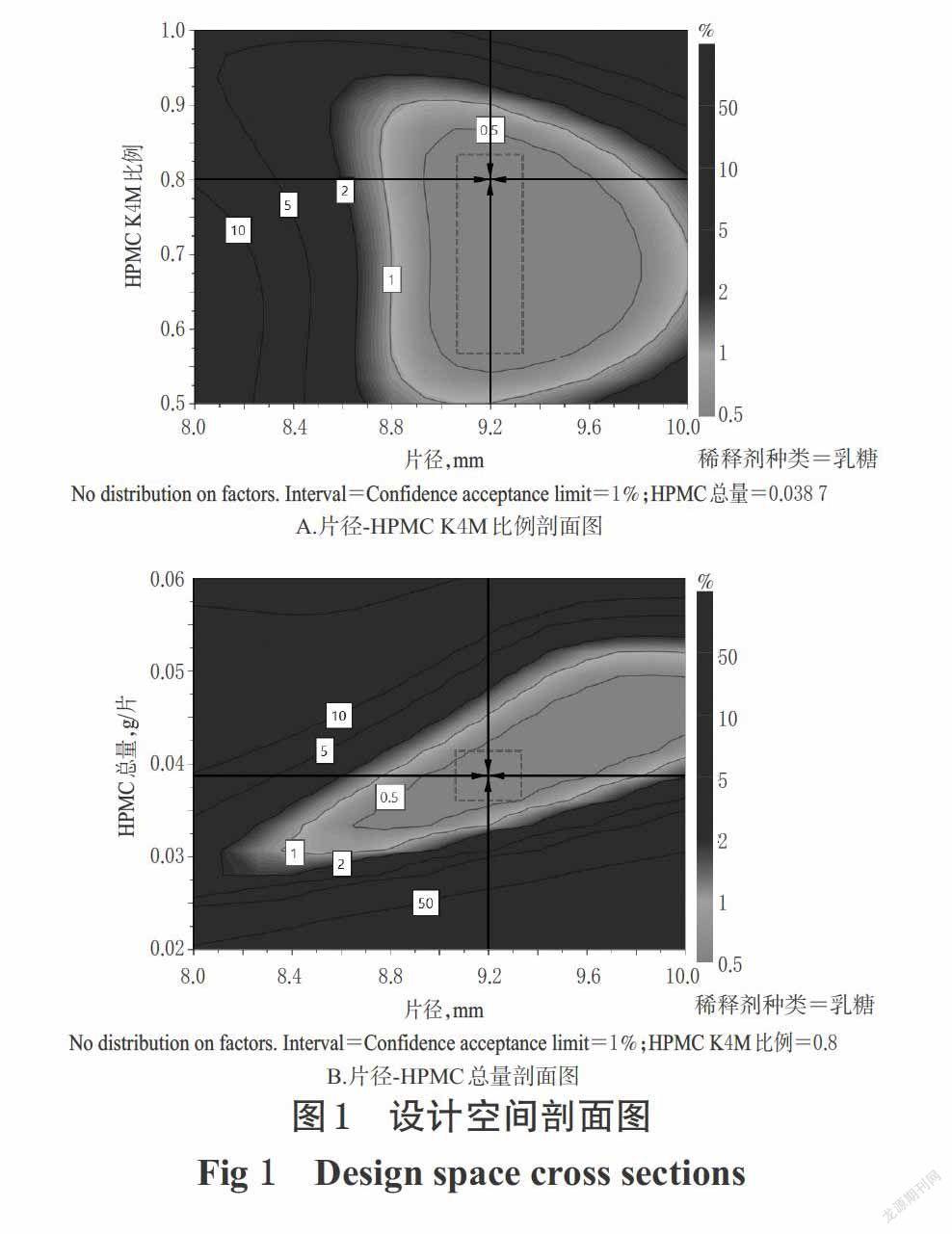
2.5.2 最優(yōu)工藝處方的確定 根據人用藥品注冊技術要求國際協(xié)調會(ICH)技術文件Q8的定義,“設計空間”是指包含輸入因子的多維組合和相互作用且已被證明能夠提供質量保證的區(qū)域,在設計空間內的生產參數(shù)變化不需要重新進行審批,只有超出此空間的變化才需要獲得批準后再實施生產[13]。本研究基于設計空間確定優(yōu)化工藝處方。根據“2.5.1”項下建立的最優(yōu)模型,采用Modde 12.0軟件求得任意工藝參數(shù)組合下的產品質量屬性,并通過灰度體現(xiàn)其符合質量要求的概率,綜合計算結果匯總成圖,即得設計空間,詳見圖1(注:剖面圖中最內圈曲線覆蓋的區(qū)域就是滿足質量要求的設計空間;另根據Modde 12.0軟件計算結果,采用乳糖作為稀釋劑時設計空間面積更大且可達到最優(yōu)處方工藝,因此將定性變量X1確定為乳糖以呈現(xiàn)設計空間)。
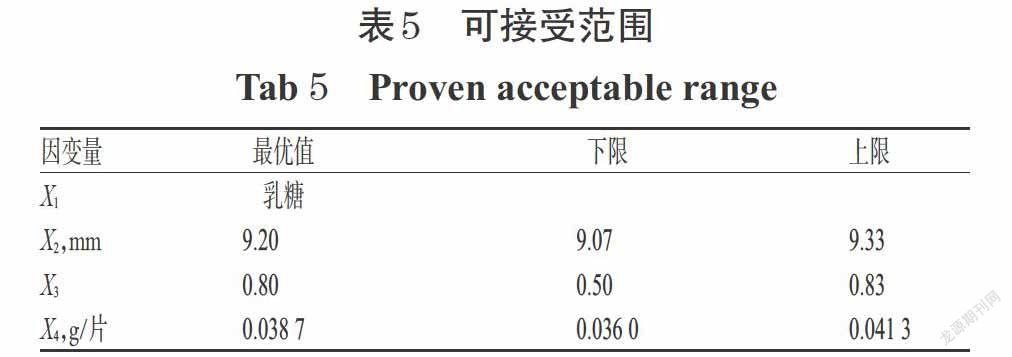
可接受范圍(PAR)是設計空間內符合質量要求的區(qū)域內面積巨大的矩形,其具體體現(xiàn)為過程參數(shù)的特征范圍,在PAR范圍內“進行某參數(shù)的改變,同時保持其他參數(shù)不變,將生產出符合相關質量標準的材料”[14]。采用Modde 12.0軟件在設計空間內生成在不損害產品的CQAs前提下所有因素組合的PAR,詳見圖1(注:圖中灰色矩形線框所示)、表5。
根據表5最優(yōu)值,并按片質量200 mg計算,得到自制緩釋片的最優(yōu)處方工藝為茶堿占比50%、HPMC K4M占比15.48%、HPMC K100M占比3.87%,其余部分使用乳糖作為填充劑,并加入適量微粉硅膠作為潤滑劑,制片后片徑為9.20 mm。
2.5.3 最優(yōu)工藝處方驗證 精密稱取無水茶堿原料藥20 g及輔料適量,依照“2.5.2”項下最優(yōu)處方工藝制備自制緩釋片(生產規(guī)模大于100片),并按“2.2”項下方法測定其累積釋放度及相似因子。結果,所得緩釋片在第2、4、6、12 h時累積釋放度分別為27.01%、42.43%、58.34%、84.81%,符合2015年版《中國藥典》(二部)對茶堿緩釋片規(guī)定的“2 h時釋放度在20%~40%、6 h時40%~65%、12 h時不低于70%”的釋放要求[11];其與參比制劑的相似因子為79.90(>50),表明與參比制劑具有相似的體外釋放行為。
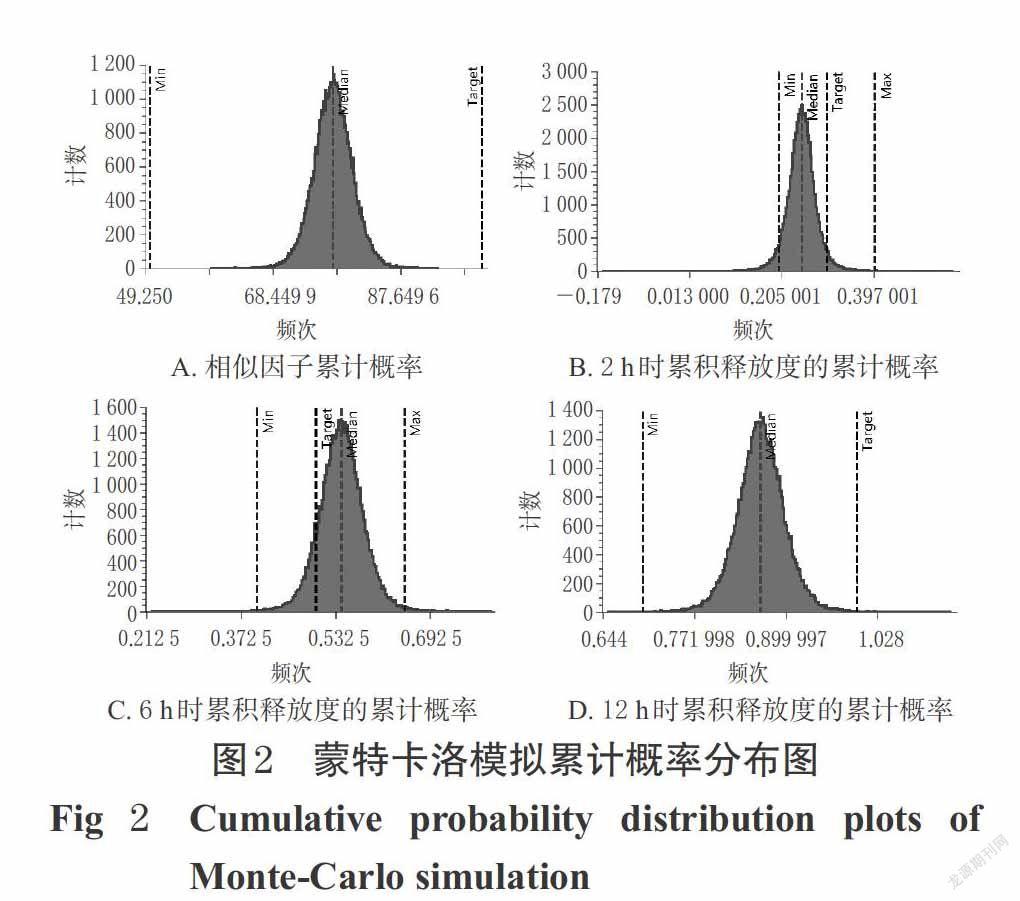
為驗證模型和優(yōu)選結果的穩(wěn)定性,采用Modde 12.0軟件對最優(yōu)工藝處方進行蒙特卡洛模擬(1 000 000次),結果得到各CQAs的累計概率分布圖,詳見圖2(注:由于Y3無對應優(yōu)化目標,此處略去)。由圖2可見,模擬產生的99.5%以上的結果都落在了上下限內,符合穩(wěn)定性要求,證明了通過設計空間所得最優(yōu)處方工藝的穩(wěn)定性良好。
3 討論
本研究將QbD的理念運用到自制緩釋片的工藝處方設計過程,首先通過文獻研究和風險評估確定 CQAs和CPPs;其次采用4因素3水平L18正交表進行設計和試驗;再次,對試驗結果建立了二次多項式回歸模型,綜合分析了影響自制緩釋片釋放的CPPs;最后,通過建立設計空間,確定并驗證了最優(yōu)工藝處方為茶堿占比50%、HPMC K4M占比15.48%、HPMC K100M占比3.87%,其余部分使用乳糖作為稀釋劑,制片后片徑為9.20 mm。驗證結果表明,經由該最優(yōu)工藝處方生產的片劑符合2015年版《中國藥典》(二部)對茶堿緩釋片的釋放性能要求[11]。而且,由于運用QbD理念進行了工藝處方研究,并通過精確的預測模型得出了設計空間及其PAR。實際生產過程中,只要在PAR范圍內調整CPPs,就能保證生產出的制劑能夠符合CQAs的要求,克服了傳統(tǒng)優(yōu)化工藝處方生產不夠靈活的問題。
此外,本研究通過分析最優(yōu)模型發(fā)現(xiàn),親水凝膠骨片的釋放過程受各個CQAs的影響是隨時間的延長而逐漸趨于穩(wěn)定的。其中,片徑和稀釋劑種類的影響僅存在于緩釋片溶出過程的前段,其對水分浸入的速度以及凝膠層尚未形成前藥物的釋放速度有一定影響;片徑和HPMC總量則會影響骨架的形成時間及厚度;稀釋劑種類、HPMC總量、HPMC K4M比例之間的交互作用會影響親水凝膠骨架的強度及藥物在骨架中的擴散速度。當稀釋劑類型為微晶纖維素、HPMC總量占比低于40%(即低于0.08 g/片)、稀釋劑總量占比高于10%(即高于0.02 g/片)時,所制緩釋片各時間點累積釋放度顯著提高,在2 h時出現(xiàn)突釋現(xiàn)象,推測為微晶纖維素的崩解作用所導致。在其他條件下,緩釋片的釋放過程沒有出現(xiàn)偏離模型的突釋。結合上述現(xiàn)象和模型結果推測,具有理想響應值的HPMC K4M比例為0.80~0.83。
由于實驗室壓片機設備的條件限制,本研究中使用的單沖壓片機壓力固定為6 t,而在實際的工廠生產中,不同設備的不同壓沖壓力對緩釋片的釋放可能會存在一定影響,從而導致藥品的質量出現(xiàn)偏差。在今后的研究中,將進一步考慮生產工藝參數(shù)如濕度、溫度等對藥物質量的影響并進行合理調整,探索建立符合實際生產要求的設計空間。
綜上所述,基于QbD理念建立的茶堿緩釋片處方工藝能夠符合制劑設計要求,而且在PAR范圍內調整CPPs所制備的產品能夠符合CQAs的要求,表明QbD理念用于緩控釋制劑處方工藝的設計和優(yōu)化具有科學性和有效性。
參考文獻
[ 1 ] COLLINS PC. Chemical engineering and the culmination of quality by design in pharmaceuticals[J]. AIChE J,2018,64(5):1502-1510.
[ 2 ] 陳斌,魏明春,岳淑賢. QbD在藥品產業(yè)化進程中的應用及有關問題的探索[J].上海醫(yī)藥,2010,31(7):46-49.
[ 3 ] KAPOOR S. Theophylline and its direct anti-neoplastic effects[J]. Respir Med,2016. DOI:10.1016/j.rmed.2013.01.?021.
[ 4 ] 樓永海,胡大平,孫淵.口服單劑量茶堿緩釋片的人體生物等效性評價[J].中國藥業(yè),2004,13(6):30-31.
[ 5 ] AGGELOPOULOU E,TZORTZIS S,TSIOURANTANI F,et al. Atrial fibrillation and shock:unmasking theophylline toxicity[J]. Med Princ Pract,2018,27(4):387-391.
[ 6 ] ELWERFALLI AM,GHANCHI Z,RASHID F,et al. New generation of orally disintegrating tablets for sustained drug release:a propitious outlook[J]. Curr Drug Deliv,2015,12(6):652-667.
[ 7 ] 國家藥典委員會.中華人民共和國藥典:四部[S].2015年版.北京:中國醫(yī)藥科技出版社,2015:38-40、121.
[ 8 ] LEE JK,YANG SW,LEE BS,et al. Formulation of sustained-release tablets of felodipine using hydrophilic polymers and non-ionic surfactants[J]. J Kor Pharm Sci,2006,36(4):271-276.
[ 9 ] 王博,張來華,李苑新,等.親水凝膠骨架緩釋片釋藥機制評價方法的研究進展[J].中國醫(yī)藥工業(yè)雜志,2009,40(10):782-786.
[10] 聶淑芳,劉輝,劉艷麗,等.幾種親水凝膠骨架材料相關性質的比較[J].藥學學報,2011,46(3):338-343.
[11] 國家藥典委員會.中華人民共和國藥典:二部[S].2015年版.北京:中國醫(yī)藥科技出版社,2015:715-716.
[12] ERIKSSON L,JOHANSSON E,KETTANEH-WOLD N,et al. Design of experiments,principles and applications[M]. 3rd ed. Sweden:Umetrics Academy,2008:73-75.
[13] ICH. International conference on harmonisation of technical requirements for registration of pharmaceuticals for human use:2009.ICH harmonised tripartite guideline:pharmaceutical development Q8(R2)[C].ICH,2009.
[14] CHAROO NA,SHAMSHER AA,ZIDAN AS,et al. Quality by design approach for formulation development:a case study of dispersible tablets[J]. Int J Pharm,2012,423(2):167-178.
(收稿日期:2019-04-22 修回日期:2019-08-08)
(編輯:段思怡)

