硫辛酸注射液仿制藥與原研藥的制劑質量比較及其小鼠急性毒性實驗研究
田園 孔德志 劉紫琪 張賽航 任雷鳴


摘 要 目的:對硫辛酸注射液的原研藥與國內2個廠家的仿制藥進行制劑質量比較及小鼠急性毒性實驗研究,探討一致性評價方法的項目。方法:依據《中國藥典》的相關質量標準,檢測并比較3個廠家硫辛酸注射液樣品的理化性質(性狀、pH、滲透壓等)、含量、有關物質及小鼠急性毒性實驗(n=10)中的半數致死量(LD50)及以注射液原液注射給藥后小鼠(n=30)死亡情況。結果:原研藥與2個仿制藥在理化性質和有關物質檢查方面均符合質量標準,3個樣品含量均為95%~105%;急性毒性試驗結果顯示2個仿制藥的LD50值(LD50:247.911 mg/kg,95%置信區間222.209~277.999 mg/kg;LD50:215.291 mg/kg,95%置信區間196.637~235.053 mg/kg)明顯低于原研藥的LD50值(LD50:266.534 mg/kg,95%置信區間250.597~283.418 mg/kg),但差異無統計學意義(P>0.05)。取注射液原液直接單劑量注射時,3次重復實驗結果顯示2個仿制藥引起的小鼠的死亡數(26、28只)與原研藥(19只)比較差異有統計學意義(P均<0.05),且給藥后原研藥小鼠出現竄動和驚叫等興奮性反應,而2個仿制藥呈現抑制性反應。結論:硫辛酸注射液的2個仿制藥與原研藥在制劑質量標準方面均符合《中國藥典》的有關規定,但是急性毒性實驗結果差異較大,難以證明這2個仿制藥與原研藥的一致性;在注射液的一致性評價項目中建議納入急性毒性實驗。
關鍵詞 一致性評價;硫辛酸注射液;含量;有關物質;理化性質;急性毒性實驗
ABSTRACT? ?OBJECTIVE: To compare the quality of original preparations of Thioctic acid injection and generic preparations from 2 domestic manufacturers, discuss the acute toxicity test of mice and to investigate the project of consistency evaluation methods. METHODS: According to the quality standard that stated in Chinese Pharmacopeia, physicochemical properties (characters, pH, osmotic pressure, etc., contents and related substances of samples of Thioctic acid injection as well as LD50 in acute toxicity test (n=10), and mortality of mice after administration of injection solution (n=30) were compared among 3 manufacturers. RESULTS: The physicochemical properties as and related substances of the original drug and 2 generic drugs were all in line with the quality standard; the contents of 3 samples ranged 95%-105%. The acute toxicity test results showed that the LD50 values of 2 generic drugs (LD50: 247.911 mg/kg, 95% confidence interval: 222.209-277.999 mg/kg;LD50: 215.291 mg/kg, 95% confidence interval: 196.637-235.053 mg/kg) were smaller than that of original drug (LD50: 266.534 mg/kg, 95% confidence interval: 250.597-283.418 mg/kg), but there was no statistical difference (P>0.05). The results of 3 repeated experiments showed that there was statistical significance in the number of animal death caused by the 2 generic drugs (26, 28) was more than that of the original drug (19) (all P<0.05), when injection solution was injected into mice in a single dose. After administration of the original drug, mice showed excitatory reactions such as movement and squeal, while 2 generic drugs showed inhibitory reactions. CONCLUSIONS: 2 generic drugs of Thioctic acid injection and the original drug all conform to the relevant regulations of Chinese Pharmacopoeia in terms of preparation quality standards, but the results of acute toxicity test are quite different, so it is difficult to prove the consistency between the 2 generic drugs and the original drug. Therefore, acute toxicity test is necessary for the consistency evaluation of injections.
KEYWORDS? ?Consistency evaluation; Thioctic acid injection; Content; Related substances; Physicochemical properties; Acute toxicity test
硫辛酸(1,2-二硫戊環-3-戊酸)是一種強效天然抗氧化劑,兼具水溶性和脂溶性,廣泛存在于各種原核細胞和真核細胞中,能直接清除多種自由基和活性氧,尚能再生機體的其他抗氧化物以及螯合金屬離子[1-3]。硫辛酸注射液(德國史達德大藥廠)在2005年進入中國市場,用于治療糖尿病周圍神經病變引發的感覺異常[4-5]。隨后,該藥的國產仿制藥也獲批上市。截至2019年6月,筆者通過國家藥品監督管理局網站查詢到目前共有11家藥廠在生產此藥。由于歷史原因,我國仿制藥品的質量仍有一定的提升空間,因此開展仿制藥一致性評價很有必要。目前,藥品的一致性評價工作已經不單單局限在口服固體制劑,注射劑的一致性評價工作也已經在開展。在2018年國家藥品監督管理局頒布的《已上市化學仿制藥(注射劑)一致性評價技術要求(征求意見稿)》中要求:對于不具有完整、充分的安全性、有效性數據的已上市注射劑,都要開展藥品再評價。但由于該文件中未列出具體再評價項目標準,因此筆者希望通過本研究對硫辛酸注射液國產仿制藥與原研藥的制劑質量及毒性一致性評價方法進行探索。經查詢,有文獻報道了國內仿制藥注射用硼替佐米以及注射用丙戊酸鈉與進口原研產品的質量一致性研究,該研究主要開展了理化性質、雜質檢查、含量等項目的對比,最終認為仿制藥與原研藥的質量具有一致性[6-7]。但是原研藥與仿制藥的毒性是否一致也是一項十分重要的指標,鑒于注射劑的急性毒性試驗對于制藥企業是一個常規的安全性評價手段,筆者擬對德國史達德大藥廠的硫辛酸注射液(原研藥,規格:12 mL ∶ 300 mg)與國內2018年銷售額排行前兩名(經筆者調查所得)的硫辛酸注射液仿制藥(三者主成分質量濃度一致)進行理化性質、含量測定、有關物質檢查和小鼠急性毒性試驗的對比研究,通過結果比較探討一致性評價的檢測項目。
1 材料
1.1 儀器
安捷倫1260高效液相色譜儀(美國安捷倫公司);Cubis微量天平(德國Sartorius公司);pH測定儀(梅特勒-托利多儀器有限公司);VAPRO 5600滲透壓儀(美國Wescor公司)。
1.2 藥品與試劑
硫辛酸對照品(北京恒元啟天化工技術研究所和北京世紀奧科生物技術有限公司聯合研制,批號:17072705,供實驗室藥品檢驗用,純度:99.52%);硫辛酸注射液A藥(原研藥,德國史達德大藥廠,批號:72009,規格:12 mL ∶ 300 mg);硫辛酸注射液B藥(仿制藥,國內某藥廠,批號:180601,規格:6 mL ∶ 150 mg);硫辛酸注射液C藥(仿制藥,國內某藥廠,批號:17961140,規格:6 mL ∶ 150 mg);磷酸二氫鉀、磷酸均為分析純;甲醇、乙腈均為色譜純;超純水由Thermo Scientific Nanopure超純水機制備。
1.3 動物
SPF級昆明小鼠18~22 g,♀♂各半,由河北醫科大學動物中心提供,實驗動物生產許可證號:SCXK(冀)2018-004,實驗動物質量合格證編號:1808006。實驗前在溫度23 ℃左右、相對濕度50%左右、明暗各12 h的實驗室飼養1周,期間自由飲食飲水。
2 方法與結果
2.1 理化性質檢查
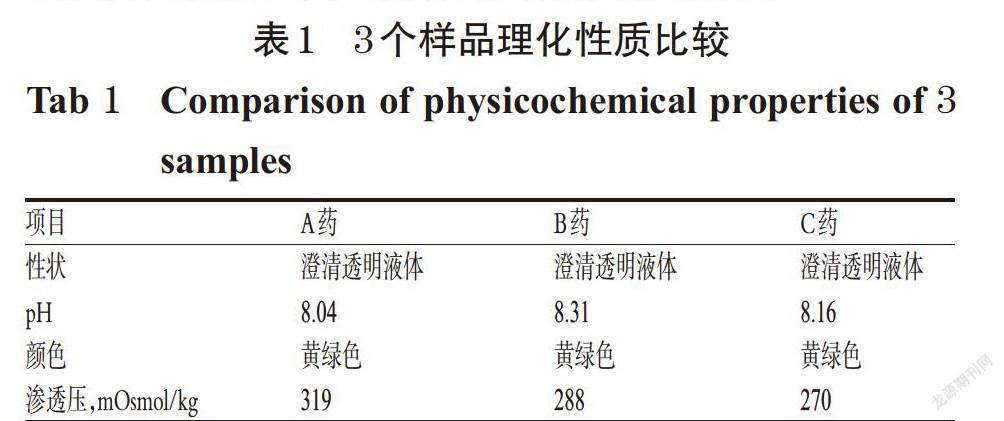
參照2015年版《中國藥典》(四部)[8],對3種硫辛酸注射液(A藥、B藥和C藥)的性狀、pH、顏色、滲透壓等質控項目進行對比考察,結果顯示原研藥與2個仿制藥在理化性質檢查方面均符合藥典標準,詳見表1。
2.2 含量測定
2.2.1 色譜條件 色譜柱:Waters symmtry C18(100 mm×3.0 mm,3.5 μm),流動相:0.1%磷酸水-乙腈? ? ? ?(70 ∶ 30,V/V)[9],流速:1 mL/min,檢測波長:210 nm,柱溫:35 ℃;進樣量:5 μL。
2.2.2 溶液制備 對照品溶液:精密稱取硫辛酸對照品10.0 mg,置于5 mL棕色量瓶中,用50%乙腈水溶解稀釋至刻度,避光4 ℃保存。供試品溶液:精密量取3個批號的硫辛酸注射液各100.0 μL,分別置于5 mL棕色量瓶中,用50%乙腈水稀釋至刻度,避光4 ℃保存。
2.2.3 方法學考察 (1)專屬性。由于仿制藥B藥和C藥處方中均含有苯甲醇,故分別取苯甲醇溶液、硫辛酸對照品溶液及A藥、B藥和C藥制備成的供試品溶液,按“2.2.1”項下條件進樣分析,結果顯示各檢測成分分離良好,苯甲醇對主藥色譜峰的分析未見干擾,色譜見圖1。
(2)精密度。取上述對照品溶液,在“2.2.1”項下條件重復進樣6次,測得硫辛酸峰面積的RSD為0.34%(n=6);連續3 d測定,硫辛酸峰面積的RSD為3.92%(n=3),表明儀器日內、日間精密度均良好。
(3)重復性。按“2.2.2”項下供試品溶液制備方法制備供試品溶液(批號:72009)6份,按“2.2.1”項下條件分別進樣分析,測得硫辛酸峰面積的RSD為0.16%(n=6),表明試驗重復性良好[10]。
(4)標準曲線與線性范圍。分別精密吸取硫辛酸對照品適量,制備成質量濃度為0.123 3、0.197 2、0.246 5、0.394 4、0.493 0、0.788 8、0.986 0 mg/mL的溶液進樣分析,對質量濃度(x)與峰面積(y)進行回歸計算,得線性方程結果為y=3 530.2x-61.25(R2=0.999 8)。表明硫辛酸檢測質量濃度線性范圍為0.123 3~0.986 0 mg/mL。
(5)穩定性。硫辛酸為見光易分解藥物,取供試品(批號:72009)溶液在室溫避光條件下放置0、1、2、4、8、12、24、48 h后,按“2.2.1”項下條件進樣分析,測得硫辛酸峰面積的RSD為1.39%(n=6),表明供試品溶液在室溫避光條件下放置48 h內穩定。
(6)方法耐用性。取供試品(批號:72009)溶液,考察方法在不同品牌色譜柱、柱溫、流動相、檢測波長下的耐用性。結果表明,各因素在試驗范圍內變動時,供試品中硫辛酸含量的RSD均<2%(n=3),表明本試驗色譜條件對不同品牌色譜柱、柱溫、流動相和檢測波長的耐用性較好,結果見表2。
(7)加樣回收率。取已知含量的硫辛酸注射液(批號:72009)共9份,并按硫辛酸注射液質量濃度的80%、100%、120% 精密取適量硫辛酸對照品各3份,混合后分別進樣,記錄峰面積,測定回收率,結果表明方法準確度較好,詳見表3。
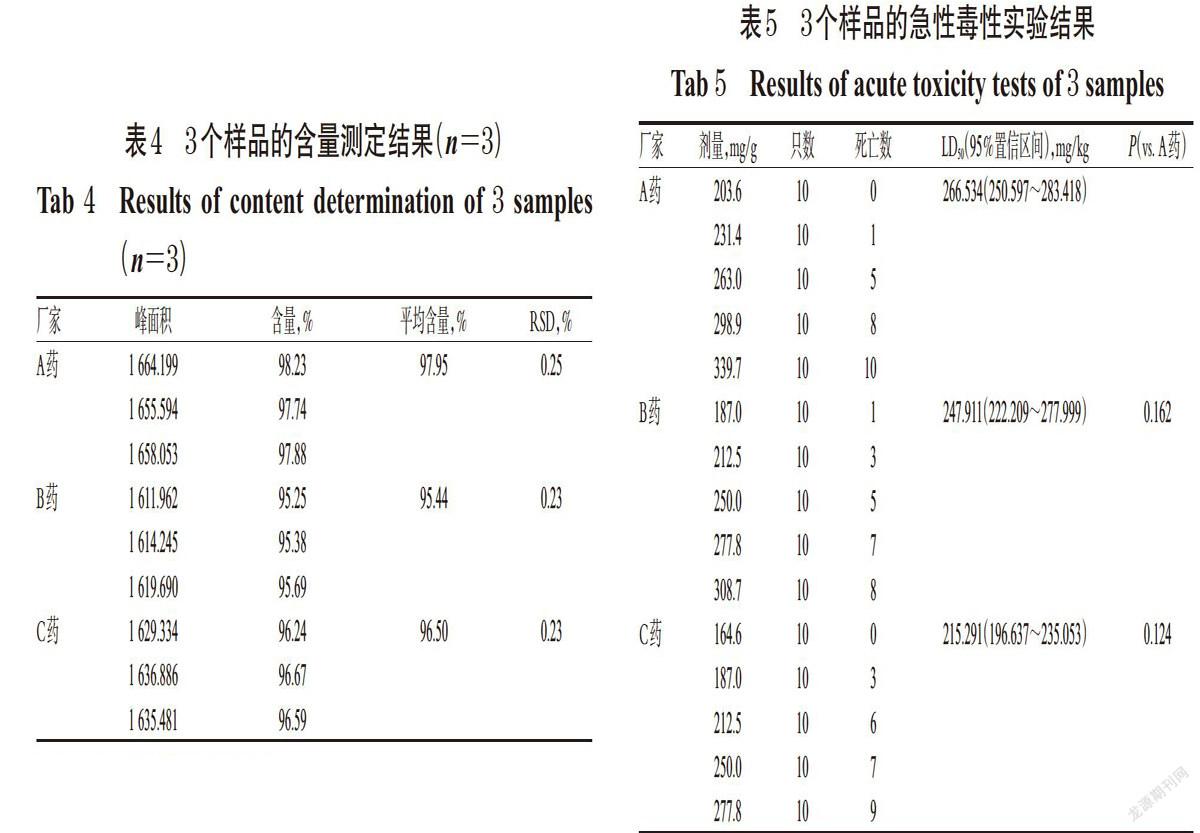
2.2.4 含量測定 取3個廠家的樣品,制備成供試品溶液后進樣,計算注射液中硫辛酸的含量,取平均值。結果,A藥和B、C藥的含量均在95%~99%,符合要求(95%~105%),結果見表4。
2.3 注射液中有關物質檢查
根據《歐洲藥典》硫辛酸有關物質檢查項條件[11],對3個廠家的樣品進行有關物質檢查,每個雜質峰的峰面積要小于硫辛酸峰面積的0.1%[12]。條件如下:色譜柱為DIKMA Diamonsil C18(250 mm×4.6 mm,5 μm),流動相為乙腈-0.7 g/L磷酸二氫鉀(用磷酸調pH為3)-甲醇? ? (8 ∶ 41 ∶ 51,V/V/V),流速為1.2 mL/min,檢測波長為215 nm,柱溫為35 ℃,進樣量為20 μL,記錄色譜圖至25 min。總雜質峰面積不得超過對照溶液主峰峰面積的2倍(1.0%)[13]。用不加校正因子的主成分自身對照法,測得A、B、C各樣品中總雜質含量分別為0.016 9%、0.006%和0.005%,B、C藥總雜質含量均低于原研藥,2個仿制藥與原研藥在有關物質檢查方面均符合質量標準。
2.4 小鼠急性毒性實驗
2.4.1 實驗方法 采用Bliss法,進行小鼠急性毒性實驗[14-16]。首先對A藥進行預實驗,得出最大劑量和最小劑量范圍。將小鼠隨機分為250.0、225.0、202.5、182.3 mg/kg 4個劑量組,組間距r=0.9,給藥體積為0.10? ? ?mL/10 g,每組10只,尾靜脈注射給藥。182.3 mg/kg 和202.5 mg/kg 這2個劑量組未見小鼠死亡,因此,最小劑量基本可以確定在202.5 mg/kg(引起小鼠零死亡的較高劑量)。之后,將劑量調整為202.5、225.0、250.0、276.0、309.0 mg/kg繼續給藥,309.0 mg/kg劑量仍不能致小鼠完全死亡,故仍需要升高劑量;最終,正式實驗設定A藥的劑量組為203.6、231.4、263.0、298.9、339.7 mg/kg,組間距r=0.88,給藥體積為0.14 mL/10 g。同理,B藥和C藥按照上述方法進行預實驗,B藥采用187.0、212.5、250.0、277.8、308.7 mg/kg 5個劑量組進行正式實驗;C藥采用164.6、187.0、212.5、250.0、277.8 mg/kg 5個劑量進行正式實驗;對照組靜脈注射同體積的生理鹽水。正式實驗時,每日取小鼠30只,隨機分為3組,各組分別靜脈注射最低劑量的A藥、B藥或C藥,每日上午9:00給藥;次日同法給予第二個劑量的A藥、B藥或C藥,直至完成所有劑量的給藥。每組實驗后需記錄14 d內小鼠的活動、體質量及死亡數。觀察期結束后,將存活小鼠處死,解剖主要臟器觀察是否發生變化[17]。
2.4.2 統計學方法 應用SPSS 22.0軟件進行統計學分析,采用t檢驗分別比較仿制藥與原研藥的半數致死量(LD50)之間差異是否有統計學意義。單劑量一次性給藥的小鼠急性毒性試驗結果,以死亡只數表示,采用χ2檢驗分別比較仿制藥與原研藥組間的差異。小鼠體質量(g)變化數據采用實測值計算x±s,多組間體質量均數的比較采用單因素方差分析。以P<0.05為差異具有統計學意義。
2.4.3 小鼠的LD50 采用SPSS 22.0軟件的Probit回歸法對急性毒性實驗數據進行LD50及95%置信區間的計算[18],結果見表5。
由表5可見,仿制藥與原研藥的小鼠急性毒性實驗結果(LD50)存在差別:266.534 mg/kg(A藥)>247.911 mg/kg(B藥)>215.291 mg/kg(C藥);但是,3組間進行統計學分析時,差異未見統計學意義(P>0.05)。
2.4.4 小鼠的急性毒性表現 A藥:231.4 mg/kg和203.6 mg/kg劑量組給藥后小鼠無任何異常表現;另外3個劑量組中約70%的小鼠給藥后立即出現四肢僵直,在籠內竄動、驚叫,持續約3 min,呈現興奮性反應。B藥:各劑量組給藥后有30%~80%小鼠表現為側臥、四肢抽搐、呼吸急促以及翻正反射消失,約2 min后恢復正常。C藥:各劑量組給藥后有30%~70%小鼠表現為俯臥癱軟、全身輕微顫抖,約5 min后恢復正常;B、C藥均呈現抑制性反應。
2.4.5 小鼠的體質量變化 實驗前(0 d)A藥、B藥和C藥組小鼠的體質量,在組間和組內(每組的各劑量組間)比較差異均無統計學意義(P>0.05)。14 d后小鼠的體質量,僅A藥298.9 mg/kg劑量組與對照組比較,體質量顯著降低(P=0.033);其余各劑量組以及B藥和C藥各劑量組小鼠體質量與對照組比較,差異均無統計學意義(P>0.05)。各組小鼠體質量比較見圖2。
2.5 3個樣品原液給藥后小鼠死亡情況比較
盡管上述B藥和C藥的LD50值明顯低于A藥,但是統計學分析結果顯示3個樣品的LD50值差異并無統計學意義(P>0.05)。為了合理比較A、B、C 3個樣品靜脈注射的毒性大小,筆者進一步做了A、B、C 3個樣品原液單次靜脈注射給藥后小鼠死亡情況的比較實驗。實驗分3批進行,每批取小鼠30只,♀♂各半,將小鼠隨機分為3組,每組10只,各組分別尾靜脈注射A藥、B藥或C藥原液。綜合A、B、C? 3藥的LD50值(依次為266.534、247.911、215.291 mg/kg),選取中間毒性的B藥的LD50值作為給藥劑量更容易比較3個樣品藥物的毒性大小,因此選取250 mg/kg(質量濃度:25 mg/mL,給藥體積:0.1 mL/10 g)這一劑量。每日上午9:00給藥,每日1批,連續3 d,比較14 d內小鼠的最終死亡情況。統計學方法見“2.4.2”項。實驗結果見表6。
如表6所示,B、C 2個仿制藥之間死亡只數無差異(26、28只),但B、C 2個仿制藥分別與A藥(19只)比較,差異均有統計學意義(P<0.05);由此可以看出A藥(原研藥)的毒性小,B、C藥的毒性較大。
3 討論
參考2015年版《中國藥典》及仿制藥一致性評價技術有關研究報道[7,19-20],筆者對3個不同廠家硫辛酸注射液的理化性質和含量等進行了檢測與比較,結果表明理化性質和含量測定結果均無明顯差異,表明原研藥與仿制藥在制劑質量方面基本一致。然而在小鼠急性毒性實驗中,筆者發現盡管B藥和C藥的LD50值在數值上明顯低于原研藥,但是三者差異并無統計學意義。鑒于LD50易受多種因素影響,筆者又設計了采用藥品原液直接單劑量一次性給藥的平行對比實驗。3次重復實驗結果顯示,仿制藥B藥和C藥的毒性大于原研藥,差異有統計學意義(見表6)。此外,在小鼠給藥后的中毒表現方面,原研藥小鼠出現竄動和驚叫等興奮性反應,而2種仿制藥呈現抑制性反應;提示仿制藥誘發小鼠急性毒性反應的機制可能與原研藥不同。雖然在有關物質檢查方面,B藥和C藥2個仿制藥的未知雜質含量均低于原研藥,卻無法排除未知雜質對急性毒性實驗的影響,可能有必要對未知雜質進行定性、定量研究和毒理學研究。B藥和C藥2個仿制藥均比原研藥多添加了苯甲醇這一輔料,苯甲醇也可能是這2個仿制藥毒性較大的因素。急性毒性實驗結果顯示,這2個仿制藥與原研藥存在較明顯的差異。
盡管在本研究中,2個硫辛酸注射液仿制藥在質量標準方面均符合《中國藥典》的有關規定,但是小鼠急性毒性實驗結果卻有明顯差異;因此難以證明這2個硫辛酸注射液仿制藥與原研藥在安全性方面的一致性。我國化學仿制藥(注射劑)一致性評價工作剛剛起步,因此,若僅僅依據注射液的理化性質、含量和有關物質檢查來評判一致性,似乎存在一定的問題。筆者認為,對于化學仿制藥(注射劑)一致性評價工作,注射液的急性毒性實驗結果具有重要的參考價值,建議增加對此項的評價。
參考文獻
[ 1 ] HUERTA AE,NAVAS-CARRETERO S,PRIETO-HONTORIA PL,et al. Effects of α-lipoic acid and eicosapentaenoic acid in overweight and obese women during weight loss[J]. Obesity,2015,23(2):313-321.
[ 2 ] 李雅杰,王舒然.硫辛酸對慢性非傳染性疾病影響[J].中國公共衛生,2014,30(2):152-154.
[ 3 ] 宋西玉,張鵬,李海霞,等.硫辛酸清除自由基的反應動力學研究[J].輻射研究與輻射工藝學報,2009,27(3):145- 150.
[ 4 ] 德國史達德大藥廠.硫辛酸注射液說明書[S]. 2011-02- 01.
[ 5 ] GOR?CA A,HUK-KOLEGA H,PIECHOTA A,et al. Lipoic acid:biological activity and therapeutic potential[J].Pharmacol Rep,2011,63(4):849-858.
[ 6 ] 李曼,張丹,饒競東,等.注射用丙戊酸鈉的質量一致性評價[J].華西藥學雜志,2017,32(6):621-624.
[ 7 ] 王瑞珣,楊文嶺,史芳華,等.注射用硼替佐米仿制藥與原研藥質量一致性評價[J].沈陽藥科大學學報,2018,35(7):574-580.
[ 8 ] 國家藥典委員會.中華人民共和國藥典:四部[S]. 2015年版.北京:中國醫藥科技出版社,2015:133-134,375.
[ 9 ] 馬宏達,胡北,吳瓊,等.硫辛酸膠囊含量測定及其穩定性[J].醫藥導報,2014,33(3):367-369.
[10] 趙婭,馮慧,周珍,等. HPLC法同時測定四味姜黃湯散中7種成分的含量[J].中國藥房,2018,29(1):29-33.
[11] EUROPEAN PHARMACOPOEIA COMMISSION. European Pharmacopeia 8.0:volume Ⅲ[S]. Strasbourg:European Directorate for the Quality of Medicine,2008:3405- 3406.
[12] 姜典卓. 2015年版《中國藥典》中有關問題的探討[J].中國藥品標準,2016,17(5):325-328.
[13] 夏天水,熊全紅,羅云龍. HPLC法測定硫辛酸注射液中的有關物質[J].中國藥房,2016,27(21):2980-2982.
[14] 劉昌孝,孫瑞元.藥物評價實驗設計與統計學基礎[M]. 北京:軍事醫學科學出版社,1999:84-88.
[15] 國家食品藥品監督管理總局.藥物單次給藥毒性試驗技術研究技術指導原則[S]. 2014-05-13.
[16] 許羚,胡玥,丁曉霜,等.雷公藤紅素體內與體外急性毒性試驗結果的比較[J].環境與職業醫學,2015,32(6):535-538,548.
[17] USUI K,NISHIDA S,SUGITA T,et al. Acute oral toxicity test of chemical compounds in silkworms[J]. Drug Discov & Ther,2016,10(1):57-61.
[18] 周一平.用SPSS軟件計算新藥的LD50[J].藥學進展,2003,27(5):314-316.
[19] 劉曉丹,何軍,張景辰,等.注射劑仿制藥一致性評價技術要求淺析[J].中國醫藥工業雜志,2018,49(7):999-1005.
[20] 胥洋,李曉光,趙榮生.硫辛酸注射液制劑的質量評價研究[J].中國新藥雜志,2015,24(14):1624-1627,1674.
(收稿日期:2019-04-28 修回日期:2019-06-14)
(編輯:劉 萍)

