不同濃度Cd2+脅迫下煙草實時熒光定量PCR內參基因的篩選
池俊玲 趙一博 郭江波 張龍 劉漢陽 辛翠花









摘要:【目的】篩選出鎘(Cd)脅迫下煙草的最佳內參基因,為后續研究與Cd2+相關的功能性基因提供理論依據。【方法】分別以0、250和500 mg/L氯化鎘(CdCl2)溶液對本生煙草進行脅迫處理,利用實時熒光定量PCR(qRT-PCR)檢測不同濃度Cd2+脅迫處理下肌動蛋白基因(ACT)、微管蛋白基因(TUB)、蛋白磷酸酶2基因(PP2A)、18S rRNA、甘油醛-3-磷酸脫氫酶基因(GAPDH)及轉錄延伸因子基因(EF1a)6個候選內參基因的表達情況,并利用geNorm和NormFinder綜合評價Ct各內參基因表達的穩定性。【結果】以不同濃度Cd2+脅迫處理的本生煙草cDNA為模板均可PCR擴增出ACT、TUB、18S rRNA、PP2A、GAPDH和EF1a等6個內參基因。6個內參基因的qRT-PCR擴增曲線走勢正常,平行性好,無引物二聚體和非特異性條帶產生,且繪制的標準曲線上各點基本分布在一條直線上,擴增效率在要求范圍(90.00%~105.00%)之內,符合下一步評價要求,且斜率的回歸系數(R2)>0.9800,說明線性關系較好。GAPDH和EF1a基因的表達豐度較高,18S rRNA處于中等水平,ACT、TUB和PP2A基因的表達豐度較低。geNorm分析結果顯示,6個內參基因的表達穩定性排序為EF1a基因>GAPDH基因>ACT基因>TUB基因>PP2A基因>18S rRNA;NormFinder分析結果顯示,6個內參基因的表達穩定性排序為EF1a基因>TUB基因>GAPDH基因=PP2A基因>ACT基因>18S rRNA。【結論】EF1a基因在不同濃度Cd2+脅迫處理下表達水平較高,穩定性最好,可作為Cd脅迫下本生煙草的最佳內參基因。
關鍵詞: 煙草;鎘脅迫;實時熒光定量PCR(qRT-PCR);內參基因;篩選
中圖分類號: S572? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼: A
文章編號:2095-1191(2019)10-2133-08? ? ? 開放科學(資源服務)標識碼(OSID):
Screening of internal reference genes for real-time fluorescence quantitative PCR under different concentrations of
Cd2+ stress in tobacco
CHI Jun-ling, ZHAO Yi-bo, GUO Jiang-bo, ZHANG Long,
LIU Han-yang, XIN Cui-hua*
(School of Life Science and Technology, Inner Mongolia University of Science and Technology,
Baotou, Inner Mongolia? 014010, China)
Abstract:【Objective】The optimal reference genes for tobacco under cadmium(Cd) stress were screened,which laid the foundation for the subsequent study of functional genes related to heavy metal Cd2+. 【Method】The tobacco was treated with 0, 250 and 500 mg/L cadmium chloride(CdCl2) solution, and real-time quantitative PCR were used to detect the expression levels of six commonly used internal reference genes, including actin(ACT),tubulin(TUB), protein phosphatase 2(PP2A),18S rRNA,glyceraldehyde-3-phosphate dehydrogenase(GAPDH) and elongation factor 1-ɑ(EF1a), under different concentrations of Cd2+ stress. And the stability of expression of these internal reference genes were evaluated by the geNorm and NormFinder. 【Result】Six internal reference genes of ACT, TUB, 18S rRNA, PP2A, GAPDH and EF1a could be amplified by PCR using the tobacco cDNA treated with different concentrations of Cd2+ stress. The qRT-PCR amplification curves of the six internal reference genes showed normal trend, geed parallelism, no primer dimer and non-specfic bands, and the points on the standard curve were basically distributed on a straight line. The amplification efficiency was within the required range(90.00%-105.00%), it met the requirements of the next evaluation, and the slope regression coefficient R2>0.9800, indicating a good linear relationship. The expression abundances of GAPDH and EF1a were high and more stable,18S rRNA was in the middle,and the expression? abundances of ACT,TUB and PP2A were low. The expression stability of EF1a was the highest in the geNorm program under different concentrations of Cd2+ stress,followed by GAPDH,TUB,PP2A,ACT and 18SrRNA. The NormFinder analysis showed that the expression stability rank was EF1a>TUB>GAPDH=PP2A>ACT>18S rRNA. 【Conclusion】EF1a has higher expression under diffe-rent concentrations of Cd2+ stress, and is the most stable one. It can be used as the optimal reference gene for tobacco under different concentrations of Cd stress.
Key words: tobacco; cadmium stress; real-time fluorescent quantitation PCR(qRT-PCR); reference gene; selection
0 引言
【研究意義】鎘(Cd)是生物體非必需且毒性很強的重金屬元素,可導致植物發生一系列生理生化病變使其新陳代謝紊亂,嚴重時出現死亡癥狀(Andresen and Kupper,2013;Hui et al.,2015)。煙草(Nicotiana benthamiana)作為一種模式植物,因其生長周期短、個體小,常被用于研究基因功能。實時熒光定量PCR(qRT-PCR)因具有特異性強、靈敏度高和實時檢測等優點,是研究基因功能的有效手段(Maurin,2012),但其檢測結果的精確性和可靠性常受RNA提取純化質量、擴增效率及內參基因等因素的影響(Li et al.,2015,Ma et al.,2016)。選擇以適宜內參基因以控制樣品間的非特異性變異,是有效準確進行基因表達量標準化處理的前提(Lee et al.,2010)。因此,檢測不同濃度Cd2+脅迫下煙草不同內參基因的表達情況,篩選出煙草在Cd脅迫下的最佳內參基因,對后續研究Cd2+相關的功能性基因具有重要意義。【前人研究進展】目前,植物功能性基因研究中常用的內參基因包括肌動蛋白基因(ACT)、微管蛋白基因(TUB)、蛋白磷酸酶2基因(PP2A)、18S rRNA、甘油醛-3-磷酸脫氫酶基因(GAPDH)和轉錄延伸因子基因(EF1a)等(Niu et al.,2015)。Nicot等(2005)對馬鈴薯在不同生理環境下內參基因表達穩定性進行比較分析,結果發現,在生物脅迫下EF1a和18S rRNA序列表達較穩定,鹽脅迫下CYP和EF1a基因表達較穩定,低溫脅迫下EF1a和L2基因表達較穩定。Wang等(2014)篩選非生物脅迫下油菜的最佳內參基因,結果發現鹽脅迫和干旱脅迫下PP2A基因是最佳內參基因,而重金屬Cr6+脅迫下ACT7基因是最佳內參基因。崔菲菲等(2018)研究發現,大白菜—結球甘藍易位體系在不同發育時期、組織部位及激素處理下的最適內參基因各不相同:UKN1和TUB4基因是營養生長期的最佳內參基因;BcT1P41和ACTIN基因是包心期經生長素IAA處理下的最佳內參基因,但UKN1和BcTIP41基因是生長素抑制劑TIBA處理下的最佳內參基因。潘虹等(2019)對不同光質培養的刺葡萄紅色愈傷組織功能性基因的表達進行qRT-PCR檢測時,分別以a-Tubulin、AP-2、60SRP、EF1a和UBQ基因為候選內參基因,利用geNorm、Normfinder和BestKeeper對其表達穩定性進行分析比較,最終確定a-Tubulin和60SRP基因為最佳內參基因。張穎等(2019)研究發現,ACT和EF1a基因可作為杉木不同組織中功能性基因表達的qRT-PCR最佳內參基因。【本研究切入點】目前,鮮見有關不同濃度Cd2+脅迫下煙草qRT-PCR內參基因篩選的研究報道。【擬解決的關鍵問題】研究不同濃度Cd2+脅迫下本生煙草中ACT、TUB、PP2A、18S rRNA、GAPDH和EF1a等6個候選內參基因的表達情況,并利用GeNorm和NormFinder對其表達穩定性進行綜合評價,最終篩選出最佳內參基因,為后續研究與Cd2+相關的功能性基因提供理論依據。
1 材料與方法
1. 1 試驗材料
本生煙草和大腸桿菌(Escherichia coli)DB3.1均由內蒙古科技大學生命科學與技術學院實驗室保存提供。TRIzol試劑、2×Taq PCR Master Mix、pGM-T載體、瓊脂糖凝膠DNA回收試劑盒和質粒小提試劑盒購自天根生化科技(北京)有限公司;SYBR?Premix Ex TaqTM II(Tli RNaseH Plus)購自TaKaRa公司;限制性內切酶EcoR I購自賽默飛世爾科技(中國)有限公司。主要儀器設備:梯度PCR儀(美國Bio-Rad公司)、高速冷凍離心機(Thermo SCIENTIFIC公司)、電熱恒溫培養箱(上海—恒科學儀器有限公司)和ABI 7500實時熒光定量PCR儀(Thermo SCIENTIFIC公司)等。
1. 2 試驗方法
1. 2. 1 材料種植及Cd2+脅迫處理 將本生煙草種植于有機土與蛭石等體積混合的花盆中,置于溫室中培養。待煙草植株長出4片真葉時,分別用0(對照)、250和500 mg/L氯化鎘(CdCl2)溶液澆灌煙草,每周澆灌2次,每次150 mL,2周后分別采集各處理植株葉片0.1 g,用于RNA提取。
1. 2. 2 總RNA提取及cDNA合成 分別將不同濃度Cd2+協迫處理的本生煙草葉片置于預冷研缽中,用液氮研磨至粉末狀,按照TRIzol試劑說明提取RNA,用NanoDrop 2000紫外可見分光光度計測定其濃度,并用變性瓊脂糖凝膠電泳檢測其質量和完整性。以提取的RNA為模板,利用TransScript One-Step gDNA Removal and cDNA Synthesis Super Mix試劑盒反轉錄合成cDNA第一鏈,稀釋5倍后-20 ℃保存備用。
1. 2. 3 引物設計 根據NCBI數據庫中本生煙草基因組信息,選取ACT、TUB、PP2A、18S rRNA、GAPDH和EF1a6基因為候選內參基因,利用Primer 5.0設計其qRT-PCR擴增引物(表1),引物由上海捷瑞生物工程有限公司合成。
1. 2. 4 內參基因PCR擴增 以不同濃度Cd2+協迫處理的本生煙草葉片cDNA為模板,用6個內參基因引物進行PCR擴增,反應體系50.0 μL:cDNA模板2.0 μL,2×Taq PCR Master Mix 25.0 μL,10 μmol/L上、下游引物各4.0 μL,ddH2O補足至50.0 μL。擴增程序:94 ℃預變性5 min;94 ℃ 30 s,65 ℃ 20 s,72 ℃ 20 s,進行35個循環;72 ℃延伸10 min,4 ℃保存備用。PCR擴增產物用1%瓊脂糖凝膠電泳進行檢測。
1. 2. 5 重組載體構建 參照瓊脂糖凝膠DNA回收試劑盒說明切膠回收內參基因目的片段,連接至pGM-T載體上,采用熱激法將其轉化大腸桿菌DB3.1感受態細胞,經菌落PCR篩選出陽性克隆,提取其質粒,利用EcoR I限制性內切酶對其進行酶切驗證。酶切驗證為陽性的克隆接種于含氨芐青霉素的LB液體培養基中,37 ℃下180 r/min搖床過夜培養后送上海捷瑞生物工程有限公司測序。
1. 2. 6 內參基因qRT-PCR檢測 分別以不同濃度Cd2+處理的本生煙草葉片cDNA為模板對6個候選內參基因進行qRT-PCR檢測,每處理的cDNA模板設3個生物學重復。反應體系20.0 μL:2×SYBR?Premix Ex TaqTM II(Tli RNaseH Plus)10.0 μL,10 μmol/L上、下游引物各0.4 μL,50×ROX Reference Dye II 0.4 μL,cDNA模板1.0 μL,ddH2O補足至20.0 μL。擴增程序:95 ℃預變性30 s;95 ℃ 5 s,65 ℃ 34 s,進行40個循環。PCR反應結束后儀器自動讀取數據。
1. 3 統計分析
使用Excel 2013對內參基因不同稀釋梯度下的循環閾值(Ct)進行整理,計算Ct均值,繪制標準曲線。再利用2-△△Ct法計算不同濃度Cd2+脅迫下候選基因的相對表達量。根據6個內參基因在各樣品中的相對表達量,分別以geNorm和NormFinder對其表達穩定性進行分析比較,綜合測評篩選出最佳內參基因。
2 結果與分析
2. 1 總RNA提取及質量檢測結果
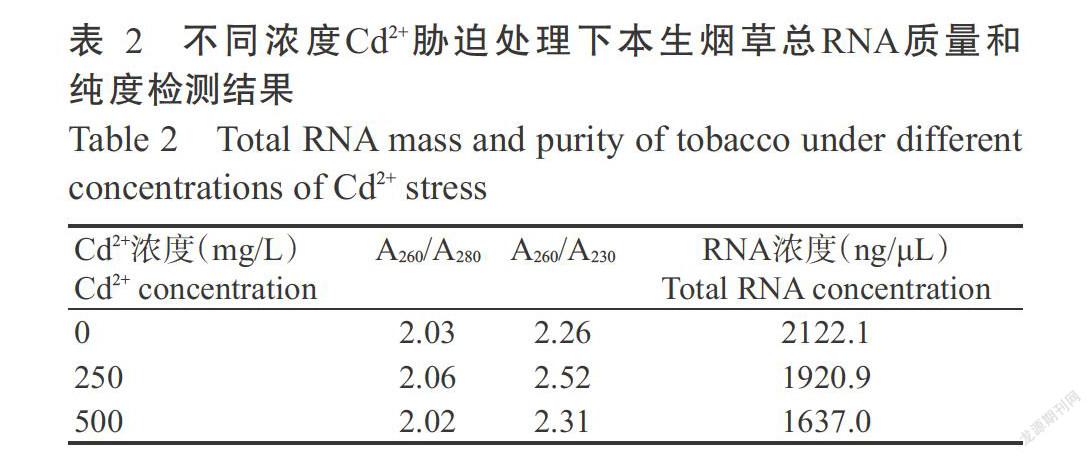
利用TRIzol法提取不同濃度Cd2+脅迫處理的本生煙草葉片總RNA,電泳檢測結果(圖1)顯示,28S rRNA條帶亮度約是18S rRNA條帶亮度的2倍,條帶清晰,說明總RNA樣品的完整性較好。核酸定量儀檢測結果(表2)顯示,總RNA樣品A260/A280約2.00,A260/A230>2.00,平均濃度為1893.3 ng/μL,表明不同濃度Cd2+脅迫處理的本生煙草總RNA提取質量和純度較高,可用于后續試驗。
2. 2 內參基因PCR擴增結果
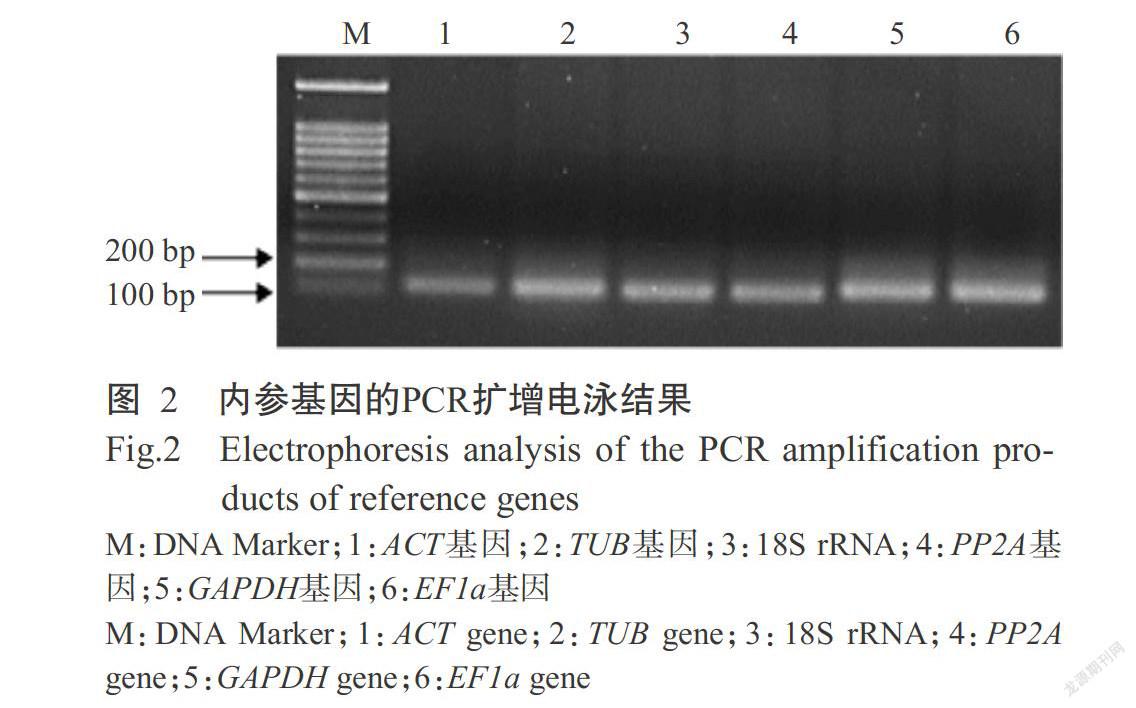
對不同濃度Cd2+脅迫處理的本生煙草cDNA進行PCR擴增,PCR產物用1%瓊脂糖凝膠電泳檢測,結果顯示,從不同濃度Cd2+脅迫處理的本生煙草cDNA均擴增出目標片段,且擴增出的ACT、TUB、18S rRNA、PP2A、GAPDH和EF1a內參基因長度與預期結果基本一致,且特異性較高。圖2為以250 mg/L Cd2+脅迫處理本生煙草cDNA為模板的擴增結果。
2. 3 重組質粒的酶切驗證結果
ACT、TUB、18S rRNA、PP2A、GAPDH和EF1a 6個內參基因重組質粒酶切鑒定結果如圖3所示,均獲得2條條帶,且條帶大小與預期結果一致,表明6個內參基因片段已成功連接至pGM-T載體中。
2. 4 內參基因的qRT-PCR檢測結果
2. 4. 1 內參基因擴增曲線和熔解曲線分析結果
將含內參基因的重組質粒10倍梯度稀釋(10-1~10-9)后進行qRT-PCR檢測,結果如圖4所示。內參基因擴增曲線走勢正常,平行性好;55~95 ℃熔解曲線僅出現明顯單一峰,表明無引物二聚體和非特異性條帶產生,所用引物均能特異擴增。
2. 4. 2 內參基因的標準曲線 以重組質粒10-1~10-9稀釋梯度的對數(起始數量的對數)為x軸、Ct為y軸繪制6種內參基因的標準曲線(圖5),并計算擴增效率E(%)=(10-1/斜率-1)×100,結果如表5所示。內參基因ACT、TUB、18S rRNA、PP2A、GAPDH和EF1a的模板濃度與Ct成反比,各點基本分布在一條直線上,擴增效率在要求范圍(90.00%~105.00%)之內,符合下一步評價的要求,且標準曲線斜率的回歸系數(R2)>0.9800,說明線性關系較好。
2. 4. 3 內參基因的表達豐度分析結果 基因表達豐度是指基因轉錄成mRNA的數量,基因表達豐度越高,轉錄mRNA的數量愈多,合成的蛋白也越多。Ct越大,代表基因拷貝數越低,基因表達豐度越低。由圖6可知,6個內參基因在0、250和500 mg/L Cd2+脅迫下的表達水平均存在明顯差異,整體來說,處理組(250和500 mg/L Cd2+脅迫)與對照組(0 mg/L Cd2+脅迫)存在顯著差異(P<0.05)或極顯著差異(P<0.01),說明Cd2+脅迫處理對內參基因的表達具有顯著或極顯著影響,以保證后續數據可靠有效,其中,ACT、TUB和PP2A基因的表達豐度較低,18S rRNA處于中等水平,而GAPDH和EF1a基因的表達豐度較高,說明GAPDH和EF1a基因適宜作為不同濃度Cd2+脅迫下本生煙草的內參基因。
2. 4. 4 內參基因的表達穩定性分析 利用geNorm程序計算6個內參基因在不同濃度Cd2+脅迫下的表達穩定值(M),結果如圖7所示。6個內參基因的M排序為18S rRNA(1.708)>PP2A基因(1.428)>TUB基因(1.368)>ACT基因(1.240)>GAPDH基因(1.228)>EF1a基因(1.140),由于M越低內參基因表達越穩定,故EF1a基因表達最穩定,最適宜作為在不同濃度Cd2+脅迫下本生煙草的內參基因,其次是GAPDH和TUB基因,而18S rRNA表達最不穩定,最不適合作為內參基因。利用NormFinder程序計算內參基因在不同濃度Cd2+脅迫下的表達穩定值(S),結果如表6所示。6個內參基因的S排序為18S rRNA(1.106)>ACT基因(0.825)>GAPDH基因=PP2A基因(0.696)>TUB基因(0.472)>EF1a基因(0.411),由于S越低,基因表達越穩定,故EF1a基因表達最穩定,最適宜作不同濃度Cd2+脅迫下本生煙草的內參基因,而18S rRNA表達最不穩定,最不適合作為內參基因,與geNorm程序分析結果一致。
3 討論
qRT-PCR是檢測基因表達變化的最佳方法之一(Bustin et al.,2005)。在分析功能性基因表達之前,必須選擇適宜內參基因以控制樣品之間的非特異性變異。在不同生物和生理狀態下穩定表達的內參基因才可有效用于表達量的標準化(Lee et al.,2010)。理論上,理想的內參基因應在所有細胞和組織形態及不同試驗條件下均能穩定表達且不受外界環境影響(Tong et al.,2009),但目前尚未發現一個這樣理想的內參基因。已有研究表明,即使內參基因在一種物種或組織中穩定表達,但在不同試驗條件下也會表現出不同的穩定性(Guénin et al.,2009;Artico et al.,2010)。因此,在分析功能性基因表達之前,必須事先驗證所有內參基因,確定其在某些條件下的表達穩定性,以保證試驗結果的準確性(Bustin,2002;Gutierrez et al.,2008;Guénin et al.,2009)。
本研究選取植物功能性基因研究中常用的6個內參基因,利用geNorm和NormFinder分析其表達穩定性,從而篩選出不同濃度Cd2+脅迫下本生煙草的最佳內參基因。其中,geNorm是確定穩定內參基準的最佳數量以精確標準化的簡便方法(Vandesompele et al.,2002),而NormFinder用于評估geNorm獲得的排名質量(Andersen et al.,2004;Pfaffl et al.,2004)。本研究根據qRT-PCR的Ct進行內參基因表達豐度分析,結果顯示ACT、TUB和PP2A基因的表達豐度較低,18S rRNA處于中等水平,GAPDH和EF1a基因的表達豐度較高,可初步確定GAPDH和EF1a基因可作為Cd2+脅迫下本生煙草的內參基因。經geNorm和NormFinder對其穩定性進行分析后發現EF1a基因表達穩定性最好,因此,EF1a基因是不同濃度Cd2+脅迫下本生煙草的最佳內參基因。
4 結論
EF1a基因在不同濃度Cd2+脅迫處理下表達水平較高,穩定性最好,可作為Cd脅迫下本生煙草的最佳內參基因。
參考文獻:
崔菲菲,孟川,王彥華,趙建軍,陳雪平,申書興,顧愛俠. 2018. 大白菜—結球甘藍易位系實時熒光定量PCR內參基因的篩選[J]. 華北農學報,33(5):60-67. [Cui F F,Meng C,Wang Y H,Zhao J J,Chen X P,Shen S X,Gu A X. 2018. Reference genes selection for quantitative real-time PCR in Chinese cabbage-cabbage translocation lines[J]. Acta Agriculturae Boreali-Sinica,33(5):60-67.]
潘紅,賴呈純,張靜,黃賢貴,林玉玲,賴鐘雄. 2019. 不同光質條件下刺葡萄紅色愈傷組織的RT-qPCR內參基因篩選[J]. 應用與環境生物學報. doi:10.19675/j.cnki.1006-687x.2019.01038. [Pan H,Lai C C,Zhang J,Huang X G,Lin Y L,Lai Z X. 2019. Selection of reference genes for RT-qPCR in red callus of Vitis davidii(Rom. Caill) Fo?x under different light qualities[J]. Chinese Journal of Applied and Environmental Biology. doi:10.19675/j.cnki.1006-687x.2019.01038.]
張穎,陳婉婷,陳冉紅,帥鵬,李明. 2019. 杉木實時熒光定量PCR分析中內參基因的選擇[J]. 林業科學研究,32(2):65-72. [Zhang Y,Chen W T,Chen R H,Shuai P,Li M. 2019. Selection of internal reference genes in real-time fluorescent quantitative PCR analysis of Cunninghamia lanceolata[J]. Forest Research,32(2):65-72.]
Andersen C L,Jensen J L,?rntoft T F. 2004. Normalization of real-time quantitative reverse transcription-PCR data:A model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J]. Cancer Research,64(15):5245-5250.
Andresen E,Kupper H. 2013. Cadmium toxicity in plants[J]. Metal Ions in Life Sciences,11:395-413.
Artico S,Nardeli S M,Brilhante O,Grossi-de-Sa M F,Alves-Ferreira M. 2010. Identification and evaluation of new reference genes in Gossypium hirsutum for accurate normalization of real-time quantitative RT-PCR data[J]. BMC Plant Biology,10(1):49.
Bustin S A,Benes V,Nolan T,Pfaffl M W. 2005. Quantitative real-time RT-PCR—A perspective[J]. Journal of Molecular Endocrinology,34(3):597-601.
Bustin S. 2002. Quantification of mRNA using real-time reverse transcription PCR(RT-PCR):Trends and problems[J]. Journal of Molecular Endocrinology,29(1):23-29.
Guénin S,Mauriat M,Pelloux J,Van Wuytswinkel O,Bellini C,Gutierrez L. 2009. Normalization of qRT-PCR data:The necessity of adopting a systematic,experimental conditions-specific,validation of references[J]. Journal of Experimental Botany,60(2):487-493.
Gutierrez L,Mauriat M,Guénin S,Pelloux J,Lefebvre J F,Louvet R,Rusterucci C,Moritz T,Guerineau F,Bellini C,Van Wuytswinkel O. 2008. The lack of a systematic validation of reference genes:A serious pitfall underva-lued in reverse transcription-polymerase chain reaction(RT-PCR) analysis in plants[J]. Plant Biotechnology Journal,6(6):609-618.
Hui F Q,Liu J,Gao Q K,Lou B G. 2015. Piriformospora indica confers cadmium tolerance in Nicotiana tabacum[J]. Journal of Environmental Sciences,37(11):184-191.
Lee J M,Roche J R,Donaqhy D J,Thrush A,Sathish P. 2010. Validation of reference genes for quantitative RT-PCR studies of gene expression in perennial ryegrass(Lolium perenne L.)[J]. BMC Molecular Biology,11(11):8.
Li Z L,Liu Z H,Chen R J,Li X J,Tai P D,Gong Z Q,Jia C Y,Liu W. 2015. DNA damage and genetic methylation changes caused by Cd in Arabidopsis thaliana seedlings[J]. Environmental Toxicology and Chemistry,34(9):2095-2103.
Ma K S,Li F,Liang P Z,Chen X W,Liu Y,Gao X W. 2016. Identification and validation of reference genes for the normalization of gene expression data in qRT-PCR analysis in Aphis gossypii(Hemiptera:Aphididae)[J]. Journal of Insect Science,16(1):17.
Maurin M. 2012. Real-time PCR as a diagnostic tool for bacterial diseases[J]. Expert Review of Molecular Diagnostics,12(7):731-754.
Nico N,Hausman J F,Hoffmann L,Evers D. 2005. Housekeeping gene selsction for real-time RT-PCR normalization in potato during biotic and abiotic stress[J]. Journal of Experimental Botany,56(421):2907-2914.
Niu L,Tao Y B,Chen M S,Fu Q,Li C,Dong Y,Wang X,He H,Xu Z F. 2015. Selection of reliable reference genes for gene expression studies of a promising oilseed crop,Plukenetia volubilis,by real-time quantitative PCR[J]. International Journal of Molecular Sciences,16(6):12513-12530.
Pfaffl M W,Tichopad A,Prgomet C,Neuvians T P. 2004. Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:BestKeeper–Excel-based tool using pair-wise correlations[J]. Biotechnology Letters,26(6):509-515.
Tong Z G,Gao Z H,Wang F,Zhou J,Zhang Z. 2009. Selection of reliable reference genes for gene expression stu-dies in peach using real-time PCR[J]. BMC Molecular Biology,10(1):71.
Vandesompele J,De Preter K,Pattyn F,Poppe B,Van Roy N,De Paepe A,Speleman F. 2002. Accurate normalization of real-time quantitative RT-PCR data by geometric avera-ging of multiple internal control genes[J]. Genome Bio-logy,3(7):research0034.1.doi:10.1186/gb-2002-3-7-research0034.
Wang Z,Chen Y,Fang H,Shi H,Chen K,Zhang Z,Tan X. 2014. Selection of reference genes for quantitative reverse-transcription polymerase chain reaction normalization in Brassica napus under various stress conditions[J]. Molecular Genetics and Genomics,289(5):1023-1035.
(責任編輯 陳 燕)

