負負得正的癌癥免疫療法
陳辰 李斌
2018年度的諾貝爾生理學或醫學獎授予美國免疫學家艾利森和日本免疫學家本庶佑.以表彰他們發現抑制免疫負調節的癌癥療法.從根本上改變了人們對癌癥冶療方式的看法。
2018年10月1日,2018年諾貝爾生理學或醫學獎揭曉。美國免疫學家艾利森(J.P.Allison)教授與日本免疫學家本庶佑(T.Honjo)教授因在癌癥免疫治療領域的奠基性工作而摘得桂冠。艾利森是美國得克薩斯大學安德森癌癥中心免疫學研究負責人,是分離出T細胞抗原復合物蛋白的第一人,他同時發現,如果暫時抑制T細胞表面的CTLA-4這一免疫系統分子“制動器”的活性,就能提高免疫系統對腫瘤細胞的攻擊性,殺傷腫瘤,從而縮小腫瘤體積。他對T細胞的發育和激活,以及免疫系統“制動器”機理的卓越研究,為癌癥治療開創了全新思路。本庶佑現任京都大學高等研究院特別教授,他建立了免疫球蛋白類型轉換的基本概念框架,提出了一個解釋抗體基因在模式轉換中變化的模型,首先鑒定PD-1為活化T細胞上的誘導型基因,這一發現為PD-1阻斷建立癌癥免疫治療原理做出了重大貢獻。
癌癥的免疫治療
癌癥是由不受控制的細胞增殖和遷移所引起的一系列惡性病變的統稱,從器官開始浸潤相鄰組織開始,最終通過血液或淋巴轉移到其他器官,導致發病和死亡。癌癥的病因和發病機制很復雜,其特征有的與調節分裂、死亡、代謝和遷移等內在的細胞過程有關,有的則體現為腫瘤微環境與形成血管、基質或免疫系統的細胞之間的相互作用[1]。各種特征受多種因素的影響,這些因素會因癌細胞基因的變化而變化,其中一些變化通過種系DNA遺傳得到,而大部分變化則是在體細胞突變后發生。
目前治療癌癥有三大手段:手術切除,輻射消除,藥物攻擊。雖然在過去50多年里,癌癥治療有了很大的進展,但是平均來說,有超過2/3的癌癥患者無法痊愈,很多癌癥的治愈率維持在較低水平,全球每年有數百萬人死于癌癥。因此,對于新治療方法和策略的需求十分迫切。
早在19世紀末20世紀初,人們意識到激活免疫系統可能是一種攻擊腫瘤細胞的策略。紐約癌癥醫院(紀念斯隆一凱特琳癌癥中心的前身)的外科醫生科利(W.Coley)曾試圖用已高溫殺死的細菌刺激免疫系統來對抗惡性腫瘤。他發現一些在癌癥手術后發生感染的患者,其存活的時間似乎更長,由此推測病原體在機體內激起的免疫反應可能會影響腫瘤。之后,對免疫系統的深入研究揭示了人體防御系統的分子組成、化學介質及精確控制該系統的分子開關,人們逐漸了解了免疫系統是如何動員起來的,進而發現可能引起嚴重感染的病原體,包括細菌和病毒。同樣重要的是,人們對調節免疫系統抗癌應答機制和通路也有了深入了解,其中,免疫檢查點(immune checkpoints)是大量分布在免疫系統中的抑制性通路,對維持機體自身的耐受、免疫應答的時間和強弱起著關鍵的調節作用,它們在免疫激活后開始參與反應,將免疫反應對周圍組織可能造成的損傷減少到最小,避免正常組織受損。
免疫系統中的“加速器”和“制動器”
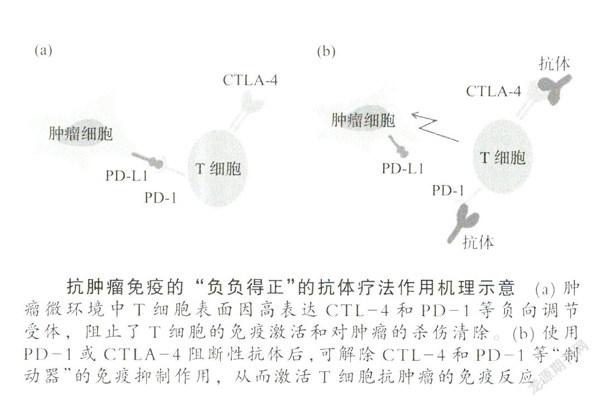
機體免疫系統的基本屬性是能夠區分“自我”和“非自我”,從而可以攻擊和消除入侵的細菌、病毒等病原體及其他危險信號。第一道防線是機體的固有免疫系統,抗腫瘤免疫的“負負得正”的抗體療法作用機理示意(a)腫瘤微環境中T細胞表面因高表達CTL-4和PD-1等負向調節受體,阻止了T細胞的免疫激活和對腫瘤的殺傷清除。(h)使用PD-1或CTLA-4阻斷性抗體后,可解除CTL-4和PD-1等“制動器”的免疫抑制作用,從而激活T細胞抗腫瘤的免疫反應由白細胞(如中性粒細胞和單核細胞)負責協調,進行對細菌和病毒的非特異性免疫反應,專門識別細菌或病毒中常見的分子結構,如部分表面結構,或有別于高等生物的DNA和RNA分子,盡管這些白細胞并不能特異性地識別并攻擊某些蛋白結構,卻能抵擋許多微生物的人侵,將其分解成小分子片段,即所謂的抗原。之后,免疫系統便會將抗原視為異物,予以消滅。第二道防線是適應性免疫系統,專門識別抗原,繼而發動更精準的免疫攻擊。如果攻擊有效,機體就會產生對該種病原的“記憶”,一旦再遇相同的入侵病原體,便能輕易將其擊潰,T細胞和B細胞是適應性免疫反應的核心角色。T細胞發源于胸腺,有多種類型,B細胞來自骨髓,能制造抗體。抗體分子與T細胞上一些特定的分子結構一樣,能夠附著在特定的抗原上,這樣就可鎖定目標,通過免疫反應消滅細菌和表面帶有抗原的受感染細胞
腫瘤細胞是發生了遺傳變異等病理變化的自體細胞,會表達異常的分子,這些分子對T細胞或B細胞來說就是異物,所以免疫系統能識別出腫瘤細胞。但是,在多種因素的作用下,機體對于腫瘤的免疫攻擊并未產生顯著效果。不懈的努力之下,科學家發現腫瘤細胞會與免疫系統的“制動器”協同作用,抑制機體針對腫瘤細胞的免疫反應,逃避了免疫系統的攻擊,這一原理為癌癥的免疫治療開辟了一條新思路。
每個T細胞都有獨特的受體,它們類似免疫系統的“加速器”,可以與被識別出的非自身抗原結合,激活免疫反應。但是,在腫瘤組織微環境下,由于殺傷性T細胞表面的負向調控受體蛋白(如PD-1)被腫瘤細胞表達的負向信號受體的配體蛋自(如PD-L1)結合,抑制了T細胞的激活,從而制動了抗腫瘤的免疫反應。現已確定了一批T細胞表達的具負向調控功能的表面受體蛋自,這些蛋白像“制動器”一樣抑制免疫激活。機體通過控制加速器蛋白和制動器蛋白之間微妙的平衡,確保免疫系統充分參與對外來微生物的攻擊,同時又避免過度激活帶來的自身免疫性破壞。
許多T細胞都能表達CTLA-4蛋白,在細胞靜息時它駐留在T細胞內部,當特定的T細胞識別出作用目標,同時接收到來自其他分子的啟動信號時,該蛋白被激活。一旦激活,CTLA-4就與其他蛋白協同作用,于擾由T細胞受體和共刺激分子受體引發的正信號,成為一種T細胞活化的負調節因子,起到“制動器”的作用,防止過度活躍的免疫系統對機體自身造成破壞。如果CTLA-4蛋自永久性缺乏,將會引發災難性的自身免疫反應。
腫瘤免疫檢查點阻斷技術
隨著對腫瘤細胞逃避免疫系統識別和清除的機制了解得越來越清晰,人們可以通過重新“關閉”一些被腫瘤細胞激活的、會對免疫系統產生抑制功能的通路,釋放機體的免疫抑制,達到阻止腫瘤細胞發生免疫逃逸、調動自身免疫系統功能來消除腫瘤的目的。這種被稱為腫瘤免疫檢查點阻斷技術,已成為腫瘤免疫治療的主要研究方向,相應的藥物研發也成為國內外企業競相角逐的市場)
針對CTLA-4蛋白的阻斷
1994年底,艾利森提出假設:如果能暫時抑制CTLA-4這一分子“制動器”的活性,是否就能提高免疫系統對腫瘤細胞的攻擊性,從而縮小腫瘤的體積。他用抗CTLA-4的單克隆抗體處理患有腫瘤的小鼠,結果抑癌效果相當顯著。并發現這種針對免疫系統的療法具有完全治愈荷瘤小鼠的潛力,阻斷CTLA-4會增強T細胞的抗腫瘤反應,排斥反應后是持久的腫瘤免疫。這項工作象征了免疫療法的誕生,具有重新釋放機體對腫瘤反應能力的單克隆抗體則被稱為免疫檢查點抑制劑。
當時的制藥業對于基于去除免疫應答制動的腫瘤免疫治療并無太大興趣,因為不知道哪些特異性抗原能在腫瘤細胞上被識別,也不符合當時普遍認為的應基于發現并激活腫瘤抗原的腫瘤治療策略。而且,缺乏CTLA-4的小鼠會產生嚴重的自身免疫反應,這種不良反應有很大風險,使人望而卻步。然而,通過堅持不懈的努力,艾利森與一家生物技術公司合作,成功地制備出可臨床使用的抗CTLA-4人源化單克隆抗體1999年他們開發出名為MDX-010的抗CTLA-4 IgG l單克隆抗體,也就是后來的伊匹單抗[ipilimumab),并招募那些對其他療法完全無應答的晚期癌癥患者進行臨床試驗。第一次臨床試驗中就在一些黑色素瘤患者身上觀察到響應。同年,在另一項黑色素瘤患者治療試驗中,結果顯示黑色素瘤可完全消退,同時也觀察到患者產生了嚴重的自身免疫反應,這些反應比采用化療方式之后出現的更頻繁。這種方法的療效很難通過測量腫瘤體積來判斷,因此,研究人員采用了一個既簡單又重要的標準來評判伊匹單抗的療效,這一標準就是“整體存活期”,即患者的生存時間。最新臨床試驗結果顯示,伊匹單抗治療后,20%以上的轉移性黑色素瘤患者的病情在較長時間內得到了控制,治療后存活時間達3年以上。而之前的轉移性黑色素瘤患者的中位預期壽命僅為7~8個月。
針對PD-1蛋白的抑制
本庶佑小組在1990年代早期發現并克隆了PD-1,其功能多年來一直難以捉摸,通過十多年對缺乏這種分子的基因敲除小鼠的研究發現,敲除了PD-1的小鼠類似于敲除了CTLA-4的小鼠,會發生T細胞驅動的自身免疫綜合征。本庶佑由此得出結論,PD-I與CTLA-4類似,對免疫反應起負調節作用,并發現了它的配體PD-L1,不久又確定了PD-1的第二種配體PD-L2。
PD-I/PD-L1途徑可能參與腫瘤免疫反應的假設,最早在2002年發表的兩項研究中得以測試證實,該配體(PD-L1)的表達可保護轉化細胞免受體內免疫系統攻擊,并可通過針對PD-L1的抗體逆轉結果[2,3]。現在已經了解PD-1 /PD-L1途徑在腫瘤免疫過程中的作用。
2005年本庶佑發表了用于治療小鼠腫瘤模型的PD-1抗體的工作,提出現今仍可用來預測臨床療效的結論:抗PD-1治療可誘導免疫反應,甚至對不表達PD-L1或PD-L2的腫瘤也能誘導出免疫反應;在腫瘤治療上比CTLA-4更有效;產生的自身免疫不良反應沒有CTLA-4的嚴重。這一進展促進了基于PD-1抑制的臨床研究,已開發出針對PD-1的臨床級抗體,2006年開始的第一階段臨床研究表明,該藥具良好的耐受性[4]。兩年后報道在一期臨床研究中,296名患者使用抗PD-I抗體的結果顯示,該抗體在治療黑色素瘤等多種實體瘤方面效果顯著。
癌癥免疫療法的愿景
免疫檢查點治療法從根本上改變了某些晚期癌癥患者的生存狀況。雖然與其他癌癥療法相比,不良反應依然可見,有些甚至會嚴重到危及生命,但是,它已經從根本上改變了人類對癌癥治療方式的看法,科學家將會不懈地研究,去改善治療方法和減少不良反應。
腫瘤免疫檢查點阻斷技術的研究主要集中在CTLA-4、PD1、PD-L1只個分子上。CTLA-4阻斷療法的主要弱點在于免疫毒性作用的高速率,接受抗CTLA-4治療的患者會發生許多不良反應,從而限制了它的廣泛應用。而PDl/PD-L1這一對免疫檢查點的表達更具選擇性,不會在正常炎性組織中過度表達,應用更安全,不良反應更小。
在臨床治療策略方面,針對PD-1檢查點治療被證明更為有效,它在包括肺癌、腎癌、淋巴瘤和黑色素瘤在內的多種癌癥治療中都有顯著效果。更進一步,新的臨床研究表明,針對CTLA-4和PD-I的聯合治療可能更為有效。艾利森和本庶佑也鼓勵人們努力結合不同的策略來激發免疫系統的反應,以便更有效地消除腫瘤細胞。期待在科學家、醫生、患者及其家庭、制藥企業和政府管理者等各方面的密切合作下,抗腫瘤免疫療法將會不斷得到改進,從而治愈更多癌癥患者,造福社會大眾。
[1]Bailey M H,Tokheim C,Porta-Pardo E,et al.Comprehensivecharacterization of cancer driver genes and mutations.Cell,2018,173(2):371-385.e18.
[2]Agata Y,Kawasaki A,Nishimura H,et al.Expression of the PD-1antigen on the surface of stimulated mouse T and B lymphocytes.IntImmunol,1996,8(5):765-72.
[3]Ansell S M,Lesokhin A M,Borrello I,et al.PD-I blockade withnivolumab in relapsed or refractory Hodgkin's lymphoma.N Engl JMed,2015,372(4):311-9
[4]Brahmer J R,Drake C G,Wollner I,et al.Phase I study of single-agent anti-programmed death-1(MDX-1106) in refractory solidtumors:safety,clinical activity,pharmacodynamics,and immunologiccorrelates.J Clin Oncol,2010,28(19):3167-75.
關鍵詞:諾貝爾生理學或醫學獎 癌癥 免疫療法 CTLA-4PD-1

