擬南芥rd29A啟動(dòng)子在不同脅迫下GUS活性分析
柳娜 楊文雄 王世紅 張雪婷 楊長(zhǎng)剛





摘要:通過(guò)特異PCR擴(kuò)增技術(shù),以擬南芥基因組DNA為模板,克隆了rd29A基因上游? ?1 600 bp的脅迫誘導(dǎo)型啟動(dòng)子序列。將此1 600 bp的調(diào)控序列與GUS基因連接構(gòu)建植物表達(dá)載體pBI101-rd29A-GUS,并用農(nóng)桿菌介導(dǎo)法轉(zhuǎn)基因擬南芥。定量PCR結(jié)果顯示,干旱脅迫下轉(zhuǎn)基因純合株系中rd29A顯著上調(diào)表達(dá)。GUS組織化學(xué)染色及GUS定量分析結(jié)果表明,在ABA、甘露醇和NaCl等脅迫處理下,GUS活性增強(qiáng),尤其是ABA脅迫處理。說(shuō)明rd29A啟動(dòng)子可以增強(qiáng)逆境下GUS基因的表達(dá),可作為一種誘導(dǎo)型啟動(dòng)子應(yīng)用于提高作物抗逆性的基因工程研究中。
關(guān)鍵詞:rd29A;干旱;ABA;NaCl;甘露醇;小麥
中圖分類(lèi)號(hào):S336? ? ? ?文獻(xiàn)標(biāo)志碼:A? ? ? ?文章編號(hào):1001-1463(2019)05-0040-07
Abstract:About 1600bp stress inducible promoter of rd29A from Arabidopsis thaliana genomic DNA was cloned by PCR. The plant expression vector pBI101-rd29A-GUS was constructed with this regulatory region linked up with GUS gene,and then transferred to Arabidopsis by Agrobacterium tumefaciens system. The expression level of rd29A was up-regulated under drought stress in homozygous seedlings. Histochemical analysis and quantitative analysis results showed that the GUS activity was enhanced under ABA、NaCl and mannitol treatments. Therefore, rd29A prompter can strengthen the expression of GUS gene under stresses, and can be used as an inducible promoter in gene engineering for stress resistance improvement of crops.
Key words:rd29A; Drought; ABA; NaCl; Mannitol; Wheat
在復(fù)雜的自然生境下,農(nóng)作物的生長(zhǎng)發(fā)育經(jīng)常會(huì)遭受到干旱、低溫、高鹽和澇旱等逆境脅迫的影響,進(jìn)而影響農(nóng)作物產(chǎn)量[1 ]。近年來(lái),現(xiàn)代生物育種技術(shù)在作物育種中的貢獻(xiàn)愈加顯著,其中利用基因工程技術(shù)提高植物抗逆性已成為分子生物學(xué)研究的重要領(lǐng)域之一[2 - 3 ]。轉(zhuǎn)基因技術(shù)作為一項(xiàng)強(qiáng)有力的工具,在不改變作物原有特性的基礎(chǔ)上,可以將控制植物抗逆的關(guān)鍵基因?qū)肫渲校瑥亩鴮?shí)現(xiàn)品種改良的目的。然而,大部分的轉(zhuǎn)基因是用CaMV35S植物組成型強(qiáng)啟動(dòng)子驅(qū)動(dòng)目的基因表達(dá),使得目的基因在植物不需要的情況下仍能強(qiáng)烈表達(dá),進(jìn)而改變植物正常的基因調(diào)控和代謝途徑,而引起植物的形態(tài)發(fā)生改變,影響植物的生長(zhǎng)發(fā)育,造成轉(zhuǎn)基因植物生長(zhǎng)緩慢、株型變小等[4 - 6 ]。
擬南芥rd29A啟動(dòng)子是逆境誘導(dǎo)型啟動(dòng)子,含有干旱、高鹽、低溫、ABA誘導(dǎo)表達(dá)等相關(guān)的順式作用元件(Yamaguchi-Shinozaki and Shinozaki,1994),可用于抗逆基因工程。因此,選擇合適的逆境誘導(dǎo)型啟動(dòng)子進(jìn)行克隆以替代CaMV35S啟動(dòng)子與特定的轉(zhuǎn)錄因子結(jié)合驅(qū)動(dòng)目的基因表達(dá),在提高植物的抗性并減小目的基因過(guò)量表達(dá)給轉(zhuǎn)基因植物帶來(lái)的不利影響等方面具有極大的優(yōu)越性。
研究發(fā)現(xiàn),rd29A的表達(dá)受多種環(huán)境因素誘導(dǎo),可響應(yīng)冷、干旱、鹽和脫落酸(ABA)等脅迫[7 ]。我們根據(jù)擬南芥rd29A起始密碼子上游1600bp的啟動(dòng)子序列設(shè)計(jì)引物,以DNA為模板,克隆獲得了該啟動(dòng)子,將其與植物表達(dá)載體pBI101-GUS連接,檢測(cè)了其在不同脅迫下的活性,以期為今后利用該誘導(dǎo)型啟動(dòng)子培育抗性作物品種(如小麥)提供研究基礎(chǔ)和應(yīng)用依據(jù)。
1? ?材料與方法
1.1? ?材料
1.1.1? ? 供試材料? ? 以擬南芥野生型(Col-0生態(tài)型)種子為材料。種子在4 ℃春化3 d后,用15%次氯酸鈉消毒,點(diǎn)種在MS培養(yǎng)基上。培養(yǎng)7 d后,取材提取RNA,反轉(zhuǎn)錄合成cDNA第一鏈后進(jìn)行基因克隆。同時(shí)將幼苗移至營(yíng)養(yǎng)土(土與蛭石按體積比3∶1配制)中,在23 ℃培養(yǎng)室培養(yǎng)(光照16 h、黑暗8 h)28 d左右,用于轉(zhuǎn)基因?qū)嶒?yàn)。
1.1.2? ? 主要試劑? ? 植物總RNA提取試劑盒(Tiangen)、反轉(zhuǎn)錄酶(Thermo Fisher)、MS粉(Duchefa)、高保真酶Prime STAR(Takara)、凝膠回收試劑盒(康潤(rùn)生物)、內(nèi)切核酸酶(NEB)、SYBR Green I(Takara)、0.2 mL PCR八連管(Bio-Rad)。卡那霉素、利福平、NaCl、甘露醇、Na2HPO4、NaH2PO4、SDS和Na2EDTA·2H2O購(gòu)自索萊寶,ABA購(gòu)自Sigma公司,X-Gluc和MUG購(gòu)自Goldbio公司。Triton X-100、β-巰基乙醇、Na2CO3、考馬斯亮藍(lán)G250和牛血清白蛋白BSA購(gòu)自上海生物工程有限公司。
1.2? ?方法
1.2.1? ? 載體構(gòu)建? ? 參照CTAB法[8 ]提取基因組DNA作為模板。選取rd29A的5’上游序列1 600 bp設(shè)計(jì)特異性引物進(jìn)行PCR擴(kuò)增。引物由華大基因公司合成。將克隆得到的片段回收后,由Hind III酶和XbaI酶進(jìn)行雙酶切,同時(shí)對(duì)載體pBI101-GUS用相同的酶雙酶切后,與酶切片段進(jìn)行連接,得到由擬南芥rd29A基因啟動(dòng)子驅(qū)動(dòng)的植物表達(dá)載體pRD29A-pBI101-GUS。雙酶切鑒定獲得陽(yáng)性克隆,測(cè)序,序列合適后提取質(zhì)粒,轉(zhuǎn)入農(nóng)桿菌GV3101。
1.2.2? ?轉(zhuǎn)基因純合株系獲得? ?利用浸花法[9 ],將1.2.1中獲得的陽(yáng)性克隆侵染擬南芥野生型(Col-0),獲得T0代種子。將干燥的T0代種子在含卡那霉素的MS培養(yǎng)基上大量播種,挑取有抗性的幼苗移入土中繼續(xù)培養(yǎng),單株收取得到T1代種子。將T1代種子按照3∶1的原則繼續(xù)經(jīng)卡那霉素篩選,存活的株系單株收種子得到T2代種子。T2代種子繼續(xù)經(jīng)抗生素篩選,全部存活沒(méi)有分離的則定為純合株系,用于后續(xù)實(shí)驗(yàn)。
1.2.3? ? 定量PCR分析? ? ?將純合株系種子在4 ℃下春化3 d后,用15%次氯酸鈉消毒,點(diǎn)種在MS培養(yǎng)基上。7 d后將幼苗移至營(yíng)養(yǎng)土中,在23 ℃培養(yǎng)室中培養(yǎng)(16 h光照/8 h黑暗)12 d后進(jìn)行干旱處理。
試驗(yàn)設(shè)計(jì)分為2組,一組為對(duì)照組,正常澆水;一組為處理組,不澆水。處理7 d后分別取材。參照植物總RNA提取試劑盒說(shuō)明書(shū)提取總RNA,檢測(cè)其完整性并測(cè)定RNA濃度和純度。取2 μg RNA,按照反轉(zhuǎn)錄酶的說(shuō)明書(shū)進(jìn)行cDNA合成。反轉(zhuǎn)錄后用于定量分析。
1.2.4? ? 組織表達(dá)分析? ? 純合株系種子在4 ℃下春化3 d后,用15%次氯酸鈉消毒,點(diǎn)種在MS培養(yǎng)基上。7 d后,幼苗移至處理培養(yǎng)基上。試驗(yàn)設(shè)計(jì)分為4組,對(duì)照組不作任何處理,繼續(xù)在MS培養(yǎng)基上正常生長(zhǎng);其他3組分別為200 mM NaCl處理、150 μM ABA處理,以及300 mM甘露醇處理。處理2 h后,對(duì)4組試驗(yàn)取材進(jìn)行GUS染色。GUS染色按照文獻(xiàn)的方法進(jìn)行[10 ]。
1.2.5? ? GUS活性分析? ? 首先提取植物總蛋白。取200 mg新鮮的植物組織,液氮速凍后迅速磨碎,將研磨后的組織轉(zhuǎn)到1.5 mL離心管里,加入1 mL GUS提取緩沖液[0.1 M 磷酸緩沖液(pH 7.0)50 mL;10% SDS 1 mL;0.5M EDTA(pH 8.0) 2 mL;Triton X-100 100 μL;β-巰基乙醇100 μL;加水定容至100 mL],充分混勻。4 ℃ 11 600 rpm 離心5 min,將上清轉(zhuǎn)至另一新的離心管中,冰上放置。
接著以牛血清白蛋白BSA作標(biāo)曲,參照Bradford的方法對(duì)蛋白濃度進(jìn)行測(cè)定[11 ]。
最后對(duì)GUS表達(dá)水平進(jìn)行定量分析:取100 μL蛋白上清,加入37 ℃預(yù)熱的GUS提取緩沖液400 μL后再加入500 μL MUG底物(2 mM),37 ℃溫浴。在0 min、15 min、30 min、45 min和60 min時(shí)分別取混合反應(yīng)物200 μL加入到800 μL反應(yīng)終止液(0.2 M Na2CO3)中,室溫下避光保存。利用熒光分光光度計(jì)在激發(fā)波長(zhǎng)365 nm、發(fā)射波長(zhǎng)455 nm下,狹縫10 nm時(shí)測(cè)定不同時(shí)間點(diǎn)的熒光強(qiáng)度值。以熒光強(qiáng)度值對(duì)反應(yīng)時(shí)間作曲線,求出單位時(shí)間熒光強(qiáng)度變化。用單位時(shí)間熒光強(qiáng)度變化除以參加反應(yīng)的蛋白量,求得單位質(zhì)量的蛋白在單位時(shí)間的熒光強(qiáng)度變化。
2? ?結(jié)果與分析
2.1? ?rd29A啟動(dòng)子的擴(kuò)增及酶切鑒定
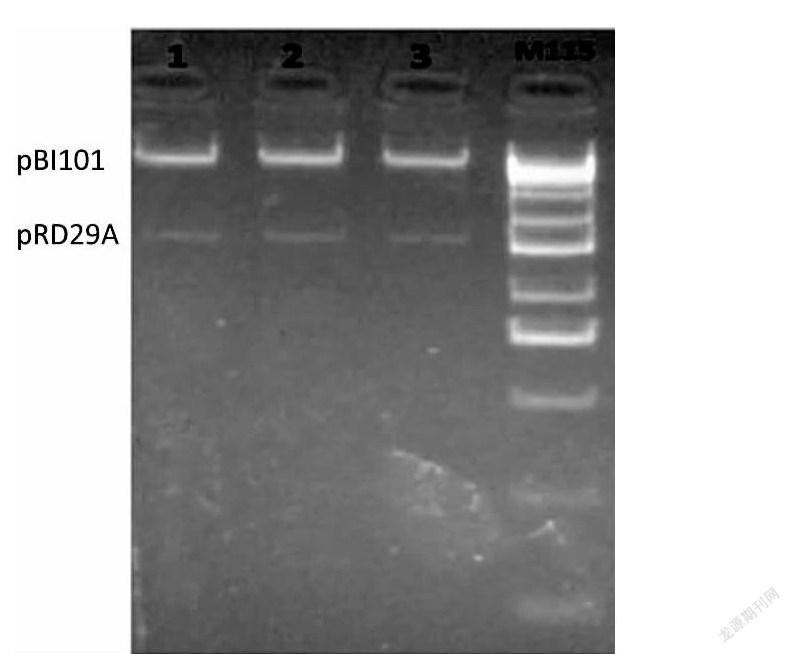
以擬南芥DNA為模板,加入特異性引物(表1)進(jìn)行擴(kuò)增。電泳結(jié)果(圖1)表明,克隆得到約1 600 bp的預(yù)期片段(命名為pRD29A)。利用HindIII酶和XbaI酶對(duì)目的片段和植物表達(dá)載體pBI101-GUS進(jìn)行雙酶切,將pRD29A插入到載體,得到由擬南芥rd29A啟動(dòng)子驅(qū)動(dòng)GUS報(bào)告基因的植物表達(dá)載體pBI101-rd29A-GUS。HindIII酶和XbaI酶雙酶切鑒定重組克隆(圖2),表明rd29A啟動(dòng)子完整的插入到表達(dá)載體中,同時(shí)通過(guò)測(cè)序確定為所需陽(yáng)性克隆。
2.2? ?轉(zhuǎn)基因植株篩選
利用農(nóng)桿菌介導(dǎo)的方法,將上述成功的陽(yáng)性克隆轉(zhuǎn)基因進(jìn)入擬南芥中。對(duì)轉(zhuǎn)基因獲得的種子進(jìn)行抗生素(卡那霉素)篩選。轉(zhuǎn)基因植株具有抗性,幼苗較綠,根能夠伸長(zhǎng)生長(zhǎng),未轉(zhuǎn)入成功的植株因缺乏抗性而黃化死去(圖3)。多次篩選后獲得純合株系。
2.3? ?干旱脅迫下rd29A及GUS基因表達(dá)量變化
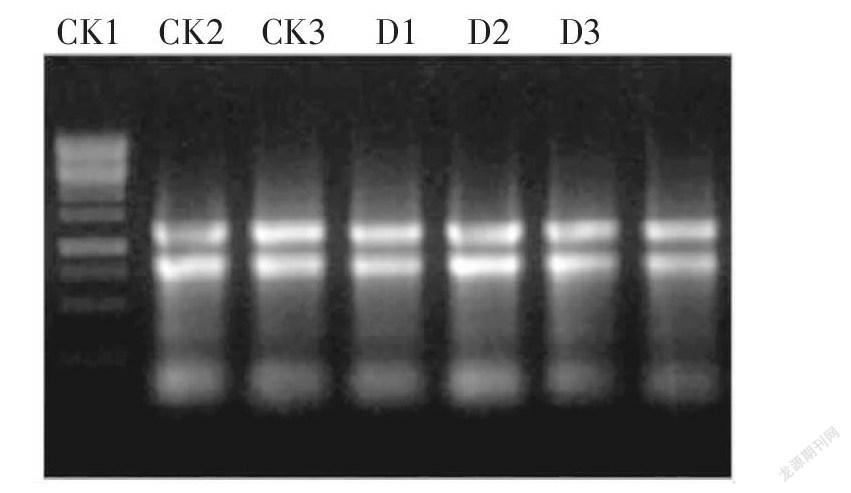
rd29A是干旱脅迫響應(yīng)的關(guān)鍵基因,因此檢測(cè)了干旱脅迫和未處理?xiàng)l件(CK)下轉(zhuǎn)基因純合株系中rd29A以及GUS報(bào)告基因表達(dá)量變化。對(duì)照組和處理組各取3個(gè)生物學(xué)重復(fù),提取總RNA后進(jìn)行凝膠電泳檢測(cè)。結(jié)果顯示6個(gè)樣本的RNA完整性均較好(圖4)。測(cè)定濃度和純度后,反轉(zhuǎn)錄為cDNA用于實(shí)時(shí)熒光定量分析。
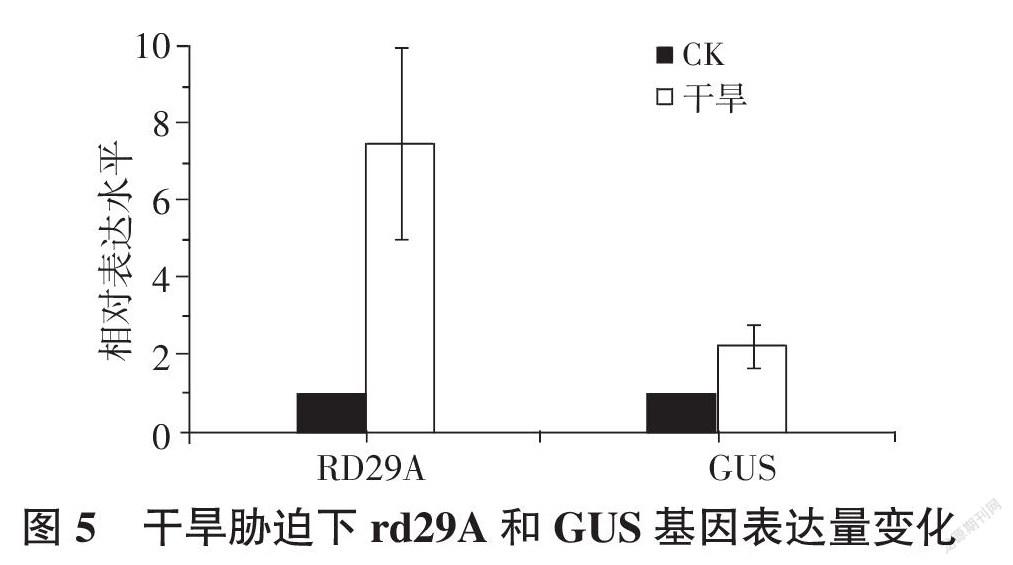
定量分析結(jié)果(圖5)顯示,與對(duì)照組相比,干旱處理后rd29A基因顯著上調(diào)表達(dá),而GUS基因表達(dá)略有上調(diào)。
2.4? ?GUS染色及活性分析
分析了不同脅迫處理下轉(zhuǎn)基因株系中GUS活性是否發(fā)生變化。將培養(yǎng)7 d的幼苗經(jīng)不同處理2 h后進(jìn)行GUS染色,脫色后在體視顯微鏡觀察。結(jié)果(圖6)顯示,與對(duì)照組相比,3種處理下下胚軸、葉片及整株幼苗中GUS活性均升高。其中ABA處理下GUS活性顯著高于對(duì)照組與其他2個(gè)處理組,尤其在子葉中。甘露醇和NaCl處理與對(duì)照相比GUS活性略有升高。
為進(jìn)一步分析不同處理下GUS活性變化,將培養(yǎng)7 d的幼苗經(jīng)不同處理2 h后的GUS活性進(jìn)行定量分析。結(jié)果(圖7)顯示,與對(duì)照組相比,3種處理下GUS活性在整株幼苗中均升高。其中ABA處理下GUS活性高于對(duì)照組與其他兩個(gè)處理組。甘露醇和NaCl處理下與對(duì)照相比GUS活性略有升高,這與GUS染色結(jié)果一致。
3? ?小結(jié)與討論
啟動(dòng)子是提供RNA聚合酶識(shí)別和結(jié)合的一段DNA序列和相關(guān)的調(diào)控元件,通常位于基因的上游,驅(qū)動(dòng)基因轉(zhuǎn)錄。根據(jù)啟動(dòng)子的作用方式,可分為組成型啟動(dòng)子、組織特異型啟動(dòng)子和誘導(dǎo)型啟動(dòng)子。在作物的遺傳轉(zhuǎn)化中,絕大多數(shù)用組成型啟動(dòng)子CaMV35S驅(qū)動(dòng)目的基因表達(dá),這可能造成轉(zhuǎn)基因作物的生長(zhǎng)發(fā)育受到限制,因此誘導(dǎo)型和特異型啟動(dòng)子的研究受到越來(lái)越廣泛的關(guān)注。
誘導(dǎo)型啟動(dòng)子通常是指在某些特定的信號(hào)刺激下可以大幅度提高基因轉(zhuǎn)錄水平的啟動(dòng)子。誘導(dǎo)型啟動(dòng)子對(duì)基因表達(dá)的調(diào)控,可以改善植物在發(fā)育過(guò)程中對(duì)環(huán)境變化的適應(yīng),同時(shí)可避免基因過(guò)量表達(dá)對(duì)植物造成的潛在危害。誘導(dǎo)型啟動(dòng)子包括多種類(lèi)型:可被激素如脫落酸、生長(zhǎng)素等誘導(dǎo)表達(dá)的啟動(dòng)子ABRE和E1[12 - 13 ];可在低溫、脫水以及高鹽等逆境因子的作用下被誘導(dǎo)表達(dá)的啟動(dòng)子Fro1、ABA2和Rab16A [14 - 16 ];能夠?qū)θ斯ず铣傻幕瘜W(xué)誘導(dǎo)物作出反應(yīng)的啟動(dòng)子IN2-2[17 ]。此外還存在一些能夠被光誘導(dǎo)Sgt1[18 - 19 ]和機(jī)械創(chuàng)傷誘導(dǎo)Win3 [20 ]表達(dá)的啟動(dòng)子類(lèi)型。
rd29A啟動(dòng)子作為誘導(dǎo)型啟動(dòng)子中研究最廣泛的啟動(dòng)子,已被許多學(xué)者應(yīng)用于提高轉(zhuǎn)基因作物抗性的育種研究中[21 - 22 ]。rd29A作為DREB1調(diào)控的目的基因,其啟動(dòng)子區(qū)域含有DRE核心序列和ABA響應(yīng)的順式作用元件(ABRE)[23 ]。在植物細(xì)胞缺水時(shí),體內(nèi)產(chǎn)生的ABA通過(guò)信號(hào)傳導(dǎo),可以產(chǎn)生與rd29A啟動(dòng)子區(qū)ABRE序列相結(jié)合的轉(zhuǎn)錄因子,啟動(dòng)rd29A的表達(dá)。同時(shí)DREB1轉(zhuǎn)錄因子與rd29A啟動(dòng)子DRE核心序列結(jié)合也可以誘導(dǎo)該基因的表達(dá)。細(xì)胞不缺水時(shí)rd29A并不表達(dá)[24 - 25 ],因此認(rèn)為rd29A是一個(gè)干旱誘導(dǎo)型啟動(dòng)子。
本研究經(jīng)過(guò)定量分析,已經(jīng)證明干旱脅迫下轉(zhuǎn)基因株系中rd29A顯著上調(diào)表達(dá)。同時(shí)通過(guò)GUS染色和GUS活性定量分析發(fā)現(xiàn),在ABA、甘露醇和NaCl等非生物脅迫下,轉(zhuǎn)基因株系的葉脈和下胚軸處的GUS染色加深,說(shuō)明rd29A啟動(dòng)子在脅迫誘導(dǎo)下活性增強(qiáng),可以有效地驅(qū)動(dòng)GUS基因的表達(dá)。前人的研究同樣表明將擬南芥rd29A啟動(dòng)子轉(zhuǎn)入煙草中,經(jīng)GUS染色分析發(fā)現(xiàn)脅迫處理下轉(zhuǎn)基因煙草葉脈處藍(lán)色較深[26 ]。
Kasuga等[27 ]分別構(gòu)建了CaMV35S啟動(dòng)子和rd29A啟動(dòng)子驅(qū)動(dòng)DREB1A基因的表達(dá)載體,轉(zhuǎn)基因到擬南芥中區(qū)別其抗逆能力。結(jié)果顯示,CaMV35S驅(qū)動(dòng)的DREB1A基因過(guò)表達(dá)后激活轉(zhuǎn)基因株系中其他脅迫基因的表達(dá),如rd29A、Kin1、Cor6.6、Cor15a、rd17和P5CS等,雖然具有更強(qiáng)的抗旱、抗鹽等能力,但其在正常條件下生長(zhǎng)遲緩。而由rd29A驅(qū)動(dòng)的DREB1A基因表達(dá)后,轉(zhuǎn)基因株系既可獲得更強(qiáng)的脅迫耐性,同時(shí)植株生長(zhǎng)受到的影響較小。因此rd29A誘導(dǎo)型啟動(dòng)子在植物抗逆基因工程中具有廣泛的應(yīng)用前景和極大的研究?jī)r(jià)值。我們?cè)谇叭说幕A(chǔ)上構(gòu)建了Rd29A啟動(dòng)驅(qū)動(dòng)的GUS基因表達(dá),不僅在組織染色水平上驗(yàn)證了其在干旱脅迫條件下的響應(yīng),同時(shí)多角度做了關(guān)聯(lián)驗(yàn)證,如自身RD29A基因的誘導(dǎo)表達(dá)分析,GUS活性定量分析,更加精確地明確了Rd29A啟動(dòng)子的功能。希望通過(guò)進(jìn)一步構(gòu)建rd29A干旱誘導(dǎo)型啟動(dòng)子驅(qū)動(dòng)DREB轉(zhuǎn)錄因子的植物表達(dá)載體,利用農(nóng)桿菌介導(dǎo)法將其成功轉(zhuǎn)入小麥中,以提高甘肅旱地小麥產(chǎn)量。
參考文獻(xiàn):
[1] ZHU J K.? Cell signaling under salt,water and cold stresses[J].? Current Opinion in Plant Biology,2001,4:401-406.
[2] 尹祥佳,李艷枚,郝? ?楠.? CRISPR/Cas9基因編輯系統(tǒng)及其在水稻育種中的應(yīng)用綜述[J].? 甘肅農(nóng)業(yè)科技,2017(10):80-84.
[3] 張俊儒,張? ?磊,劉忠元,等.? 布勞格小麥育種模式反思與節(jié)水專(zhuān)用型品種選育探討[J].? 甘肅農(nóng)業(yè)科技,2017(10):63-67.
[4] HSIEH T H, LEE J T,CHANG Y Y,et al.? Tomato plants ectopically expressing Arabidopsis CBF1 show enhanced resistance to water deficit stress[J].? Plant Physiol,2002,130:618-626.
[5]MIE K,SETUKO M,KAZUO S.? et al.? A combination of the Arabidopsis DREB1A gene and stress-inducible rd29A promoter drought and low-temperature stress tolerance in tobacco by gene transfer[J].? Plant Physiol,2004,45(3):346-350.
[6] GILMOUR S J,SEBOLT A M,SALASAR M P,et a1.? Overexpression of the Arabidopsis CBF3 transcriptional activator mimics multiple bioehemical changes associated with cold acclimation[J].? Plant Physiol,1600,124:1854.
[7] YAMAGUCHI S K,SHINOZAKI K. A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought,low-temperature or high-salt stress[J].? Plant Cell,1994,6:251-264.
[8] JUNGHANS,H,METZLAFF M.? A simple and rapid method for the preparation of total plant DNA[J].? Biotechniques,1990,8:176.
[9] CLOUGH S J,BENT A F.? Floral dip:a simplified method for Agrobacterium mediated transformation of Arabidopsis thaliana[J].? The Plant Journal,1998,16:735-743.
[10] JEFFERSON R A,KAVANAGH T A,BEVAN M W. GUS fusions:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].? The EMBO Journal,1987,6:3901-3907.
[11] BRADFORD M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein using the principle of protein dye binding[J].? Analytical Biochemistry,1976,6:3177-3188.
[12] YAMAGUCHI S K,SHINOZAKI K. Organization of cis-acting regulatory elements in osmotic and cold-stressreponsive promofers[J].? Trends in Plant Science,2005,10(2):88-94.
[13] LIU Z B,HAGEN G,GUILFOYLE T J. AG-Box-Binding protein from soybean binds to the E1 auxin-response element in the soybean GH3 promoter and contains a proline-rich repression domain[J].? Plant? Physiol,1997,
115(2):397-407
[14] BYEONG H L,HOJOUNG L,LI M, et al.? A mitochondrial complex I defect impairs cold-regulated nuclear gene expression[J].? The Plant Cell,2002(14):1235-1251.
[15] RAI M,HE C K,WU R.? Comparative functional analysis of three abiotic stress-inducible promoters in transgenic rice[J].? Transgenic Res,2009,18(5):787-799.
[16] ARYADEEP R,CHAITALI R,DIBYENDU N S. Transgenic tobacco plants overexpressing the heterologouslea gene Rab16A from rice during high salt and water deficitdisplay enhanced tolerance to salinity stress[J].? Plant Cell Rep,2007,26(10):1839-1859.
[17] 孫芳芳.? 乙酰苯胺和2-氯苯磺酰胺誘導(dǎo)啟動(dòng)子IN2-2在植物中的表達(dá)研究[D].? 重慶:西南大學(xué),2014.
[18] 李為民,王志興,裴新梧,等.? 中棉光誘導(dǎo)基因 Cacab 啟動(dòng)子的克隆及其功能分析[J].? 農(nóng)業(yè)生物技術(shù)學(xué)報(bào),2004,12(3):253-257.
[19] 魏桂民,張金文,王? ?蒂,等.? 馬鈴薯Sgt1基因啟動(dòng)子的結(jié)構(gòu)及功能分析[J].? 中國(guó)生物化學(xué)與分子生物學(xué)報(bào),2013,29(10):969-977.
[20] BRADSHAW H D,HOLLICK J B,PARSONS T J,et al. Systemically wound-responsive genes in poplar trees encode proteins similar to sweet potato spormins and legumekunitz trypsin inhibitors[J].? Plant Molecular Biology,1989,14(1):51-59.
[21] 張? ?寧,司懷軍,王? ?蒂.? 擬南芥rd29A基因啟動(dòng)子克隆及其在馬鈴薯抗脅迫轉(zhuǎn)基因中的應(yīng)用[J].? 作物學(xué)報(bào),2005,31(2):159-164.
[22] 押輝遠(yuǎn),秦廣雍,霍裕平.? Prd29A及DREB1A的克隆和干旱誘導(dǎo)型植物表達(dá)載體的構(gòu)建與鑒定[J].? 植物生理學(xué)通訊,2005,
41(3):371-375.
[23] YAMAGUCH I, SHIONZAKI K. TOKIIAWA M. Characterization of the expression of a desiccation-responsive rd29 gene of Arabidopsis thaliana and analysis of its promoter in transgenic plants[J].? Molecular & General Genetics Mgg,1993,236(2-3),331-340.
[24] 江香梅,黃敏仁,王明麻.? 植物抗鹽堿、耐旱基因工程研究進(jìn)展[J].? 南京林業(yè)大學(xué)學(xué)報(bào)(自然科學(xué)版),2001,25(25):57-62.
[25]LIMING XIONG,K AREN S SCHUMAKER,JIAN-KANG ZHU.? Cell signaling during cold,drought and salt stress[J].? The Plant Cell. 2002,14:166-183.
[26] 楊春霞,陳? ?英,黃敏仁,等.? 擬南芥逆境誘導(dǎo)型啟動(dòng)子rd29a的克隆及活性檢測(cè)[J].? 南京林業(yè)大學(xué)學(xué)報(bào)(自然科學(xué)版),2008,32(1):6-10.
[27] KASUGA M,LIU Q,MIURA S,et al.? Improving plant drought,salt and freezing tolerance by gene transfer of a single stress-inducible transcription factor[J].? Nature Biotechnology,1999(17):287-291.
(本文責(zé)編:陳? ? ?珩)
收稿日期:2019 - 03 - 06
基金項(xiàng)目:國(guó)家自然科學(xué)基金項(xiàng)目(31560390);甘肅省科技重大專(zhuān)項(xiàng)(17ZD2NA016-7);甘肅省小麥產(chǎn)業(yè)技術(shù)體系(GARS-01-01);公益性行業(yè)農(nóng)業(yè)科研專(zhuān)項(xiàng)(201503125-1)資助。
作者簡(jiǎn)介:柳? ?娜(1981 — ),女,甘肅靖遠(yuǎn)人,副研究員,主要從事小麥分子和常規(guī)育種工作。Email:592905658@qq.com。
通信作者:楊文雄(1964 — ),男,甘肅會(huì)寧人,研究員,主要從事小麥育種研究工作。Email:ywxm822@126.com。

