鉻天青S法結(jié)合高效液相色譜法測定甲烷氧化菌素含量
陳林林,韓 可,李 偉,吳嘉樹,辛嘉英,2
(1.哈爾濱商業(yè)大學(xué)省高校食品科學(xué)與工程重點實驗室,黑龍江哈爾濱 150076; 2.中國科學(xué)院蘭州化學(xué)物理研究所羰基合成與選擇氧化國家重點實驗室,甘肅蘭州 730000)
甲烷氧化菌是一類可以直接以甲烷作為碳源和能源進行生長的革蘭氏陰性細(xì)菌[1],對溫室效應(yīng)起到了有效的抑制作用[2]。甲烷氧化菌素(methanobactin,Mb)是一種小分子的熒光肽,在細(xì)胞外能以分泌物的形式存在,在細(xì)胞內(nèi)參與顆粒性甲烷單加氧酶(MMO)的組成,并且存在于細(xì)胞內(nèi)膜上[3]。Mb與銅結(jié)合后所形成的物質(zhì)會影響MMO的活性[4],MMO作為甲烷氧化菌的典型特征代謝產(chǎn)物,能將甲烷催化氧化為甲醇[5]。Mb與銅的結(jié)合物Mb-Cu具有超氧化物歧化酶(superoxide dismutase,SOD)的活性[6-7],Mb不僅能清除超氧陰離子,而且能夠清除羥自由基,可以應(yīng)用于延緩衰老的功能性食品或化妝品當(dāng)中,作為抗氧化劑也具有一定的應(yīng)用前景。
由于Mb發(fā)酵時間較長,且甲烷氧化菌在發(fā)酵過程中由于發(fā)酵條件的限制產(chǎn)生的Mb含量較低。因此為了獲得純度高、成熟的Mb,需要在發(fā)酵過程中實現(xiàn)對Mb含量的監(jiān)控以及對發(fā)酵成熟的Mb進行檢測。Mb含量的檢測方法有分光光度法、紫外光譜法、熒光法以及高效液相色譜法等[8]。利用紫外檢測定量Mb會有很大的誤差,因為甲烷氧化菌在發(fā)酵的過程中會向菌液釋放很多有紫外吸收的小肽,對檢測結(jié)果有影響。國外曾有利用鉻天青(CAS)法瓊脂平板檢測甲烷氧化菌產(chǎn)Mb的例子[9-10],利用CAS法,通過顏色變化更直接地進行檢測。
利用高效液相色譜法(HPLC)對M.trichosporiumOB3b代謝的Mb每24 h含量進行測定,確定M.trichosporiumOB3b分泌Mb的日變化趨勢,但是卻無法驗證Mb的成熟程度。鉻天青法可以通過咪唑基團與Cu的結(jié)合產(chǎn)生顏色的變化,從而檢測Mb發(fā)酵的程度以及含量。本文通過紫外光譜對Mb在CAS體系中發(fā)生的光譜變化,作為分析利用CAS法檢測Mb的測定依據(jù),并通過優(yōu)化后的CAS法檢測M.trichosporiumOB3b發(fā)酵液當(dāng)中的Mb含量。既實現(xiàn)了對Mb的實時監(jiān)測,又可以更準(zhǔn)確直接地檢測Mb,為Mb通過發(fā)酵法富集和應(yīng)用的研究提供數(shù)據(jù)支持。
1 材料與方法
1.1 材料與儀器
甲基彎菌(M.trichosporiumOB3b) 俄羅斯科學(xué)院催化研究所;鉻天青S、十六烷基三甲基溴化銨(HDTMA) 天津市光復(fù)精細(xì)化工研究所;乙二胺四乙酸、磷酸二氫鉀、磷酸氫二鉀、磷酸氫二鈉、無水乙醇、甲醇 天津市天力化學(xué)試劑有限公司;HP-20大孔吸附樹脂 日本三菱化學(xué)公司。
BSA224S電子天平 賽多利斯科學(xué)儀器(北京)有限公司;DHG-9203A型電熱恒溫鼓風(fēng)干燥箱、R-20旋轉(zhuǎn)蒸發(fā)儀 上海一恒科學(xué)儀器有限公司;HDL潔凈工作臺 北京東聯(lián)哈爾儀器制造有限公司;YY-15-2PF2 單相電容運轉(zhuǎn)電動機 上海申勝生物技術(shù)有限公司;U3000高效液相色譜儀 Themo儀器有限公司;SHB-Ⅲ循環(huán)水式多用真空泵 鄭州長城科工貿(mào)有限公司;LDZX-50KBS立式壓力蒸汽滅菌器 上海申安醫(yī)療器械廠;HNY-100B恒溫培養(yǎng)振蕩器 天津市歐諾儀器儀表有限公司;TGL-16高速臺式離心機 上海醫(yī)療器械六廠;2-16K冷凍離心機、Z-16K冷凍離心機 Sigma公司;UV-2550紫外-可見分光光度計 日本島津;F-7000FL220-240V熒光光譜儀 Watter公司;UV-2550組合式紫外檢測器 上海金達生化儀器有限公司;HL-2S恒流泵 上海滬西分析儀器廠有限公司;Ulti Mate3000高效液相色譜儀 賽默飛世爾儀器有限公司。
1.2 實驗方法
1.2.1 Mb的培養(yǎng)以及分離純化 根據(jù)文獻[11]按照OB3b菌種培養(yǎng)基配制方法,配制1 L培養(yǎng)基置于發(fā)酵罐中,以甲烷為碳源,培養(yǎng)周期為24 h。培養(yǎng)周期結(jié)束后對Mb進行分離純化。通過冷凍干燥后,得到Mb的凍干粉。
1.2.2 光譜分析Mb及CAS法測定的依據(jù)
1.2.2.1 紫外光譜分析Mb發(fā)酵程度 取1.2.1純化后的Mb利用紫外-可見分光光度計在200~700 nm之間進行掃描,通過Mb在紫外中的特征峰判定Mb的成熟程度,以確定發(fā)酵成熟后Mb可利用CAS法測定的依據(jù)。在此基礎(chǔ)上可以測定分離純化后Mb凍干粉的純度,進一步作為HPLC定量的依據(jù),從而實現(xiàn)發(fā)酵前4 d Mb含量的測定。
1.2.2.2 排除其他小肽對檢測方法的影響 將純化到的Mb干粉,取2.5 mg利用蒸餾水定容至5 mL制成樣液。取2個25 mL的容量瓶,分別向其中加入2.0 mL 0.02 mmoL/L CAS 溶液、4.0 mL 0.02 mmoL/L HDTMA溶液及2.0 mL磷酸緩沖溶液(0.4 g/L K2HPO4、0.262 g/L KH2PO4、0.74 g/L Na2HPO4),向其中一個容量瓶中加入1 mL的Mb樣液。搖勻定容,15 min后用1 cm比色皿,在200~700 nm波長范圍內(nèi)進行紫外掃描,得二者的紫外吸收光譜圖進行分析對比。
1.2.2.3 Mb與Mb-Cu紫外光譜檢測 在比色皿中加入2 mL濃度為5×10-4moL/L的Mb溶液,使用5 μL微量進樣器向其中逐漸注入0.1 moL/L的CuSO4溶液,利用紫外-可見分光光度計觀察Cu加入后Mb的紫外光譜變化。
1.2.2.4 Mb奪取CAS體系中Cu2+的證明 將純化到的Mb干粉,取2.5 mg定容至5 mL制成樣液。取4個25 mL的容量瓶,分別用移液管移取2.0、2.0、1.2、4.0、1.0、1.0 mL的磷酸緩沖溶液、0.02 mmoL/L 的CAS、CuSO4、HDTMA溶液、0.01 moL/L EDTA溶液及Mb樣液,按CAS+HDTMA、CAS+HDTMA+CuSO4、CAS+HDTMA+CuSO4+EDTA、CAS+HDTMA+CuSO4+Mb的組合方式在四個瓶中加入溶液,搖勻定容,15 min后分別在200~700 nm波長范圍內(nèi)進行紫外掃描,得四者的紫外吸收光譜圖進行分析對比。
1.2.3 CAS法檢測條件的確定 取數(shù)個25 mL容量瓶,加入2 mL的0.02 mmoL/L CAS溶液,不同體積的0.02 mmoL/L CuSO4溶液、0.02 mmoL/L HDTMA溶液以及磷酸緩沖溶液,搖勻定容,靜置幾分鐘后,以蒸餾水作空白,在607 nm下測定吸光值。每組平行測3次,取平均值繪制曲線。分別考察反應(yīng)條件為CAS溶液2.0 mL、HDTMA溶液4.0 mL、磷酸緩沖溶液0.5 mL、反應(yīng)時間15 min時,CuSO4溶液添加量(0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL)對CAS絡(luò)合體系的影響;反應(yīng)條件為CAS溶液2.0 mL、CuSO4溶液1.2 mL、磷酸緩沖溶液0.5 mL、反應(yīng)時間15 min時,HDTMA溶液添加量(1.0、2.0、3.0、4.0、5.0、6.0 mL)對CAS絡(luò)合體系的影響;反應(yīng)條件為CAS溶液2.0 mL、CuSO4溶液1.2 mL、HDTMA 4.0 mL、反應(yīng)時間15 min時,磷酸緩沖液添加量(0.5、1.0、1.5、2.0、2.5、3.0 mL)對CAS絡(luò)合體系的影響;以及反應(yīng)條件為CAS溶液2.0 mL、CuSO4溶液1.2 mL、HDTMA溶液4.0 mL、磷酸緩沖溶液2.0 mL時,絡(luò)合時間(5、10、15、20、25、30 min)對CAS絡(luò)合體系的影響。
1.2.4 CAS法檢測Mb含量
1.2.4.1 Mb含量的測定 取7支試管并進行編號,按CAS:HDTMA:CuSO4體積比為1.0∶8.0∶0.7的比例配制100 mL C液,分別向試管中加入9 mL C液及1 mL 1.2.1中的凍干粉溶液和蒸餾水混合液,其凍干粉溶液的添加量依次為0.0、0.2、0.3、0.5、0.7、0.9、1.0 mL,以1號為空白在607 nm波長下測定吸光值,每組平行測3次,取平均值繪制曲線。通過在含有2.0 mL 0.02 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.02 mmoL/L HDTMA溶液、2.0 mL磷酸緩沖溶液的反應(yīng)體系中,依次加入不同體積的0.01 moL/L EDTA溶液,于607 nm紫外吸收波長下測得的吸光值[12]。此操作平行3次,計算平均值。
1.2.4.2 Mb含量的計算 取8個25 mL容量瓶,分別用移液管移取2.0 mL 0.02 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.02 mmoL/L HDTMA溶液、2.0 mL磷酸緩沖溶液置于容量瓶中,然后依次加入0.0、0.3、0.6、0.9、1.2、1.5、1.8、2.0 mL的0.01 moL/L EDTA溶液,搖勻定容,靜置15 min后,以蒸餾水作空白,在607 nm下測定吸光值。平行測3次,取平均值繪制EDTA工作曲線,根據(jù)EDTA工作曲線y=-0.0447x+0.0738,r=0.9895,求出Mb對EDTA的當(dāng)量濃度(μmoL·mL-1),由公式[13-16]求出1 L發(fā)酵液中的Mb含量。Mb含量計算公式為:
Mb含量(μmoL/250 mL)=EDTA當(dāng)量濃度×25×2.5
1.2.5 HPLC法檢測Mb含量
1.2.5.1 HPLC法的檢測條件 色譜柱:C18XDB(4.6 mm×150 mm,5 μm);檢測器:二極管陣列檢測器;柱溫:30 ℃;流速:0.4 mL/min;流動相:A為去離子水,B為100%乙腈;采用梯度洗脫,0~2 min 100%~88% A、2~5 min 88%~75% A、5~11 min 75%~68% A、11~15 min 68%~50% A、15~25 min 50%~0% A運行25 min;進樣量10 μL。
1.2.5.2 HPLC法檢測Mb含量 取10 μL發(fā)酵液純化獲得Mb干粉樣液于高效液相色譜儀中檢測,結(jié)合三維液相色譜圖與紫外光譜圖確定Mb的出峰位置。取0.5 mg的OB3b Mb凍干粉加入蒸餾水配成1 mL干粉溶液,在高效液相色譜儀中進樣1 μL濃度分別為2.5×10-3、5×10-3、7.5×10-3、1×10-2、1.25×10-2、1.5×10-2g/mL的凍干粉溶液進行檢測,得到不同含量Mb的液相色譜圖,獲得相應(yīng)保留時間內(nèi)各Mb含量對應(yīng)的峰面積,繪制出峰面積與Mb含量的標(biāo)準(zhǔn)曲線。每24 h對發(fā)酵液進行提取,于高效液相色譜儀下進行檢測,得到不同時間段下的Mb液相分析圖后,利用線性關(guān)系,得到相應(yīng)的Mb含量,考察M.trichosporiumOB3b代謝Mb的日含量變化情況。
2 結(jié)果與分析
2.1 光譜分析Mb及CAS法測定的依據(jù)
2.1.1 紫外光譜分析Mb發(fā)酵程度 對發(fā)酵過程中的Mb每24 h進行分離純化提取,以蒸餾水為空白,在200~700 nm波長下掃描的紫外吸收光譜如圖1所示。由圖1可知,發(fā)酵24 h的Mb只在290 nm處有一個特征峰;發(fā)酵48 h在290 nm處有一個特征峰;發(fā)酵72 h在290、340 nm處有兩個特征峰;發(fā)酵96 h在290、340、390 nm有三個特征峰;發(fā)酵120 h在290、340、390 nm有三個特征峰。根據(jù)文獻[11]可知與Cu2+結(jié)合的咪唑基團在340、390 nm處產(chǎn)生。由此可見Mb只有發(fā)酵72 h后才有與Cu結(jié)合的咪唑基團,發(fā)酵96 h后的Mb較為成熟。
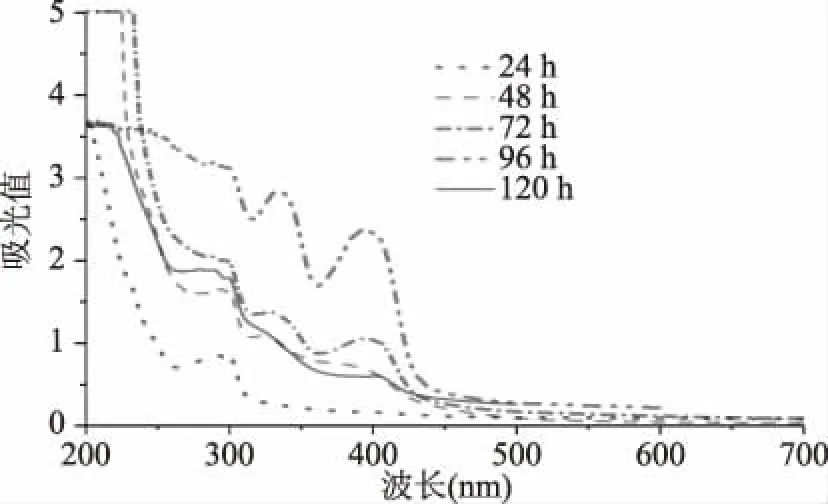
圖1 Mb紫外光譜圖Fig.1 Mb ultraviolet spectrum
2.1.2 排除其他小肽對檢測方法的影響 由圖2可知,兩種混合體系在400 nm以后幾乎是重合的,在不加 CuSO4的情況下,加Mb體系與不加Mb體系在607 nm處均無特征吸收峰,說明MethylosinustrichosporiumOB3b向發(fā)酵液中分泌的多種小肽并不會影響Mb的紫外檢測結(jié)果,故排除發(fā)酵液中雜蛋白的干擾。
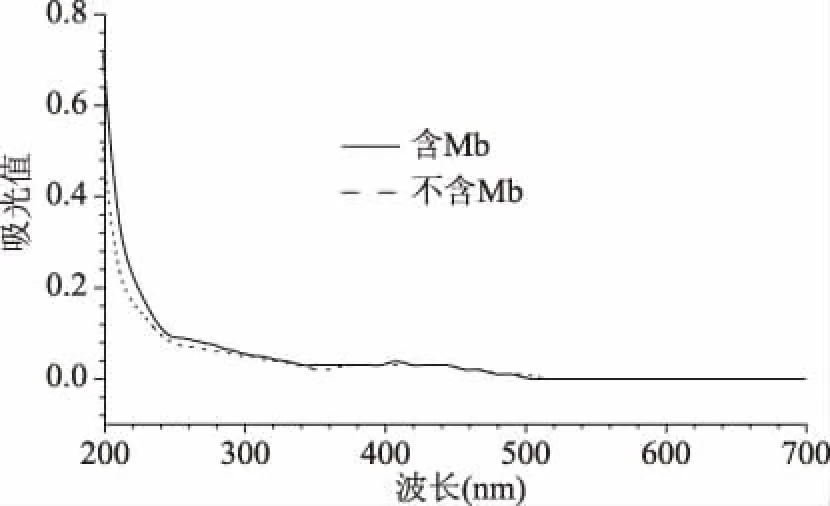
圖2 無銅CAS體系添加Mb的紫外光譜Fig.2 UV spectrum of Mb added to copper-free CAS system
2.1.3 Mb紫外光譜的檢測 由圖3可以看出,Mb紫外-可見光譜圖中有三處吸收峰,分別為290、340、394 nm,這與文獻報道的Mb的結(jié)構(gòu)[17]一致。當(dāng)加入Cu2+后,340 nm的4-羥基-5-亞硫酰咪唑基團以及394 nm的硫酰咪唑基團的特征峰均下降,表明純化后的Mb具有4-羥基-5-亞硫酰咪唑基團和硫酰咪唑基團,且Cu2+與Mb的咪唑酮環(huán)發(fā)生了配位結(jié)合。
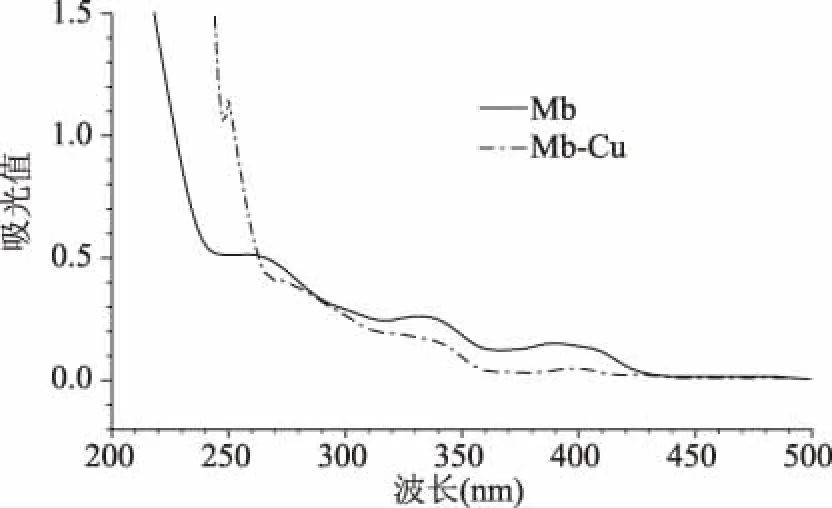
圖3 Mb及Mb-Cu紫外光譜Fig.3 UV spectrum of Mb and Mb-Cu
2.1.4 Mb奪取CAS體系中Cu2+的證明 CAS+HDTMA、CAS+HDTMA+CuSO4、CAS+HDTMA+CuSO4+EDTA、CAS+HDTMA+CuSO4+Mb四種組合方式的混合體系在200~700 nm波長下掃描得到的紫外吸收光譜結(jié)果如圖4所示。由圖4可知,CAS溶液與CuSO4溶液形成的絡(luò)合體系在加入Mb和EDTA后,607 nm附近的吸收峰均有所降低,表明Mb與EDTA相同,均能夠奪取絡(luò)合物CAS-Cu中的Cu2+,從而具有降低特征吸收峰的作用[18]。因此利用鉻天青法檢測Mb含量可行。
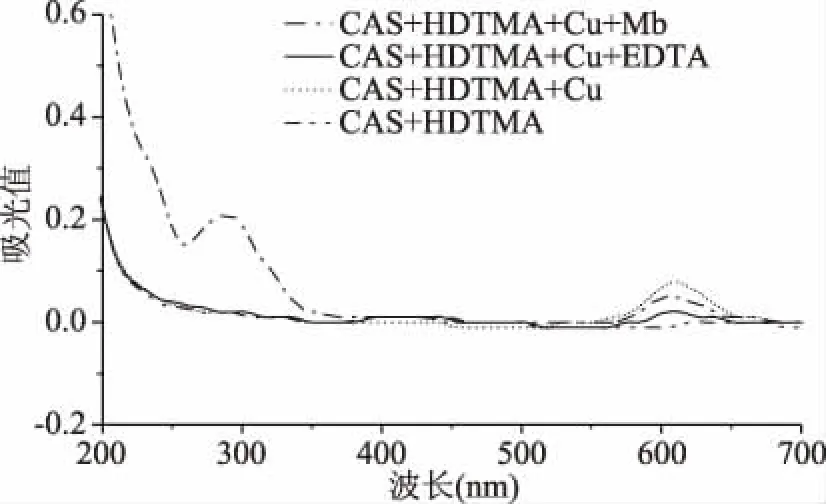
圖4 四種反應(yīng)體系的紫外光譜Fig.4 UV spectrum of four reaction systems
2.2 CAS法檢測條件的優(yōu)化
2.2.1 CuSO4溶液添加量對CAS體系的影響 由圖5可知,絡(luò)合體系的吸光值會隨著CuSO4溶液的添加量逐漸增加,一定量后達到最大值。在0~1.2 mL時絡(luò)合體系的吸光值逐漸上升。當(dāng)CuSO4的添加量為1.2 mL時,吸光度達到最大值,說明體系中有足夠的Cu2+發(fā)生反應(yīng)。繼續(xù)添加CuSO4溶液,吸光度呈下降趨勢,使得溶液中含有多余游離Cu2+而不利于工作曲線及Mb的測定。因此選取CuSO4溶液的添加量為1.2 mL。
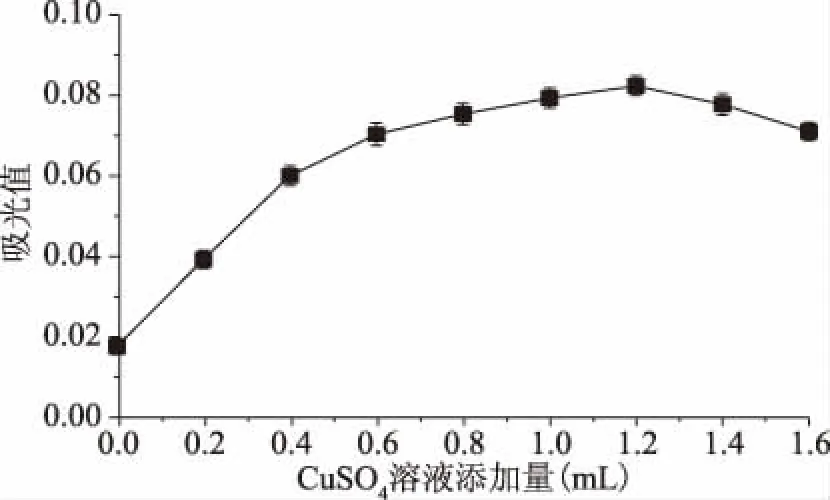
圖5 CuSO4溶液添加量對CAS體系的影響Fig.5 Effect of addition of CuSO4 solution on CAS system
2.2.2 HDTMA溶液添加量對CAS體系的影響 由圖6可知,隨著HDTMA由1 mL增加至4 mL時,絡(luò)合體系的吸光值上升明顯,而當(dāng)HDTMA添加量高于4.0 mL后,吸光值趨于穩(wěn)定,這表明HDTMA溶液添加量為4.0 mL時,對整個體系的增色效果達到最大。因此選取HDTMA溶液的添加量為4 mL。

圖6 HDTMA溶液添加量CAS體系的影響Fig.6 Effect of addition of HDTMA solution on CAS system
2.2.3 磷酸緩沖溶液添加量對CAS體系的影響 由圖7可知,添加不同體積的磷酸緩沖溶液,其絡(luò)合體系對應(yīng)的吸光度值接近,表明磷酸緩沖液對于反應(yīng)體系影響不明顯。在0~2 mL時,絡(luò)合體系的吸光值有小幅度的上升,當(dāng)添加量超過2.0 mL時,吸光值趨于平穩(wěn),這表明磷酸緩沖溶液添加量為2.0 mL時,絡(luò)合體系的穩(wěn)定性較好。因此選取磷酸緩沖溶液的添加量為2.0 mL。
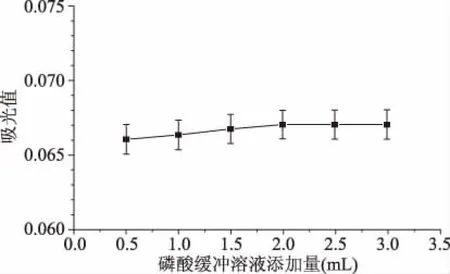
圖7 磷酸緩沖溶液添加量對CAS體系的影響Fig.7 Effect of addition of phosphate buffer solution on CAS system
2.2.4 絡(luò)合時間對CAS體系的影響 由圖8所示,CAS與CuSO4絡(luò)合時間在0~15 min波動明顯。當(dāng)絡(luò)合體系形成時間大于15 min時,體系吸光度稍有下降并處于穩(wěn)定,表明絡(luò)合時間為15 min時反應(yīng)完全,絡(luò)合體系達到穩(wěn)定。因此選取反應(yīng)時間為15 min。
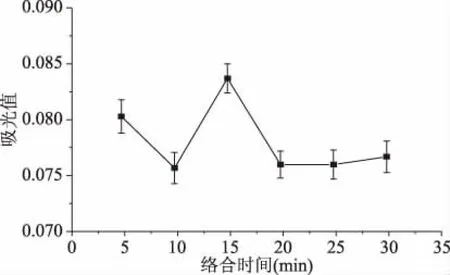
圖8 絡(luò)合時間對CAS體系的影響 Fig.8 Effect of complexation time on CAS system
2.3 CAS法對Mb含量的檢測結(jié)果
2.3.1 CAS法對Mb含量線性關(guān)系的測定 按0.1 mmol/L CAS:0.1 mmol/L HDTMA:0.1 mmol/L CuSO4體積比為1.0∶8.0∶0.7的比例配成CAS絡(luò)合體系,加入不同濃度的Mb凍干粉溶液后,在607 nm吸收波長下測得的吸光值如圖9所示。
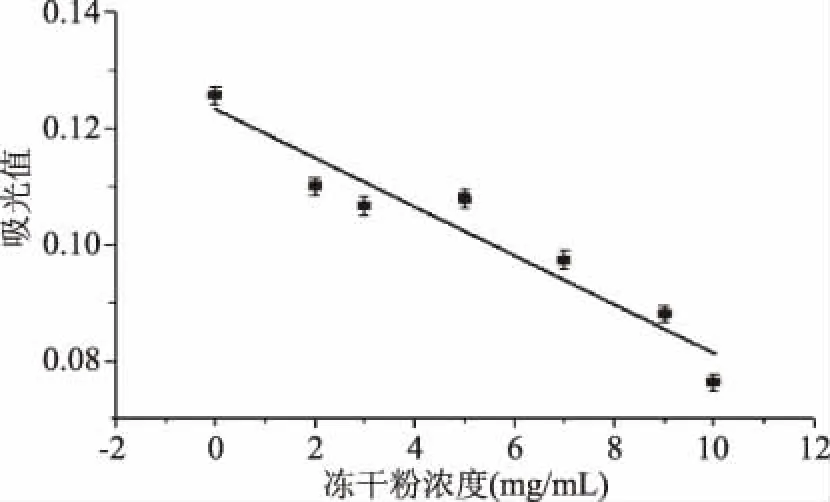
圖9 Mb含量與吸光值的線性關(guān)系 Fig.9 Linear relationship between Mb content and absorbance
從圖9可以看出,在含有Mb的CAS-Cu絡(luò)合體系中,Mb的濃度與反應(yīng)體系的吸光度同EDTA與吸光度的關(guān)系(y=-0.0447x+0.0738,r=0.9895)相似,均呈線性關(guān)系,且其線性方程為y=-0.0042x+0.1232,其中r值為0.9495,線性關(guān)系可靠。因此可通過EDTA的工作曲線求得Mb的EDTA當(dāng)量濃度,進而求得發(fā)酵液中的Mb含量。
2.3.2 CAS法對發(fā)酵液中Mb含量的測定 將2.0 mL發(fā)酵液純化的Mb樣液加入到由2.0 mL 0.02 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.02 mmoL/L HDTMA溶液、2.0 mL磷酸緩沖溶液配成的絡(luò)合體系中,靜置15 min后于607 nm波長下測得吸光值,此操作平行3次,求出的Mb含量如表1所示。表1表明 OB3b 1 L發(fā)酵液當(dāng)中Mb的含量為26.91 μmoL,并且其相對標(biāo)準(zhǔn)偏差(RSD)小于5%,重現(xiàn)性較好。

表1 Mb含量測定結(jié)果Table 1 Determination results of Mb content
2.3.3 Mb含量最低檢測限的測定 將1 mL的Mb樣液稀釋后,加入到由2.0 mL 0.1 mmoL/L CAS溶液、1.2 mL 0.02 mmoL/L CuSO4溶液、4.0 mL 0.1 mmoL/L HDTMA溶液、2.0 mL磷酸緩沖溶液配成的絡(luò)合體系中,靜置15 min后于607 nm波長下測得吸光值,此操作平行3次,求出Mb含量如表2所示。由表2可知,通過CAS法檢測OB3b 1 L發(fā)酵液當(dāng)中Mb最低含量為稀釋50倍后的濃度值,最低檢測限為0.042 μmoL/L,并且其相對標(biāo)準(zhǔn)偏差(RSD)小于5%,重現(xiàn)性較好。

表2 Mb含量最低檢測限Table 2 Minimum detection limit of Mb
2.4 HPLC法對Mb含量的檢測結(jié)果
2.4.1 HPLC法檢測Mb的定性分析 10 μL發(fā)酵液純化的Mb樣液的高效液相色譜圖及3D液相色譜圖如圖10、圖11所示。由圖10可以看出,在保留時間為10.843 min出現(xiàn)的吸收峰與在圖11在同一保留時間出峰位置相對應(yīng),說明為同一種物質(zhì),且由圖11中可以看出,保留時間為10.843 min出現(xiàn)的吸收峰分別出現(xiàn)在275、340、394 nm,再結(jié)合2.1.3中的紫外光譜圖當(dāng)中Mb的特征峰出峰位置,分析證實保留時間10.843 min處的吸收峰為Mb。
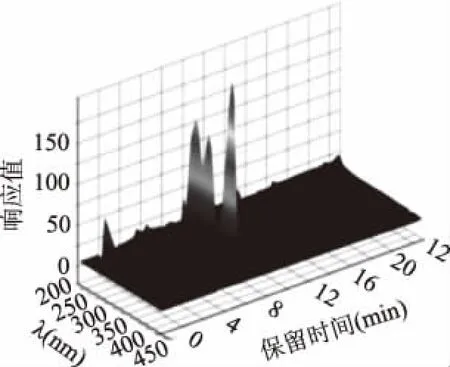
圖11 Mb三維液相色譜圖Fig.11 Mb three-dimensional liquid chromatogram
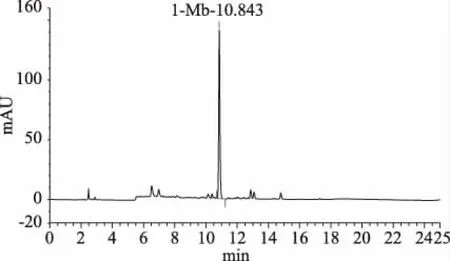
圖10 Mb高效液相色譜圖Fig.10 High performance liquid chromatogram of Mb
2.4.2 HPLC檢測Mb的定量分析 將經(jīng)CAS法檢測獲得Mb含量為83.33 μmoL的凍干粉制成1 mL干粉溶液,在高效液相色譜儀中進樣1 μL濃度分別為2.5×10-3、5×10-3、7.5×10-3、1×10-2、1.25×10-2、1.5×10-2g/mL進行檢測,檢測繪制出的峰面積與Mb含量的線性關(guān)系曲線,線性方程為y=10.5251x+4.4038,r值為0.9998,線性關(guān)系可靠。
將20 μL 24 h間隔下取出的250 mL發(fā)酵液的Mb樣液于高效液相色譜儀下進行檢測,得到不同時間段下Mb保留時間內(nèi)的峰面積,將其代入到峰面積與Mb含量的線性關(guān)系中,得到發(fā)酵液中的Mb日含量如表3所示。由表3可知,24、48 h下測得的Mb含量為1.008、1.336 μmoL·250 mL-1,表明在培養(yǎng)前期,MethylosinustrichosporiumOB3b分泌出的Mb含量極低;72~96 h時間段內(nèi),得到250 mL發(fā)酵液當(dāng)中的Mb含量分別為3.125、7.500 μmoL,OB3b培養(yǎng)后期分泌的Mb含量明顯增加,每個時間段樣品重復(fù)測定3次,由標(biāo)準(zhǔn)差SD和RSD的結(jié)果分析可知,重現(xiàn)性良好。

表3 甲烷氧化菌不同培養(yǎng)時間段下分泌的Mb含量Table 3 Mb content secreted by methane oxidizing bacteria at different culture time
3 結(jié)論
通過對MethylosinustrichosporiumOB3b的Mb的紫外光譜圖與三維液相色譜圖的結(jié)合分析,證明發(fā)酵液中Mb具有硫酰咪唑基團及酪氨酸活性基團,并結(jié)合色譜分析時的出峰位置獲得了利用CAS方法結(jié)合HPLC方法測定Mb的依據(jù)。通過優(yōu)化后的CAS分光光度法(各試劑的添加量為0.02 mmoL/L CAS溶液2.0 mL、0.02 mmoL/L CuSO4溶液1.2 mL、0.02 mmoL/L HDTMA溶液的添加量4.0 mL、磷酸緩沖液2.0 mL、絡(luò)合時間為15 min)測定了1 L發(fā)酵液當(dāng)中Mb的含量為26.91 μmoL;通過CAS法檢測OB3b 1 L發(fā)酵液當(dāng)中Mb最低含量為稀釋50倍后的濃度值,最低檢測限為0.042 μmoL/L,重現(xiàn)性較好。在此基礎(chǔ)上結(jié)合HPLC法實現(xiàn)了對發(fā)酵液中Mb含量的周期監(jiān)測,在發(fā)酵24、48、72、96 h時發(fā)酵液中Mb含量分別為1.008、1.336、3.125、7.500 μmoL/250 mL。本文對前人所述方法進行了進一步的改進,精密度和方法的穩(wěn)定性都有所提高,為Mb的發(fā)酵、生產(chǎn)和應(yīng)用提供依據(jù)。

