冰藏聯用ClO2保鮮對大黃魚肌肉優勢腐敗菌及品質的影響
吳迪迪,李勇勇,史詠梅,王 焙,張登科,婁永江
(寧波大學食品與藥學學院,浙江寧波 315211)
大黃魚(Pseudosciaenacrocea)是我國重要的經濟水產養殖魚之一,因其味道鮮美,富含營養成分而深受大眾歡迎[1]。由于新鮮大黃魚含有較高的蛋白質和水分,極易腐敗變質。目前關于大黃魚的保鮮方法主要有輻照保鮮[2]、超高壓保鮮[3]、氣調保鮮[4-5]、復合保鮮[6]等,但因為面臨技術不成熟及商業成本高等問題還不能完全普及。冰藏保鮮[5,7-8]是常見的保鮮方法,但大黃魚的肌肉易被腐敗微生物侵染而腐敗變質[9]。二氧化氯(Chlorine Dioxide,ClO2)作為一種新型的保鮮介質,對水體中傳播的病原微生物、病毒、芽孢都有極強的殺滅作用[10],且具有安全無殘留,效率高、副產物少、成本低等優點,是目前國際上公認的高效殺菌劑和食品保鮮劑[11],研究表明ClO2對微生物的細胞壁有較好的透過和吸附性能,控制微生物蛋白質的合成,并使蛋白質中的部分氨基酸發生氧化還原反應,使氨基酸分解破壞,最終導致微生物死亡[12]。目前,國內ClO2在果蔬保鮮方面有較多研究[13-14],但研究ClO2對大黃魚肌肉保鮮處理的報道甚少。
本研究選取大黃魚肌肉作為原材料,以三種不同的保鮮方式進行保鮮處理,測定其微生物變化和品質特性,并利用高通量測序技術分析大黃魚肌肉的腐敗菌,旨在進一步提高大黃魚的肌肉品質,延長產品保藏期,為穩定型ClO2冰對大黃魚肌肉的保鮮產業化開發提供指導。
1 材料與方法
1.1 材料與儀器
大黃魚 購于浙江寧波路林市場的閩粵東族養殖大黃魚,選取表皮光澤無損傷,魚鱗完整并有少量透明粘液,個體均勻,重量約為(450±50) g/條的鮮活大黃魚;ClO2試劑(A試劑、B試劑) 純歐德公司;基因組DNA抽提試劑盒系列 上海遠慕生物科技有限公司;Qubit3.0 DNA檢測試劑盒 上海斯信生物科技有限公司;Taq DNA聚合酶 賽默飛世爾科技公司;MagicPure Size Selection DNA Beads 北京全式金生物技術有限公司。
A96FS70TI型變頻冰箱 德國Siemens股份有限公司;TX-XT plus質構儀 英國SMS公司;PEN3型電子鼻 德國Airsense公司;Pico-21臺式離心機Thermo Fisher;凝膠成像系統 美國UVP;Q32866 Qubit? 2.0熒光計 Invitrogen;T100TM Thermal Cyeler PCR儀 BIO-RAD。
1.2 實驗方法
1.2.1 ClO2冰的制備 參照純歐德ClO2試劑說明書,配制濃度為300 mg/L的高濃度的ClO2溶液,將稀釋至5 mg/L的溶液置于制冰機中,制備大小約為(0.75±0.25) cm3的穩定型ClO2碎冰。
1.2.2 保鮮處理 活體大黃魚載氧運至實驗室后,放在冰水中30 min冷卻致死后隨機分成三組,冷藏保鮮(CK組):大黃魚裝入帶孔泡沫箱后置于0~4 ℃環境下;冰藏保鮮(IC組):大黃魚裝入帶孔泡沫箱后加入普通碎冰覆蓋,置于0 ℃~4 ℃環境下;冰藏聯用ClO2保鮮(CD組):大黃魚裝入帶孔泡沫箱后加入ClO2碎冰覆蓋,置于0 ℃~4 ℃環境下,不同組碎冰覆蓋厚度均為(3.0±0.5) cm,每隔24 h補充一次碎冰。選取大黃魚背部肌肉去鱗、去皮進行指標測定,并在第0、1、3、5、9、13、17、21 d進行樣品測定分析。
1.2.3 高通量測序鑒定
1.2.3.1 樣品預處理 參照文獻[15-16],將不同處理組的大黃魚放入滅菌泡沫盒中0~4 ℃條件下保藏7 d后各取肌肉200 mg。將樣品放入2 mL離心管中,加入70%乙醇溶液1 mL,振蕩,離心(10000 r/min,3 min),移去上層液體。加入1×PBS溶液,振蕩混勻并再次離心(10000 r/min,3 min),之后移去上層液體。將2 mL離心管倒置于吸水紙上1 min至無液體流出為止。離心管于55 ℃烘箱直至殘留酒精完全揮發。
1.2.3.2 宏基因組DNA的提取 采用E.Z.N.ATM Mag-Bind Soil DNA Kit的試劑盒(OMEGA公司)提取總DNA,并用凝膠電泳(濃度為1%瓊脂糖)對所提取總DNA的完整性進行檢測,檢測濃度采用超微量分光光度計(ThermoNanoDrop 2000)。將檢測合格的總DNA于-20 ℃條件下保存,用于后續實驗。
1.2.3.3 PCR擴增及高通量測序 經PCR擴增,使用Qubit3.0 DNA檢測試劑盒進行基因組DNA精確定量。用于PCR擴增的引物與Miseq測序平臺的V3-V4通用引物已經融合,341F引物:CCCTACA CGACGCTCTTCCGATCTG(barcode)CCTACGGGNG GCWGCAG;805R引物:GACTGGAGTTCCTTGGCAC CCGAGAATTCCAGACTACHVGGGTATCTAATCC。
經兩輪PCR擴增完成接頭序列的連接。PCR結束后,先利用瓊脂糖進行電泳鑒定,之后再進行DNA純化回收。使用Qubit 2.0 DNA測定試劑盒精確定量回收的DNA,以便以1∶1的等量混勻后進行測序。每個樣品等量混合后的DNA量取10 ng,最終上機時測序濃度為20 pmol。
1.2.4 菌落總數 依據GB 4789.2-2016菌落總數的測定。
1.2.5 pH 依據GB 5009.237-2016食品中pH的測定。
1.2.6 質構特性測定 參考廖媛媛等[17]的操作方法略作修改,將三組大黃魚室溫下解凍20 min切取背部肌肉2.5 cm×2.5 cm×1.5 cm的無刺樣品,用TX-XT plus質構儀進行測定。探頭選用直徑為5 cm的圓柱形探頭。壓縮探針速度為1 mm/s,測試壓縮比為50%,平行測定6次。
1.2.7 揮發性鹽基氮(TVB-N) 按照GB 5009.228-2016方法進行試驗。
1.2.8 TBARS的測定 參考馬麗珍等[18]的操作方法略作修改,稱取10.0 g背部肌肉研細后,置于100 mL的加蓋錐形瓶中,加入50 mL 7.5%的三氯乙酸(含 0.1% EDTA),混勻后,室溫放置30 min,浸漬液用雙層濾紙過濾。濾液重復用雙層濾紙過濾一次。取5 mL濾液加入25 mL離心管中,加入5 mL 0.02 mol/L硫代巴比妥酸溶液,在90 ℃水浴40 min。
之后流水冷卻。再加入5 mL氯仿并搖勻。分層后取上清液分別在532 nm和600 nm處比色。記錄吸光度值并用以下公式計算TBARS值。
與TBARS反應的物質的量(TBARS)單位表示為mg·MA/kg。
1.2.9 電子鼻檢測 參考楊茗媛等[19]的操作方法略作修改,將不同處理組的大黃魚肌肉解剖,取背部同一部位肌肉0.50 g于10 mL頂空瓶中,加蓋密封,放入4 ℃樣品盤待檢,樣品平衡時間20 min,平衡溫度35 ℃,取樣體積3 mL;進樣速度25 mL/s,進樣口溫度45 ℃。
1.3 數據處理
使用SAS 8.5及Origin 9.0進行數據分析處理,數據結果均以“mean±SD”來表示,每組實驗重復5次。同一列中的不同小寫字母表示顯著差異(p<0.05)。
2 結果與分析
2.1 不同處理方式對大黃魚肌肉貯藏期間細菌群落結構的影響
由表1可以看出,CK組中的腐敗菌是希瓦氏菌屬、假單胞菌屬、冷桿菌屬、摩根氏菌屬、氣單胞菌屬。在IC組中,希瓦氏菌屬、假單胞菌屬、冷桿菌屬是優勢菌,而在CD組中,僅有希瓦氏菌屬和假單胞菌屬是優勢細菌。Ge等[20]研究腐敗大黃魚肌肉中分離出10株菌,其中8株產生H2S的菌株與希瓦氏菌屬密切相關,另外的兩株分離株分別被鑒定為熒光假單胞菌和P.fragi。加冰處理對摩根氏菌屬、弧菌屬與類香味菌屬有明顯的抑制效果,可能由于加冰處理抑制了嗜熱微生物的生長。但ClO2處理后大黃魚肌肉中的菌屬種類均顯著降低,由于ClO2分子外層具有一對未成對的活潑的自由電子,具有很強的氧化能力,破壞微生物的結構,從而改變微生物菌群結構及造成數量降低[21]。
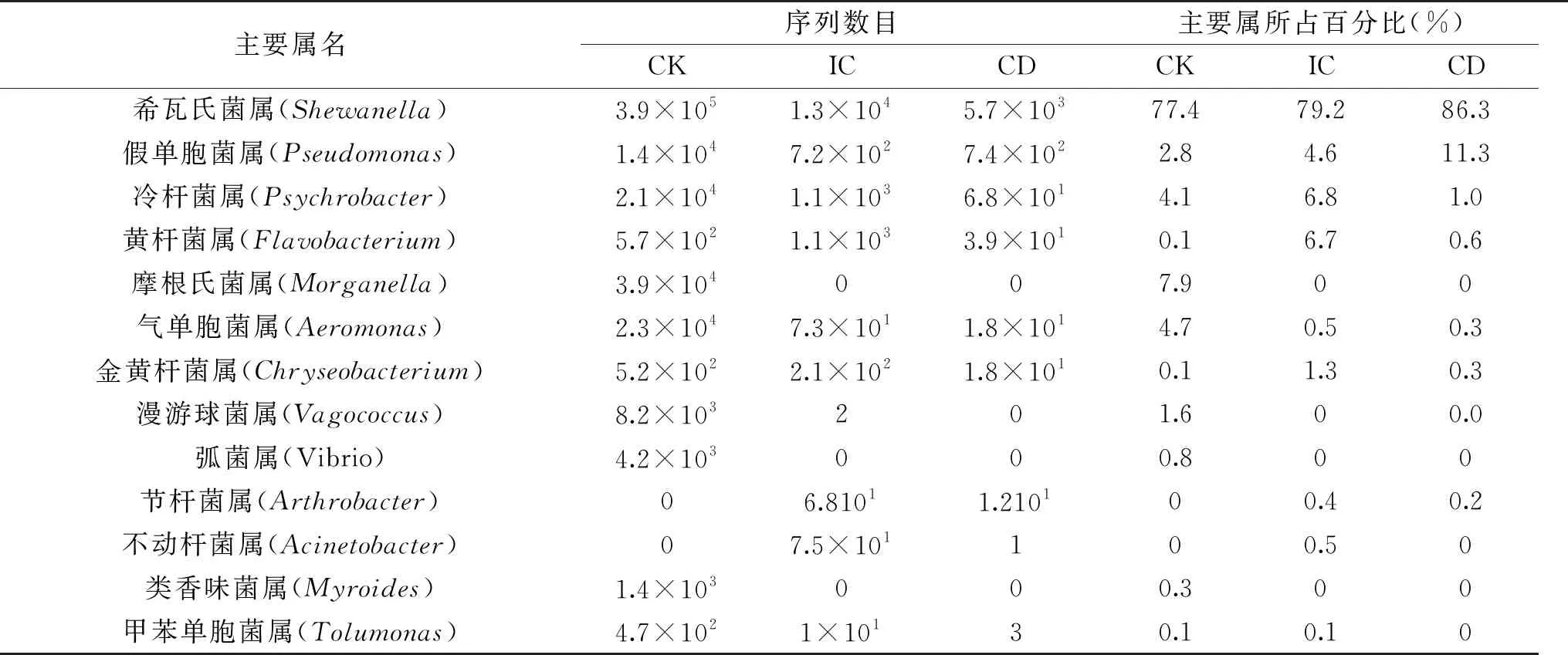
表1 基于屬水平上樣本主要rank reads數目Table 1 Number of major rank reads of the sample at the genus level
2.2 不同處理方式對大黃魚肌肉菌落總數的影響
圖1表明,隨著貯藏時間的延長,各組菌落總數均呈上升趨勢。IC組前期上升趨勢較CK組不顯著(p>0.05),后期上升趨勢有顯著差異(p<0.05)。從貯藏效果來看,CD組>IC組>CK組,說明ClO2冰殺菌及抑制細菌增長繁殖的效果優于普通冰。ClO2分子外層具有一對未成對的活潑的自由電子,具有很強的氧化能力,可以使微生物中含有的蛋白質(酶)中氨基酸間的鏈氧化斷裂,使蛋白質失去活性,阻止細胞再生[22-23]。季曉彤等[24]研究也證明了ClO2可以起到殺菌并延長貨架期的作用。
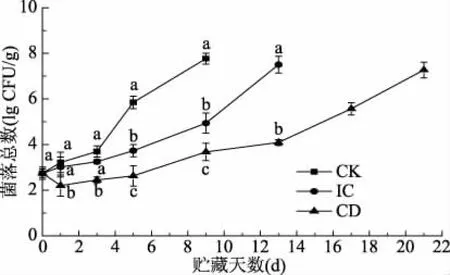
圖1 不同處理組對大黃魚肌肉菌落總數的影響Fig.1 Effects of different treatment groups on the total number of large yellow croaker colonies注:不同處理組同一天不同小寫字母 表示差異顯著;圖2~圖5同。
2.3 不同處理方式對大黃魚肌肉pH的影響
圖2結果所示,在貯藏過程中,每組的pH呈先下降后上升趨勢。其中,CD組與前兩組比較有顯著性差異(p<0.05)。貯藏初期,魚體經歷僵硬、自溶兩個過程中,僵硬期微生物使糖原和ATP分解產生乳酸、磷酸,使肌肉組織酸性增強,導致pH下降,自溶期pH開始升高,由于肌肉中大量蛋白質分解為氨基酸和可溶性含氮物,這為微生物的繁殖提供了條件[25]。pH下降后又開始緩慢上升是由于肌肉內源性及微生物來源蛋白酶降解氨基酸產生胺類等堿性物質所致[23-24]。CD組的pH下降緩慢,ClO2具可以抑制蛋白質(酶)中的氨基酸鏈發生斷裂,從而使蛋白質失去活性,最終使糖原和ATP分解產酸量減少[26]。同時,ClO2處理后下降緩慢是由于微生物中的外源性蛋白酶失去活性,進一步抑制體系中產胺微生物的滋生,從而降低自溶程度,使pH上升緩慢[27]。
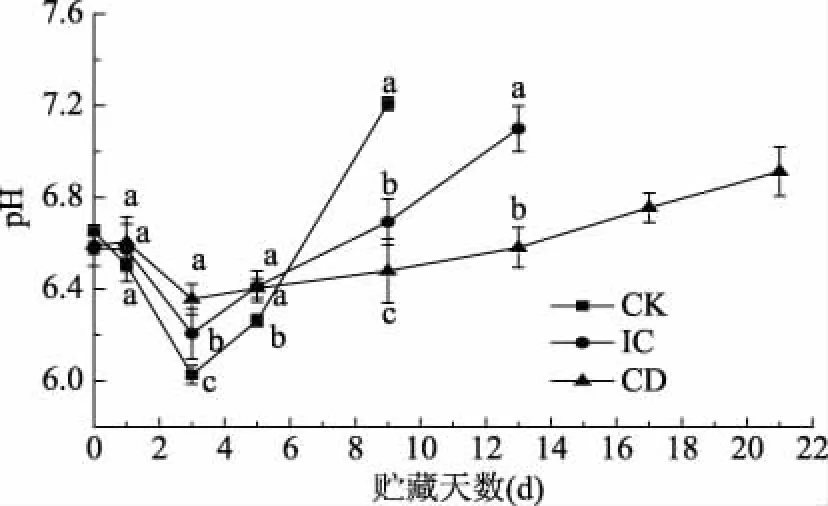
圖2 不同處理組對大黃魚肌肉pH的影響Fig.2 Effect of different treatment groups on pH of large yellow croaker
2.4 不同處理方式對大黃魚肌肉質構特性的影響
圖3結果表明,隨著貯藏時間的延長,CD組相比較CK組和IC組的硬度(A圖)、彈性(B圖)、咀嚼性(C圖)均呈現先上升再下降的趨勢,在貯藏3 d后CD組下降速度較CK組和IC組緩慢,出現顯著差異(p<0.05)。由于養殖大黃魚在死后,進入了僵硬期,肌肉的質地特性受蛋白質、水分、脂肪含量的影響,貯藏期間,肌肉的水分含量逐漸減少,脂肪和蛋白質逐漸被氧化和分解[28];隨后由于內源蛋白酶和腐敗微生物的降解導致蛋白分子結構發生變化,繼而導致硬度、彈性、咀嚼性等等指標下降[29-30]。結果中CD組樣品的質構特性優于CK組樣品,這是由于樣品經過ClO2處理后對微生物的抑制作用較強,微生物無法通過生物活性與代謝活動對大黃魚肌肉的蛋白質產生影響[31];同時,冰藏的處理方式使樣品迅速降溫,抑制其組織內部酶的活性及細胞的代謝,從而起到保持蛋白質特性的目的。

圖3 不同處理組對大黃魚肌肉質構的影響Fig.3 Effects of different treatment groups on the texture of large yellow croaker
2.5 不同處理方式對大黃魚肌肉TVB-N的影響
從圖4中可知,隨著貯藏時間的延長,不同處理組的TVB-N值均呈上升趨勢且差異顯著(p<0.05)。在貯藏期間,IC組和CD組樣品的TVB-N值上升趨勢低于CK組。研究表明普通冰和ClO2可以抑制微生物的生長繁殖并降低內源酶的作用,從而延緩蛋白質的分解,降低魚肉的腐敗程度[32]。CD組相比于IC組能夠較好地抑制TVB-N值的上升,由于ClO2通過使微生物蛋白質失活達到殺菌目的,有利于降低TVB-N的生成速率,表明ClO2可以有效抑制微生物的生長[24,26]。

圖4 不同處理組對大黃魚肌肉TVB-N的影響Fig.4 Effects of different treatment groups on TVB-N of large yellow croaker
2.6 不同處理方式對大黃魚肌肉TBARS值的影響
TBARS是評估脂質氧化程度的重要參考指標,TBARS值與反應中產生的醛、酮等小分子物質成正比,說明TBARS值越大,其脂質氧化程度越高[33-34]。圖5表明不同處理組對養殖大黃魚肌肉的TBARS值的影響,貯藏初期新鮮大黃魚肌肉的TBARS值為0.26 mg/100 g左右。貯藏前期,CD組的TBARS值均呈現上升趨勢且較CK組和IC組差異極顯著(p<0.0001),說明氧化程度嚴重;其中,貯藏初期IC組大黃魚肌肉的TBARS值上升速率低于CK組。貯藏前期冰藏聯用ClO2處理組上升較快,可能由于ClO2具有強氧化性,使脂肪氧化成丙二醛(MDA),隨后ClO2進一步將醛類物質氧化為羧酸[35],使TBARS含量下降。楊賢慶等[31]研究不同濃度的ClO2對羅非魚魚丸的TBARS值有較好的抑制效果,且低濃度的ClO2就能有較好的抑制效果,與本研究結果一致。
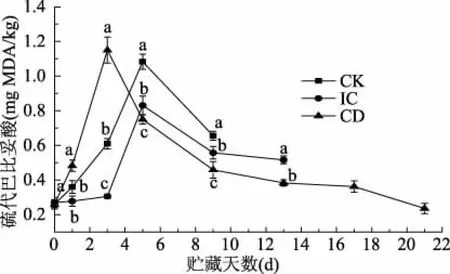
圖5 不同處理組對大黃魚肌肉TBARS值的影響Fig.5 Effects of different treatment groups on TBARS values of large yellow croaker
2.7 不同處理方式對大黃魚肌肉氣味變化的影響
電子鼻可以靈敏地檢測到不同大黃魚肌肉氣味的變化,利用電子鼻作為完善食品在保藏期間氣味變化的衡量標準[36],可以更準確直觀的反應大黃魚肌肉品質變化及腐敗程度,避免主觀因素對感官評價的影響。圖6通過執行載荷分析來消除冗余傳感器,根據分析,傳感器S2(氮氧化物)、S6(甲烷)、S7(無機硫化物)和S9(芳香成分,有機硫化物)對大黃魚背部肌肉具有較高的響應值,與前人研究結果相似[19]。腐敗希瓦氏菌是一種典型的冷藏海魚腐敗菌,具有較強的腐敗活性,可產生H2S,還原TMAO等物質;假單胞菌可以產生大量的醛、酮和酯類等物質[37-39]。圖7表示不同處理條件下養殖大黃魚背部肌肉電子鼻PCA分析結果,每個橢圓代表不同處理組,橢圓分布距離越遠,說明氣味差異性越大[19]。圖7的PC1、PC2的方差貢獻率分別為92.47%、5.17%,PC1、PC2的總貢獻率為97.64%。CK組、IC組、CD組分別在貯藏5 d、9 d、17 d后的橢圓距離新鮮樣品(0 d)較遠,這與菌落總數和TVB-N值一致,表明肌肉接近腐敗的終點。由于PC2的方差貢獻率為5.17%,說明ClO2對于大黃魚肌肉貢獻率影響不大,說明其貢獻率主要源于微生物腐敗以及蛋白質自溶。
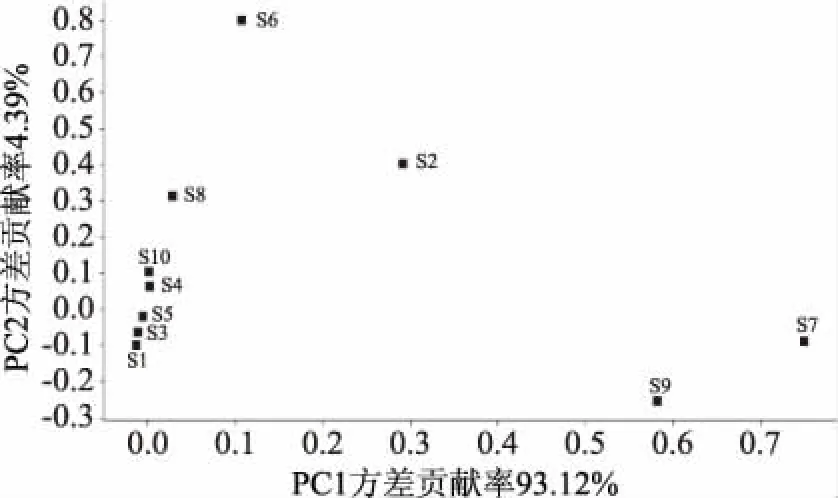
圖6 電子鼻傳感器對大黃魚肌肉背部肉響應值載荷分析Fig.6 Load analysis of response value ofelectronic nose sensor to cultured Pseudosciaena crocea
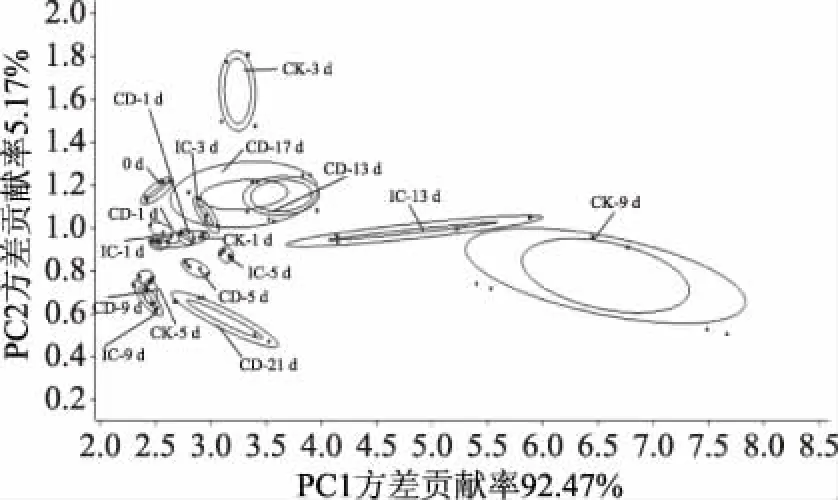
圖7 ClO2冰對大黃魚肌肉背部肉電子鼻數據PCA圖Fig.7 PCA diagram of chlorine nose ice on the back of meat of large yellow croaker
3 結論
通過高通量測序分析表明冰藏聯用ClO2處理能降低菌落總數,改變菌相組成。大黃魚肌肉經過ClO2冰處理后,其TVB-N值、TBARS值、硬度、咀嚼性、彈性和pH等理化指標相較于冰藏保鮮變化較為小,表明ClO2冰可以使大黃魚肌肉保持較好的理化品質,并延長其貨架期。同時,從氣味變化可以看出,肌肉經ClO2冰處理后,不僅減少其品質劣變而且又不影響大黃魚肌肉本身的風味。

