UV-C處理抑制馬鈴薯貯藏期發芽及相關機理研究
史 萌,許立興,林 瓊,閻瑞香,劉 斌,關文強,*
(1.天津市食品生物技術重點實驗室,天津商業大學生物技術與食品科學學院,天津 300134; 2.中國農業科學院農產品加工研究所,北京 100193; 3.天津科技大學包裝與印刷工程學院,天津 300222; 4.天津市制冷技術重點實驗室,天津商業大學機械工程學院,天津 300134)
馬鈴薯又稱土豆、洋芋,是繼小麥、水稻、玉米之后的第四大主糧[1],因其營養豐富,糧菜兼用深受消費者及食品加工業者的喜愛[2]。但馬鈴薯在貯藏過程中容易發芽,發芽后的馬鈴薯不僅品質降低,更會產生α-茄堿等有毒物質,給消費者帶來巨大安全隱患[3],因此解決馬鈴薯貯藏期間的發芽問題一直是研究的熱點和難點。
現階段馬鈴薯抑芽主要通過化學抑芽劑結合溫度控制完成[4]。目前常用的氯苯胺靈(CIPC)在2.5%處理濃度時可明顯抑制馬鈴薯塊莖頂芽的生長[5],由于化學抑芽劑存在污染環境等問題,其使用逐漸受到限制[4]。適宜低溫貯藏有利于抑制馬鈴薯發芽,4 ℃低溫下貯藏120 d后馬鈴薯發芽數量及芽長仍無明顯變化[6-7],但低溫糖化會嚴重影響馬鈴薯加工色澤并增加丙烯酰胺等潛在致癌物質。外源乙烯可以通過影響馬鈴薯碳水化合物代謝來抑制馬鈴薯塊莖的發芽,且乙烯用量越大,馬鈴薯抑芽效果越好[8-10],但使用乙烯氣體對馬鈴薯的儲存容器有很高的要求,且乙烯對馬鈴薯抑芽的閾值尚未明確[8]。因此,尋求天然無害的抑芽方法對馬鈴薯貯藏具有重要意義。
UV-C是主要的生物效應紫外線波段,能被生命體蛋白質分子吸收并破壞其核酸結構。低劑量紫外線照射易造成DNA可修復性損傷,進而引起生物體內抗性產生并增加細胞保護[11]。近年來研究表明,UV-C可控制番茄、菠菜等多種果蔬中致病微生物的生長,增加抗氧化酶的活性并延緩果蔬的劣變速度[12-15]。Ranganna等[16]研究發現UV-C可以降低馬鈴薯干腐病和軟腐病的發病率,抑制馬鈴薯發芽并提高貯藏品質。然而,由于果蔬間組織結構、采后生理特性存在差異,不同UV-C處理方式對貯藏品質的影響較大[17]。目前關于UV-C照射劑量和處理方式對馬鈴薯貯藏中的抑芽效果及相關機理尚未見報道。本實驗以“大西洋”馬鈴薯為實驗材料,采用10 kJ/m2劑量UV-C分別在貯藏前(一次處理)、貯藏前及中期(二次處理)進行照射,研究UV-C處理對馬鈴薯貯藏期間的抑芽效果,并從赤霉素、茄堿等的變化角度來確定相關機理,為開發馬鈴薯貯藏保鮮新技術提供參考。
1 材料與方法
1.1 材料與儀器
“大西洋”馬鈴薯 天津市西青區洋裕生物技術有限公司脫毒馬鈴薯微型種薯繁育基地;L-苯丙氨酸 分析純,天津江天化工技術有限公司;沒食子酸 分析純,上海科豐試劑廠;鹽酸 分析純,天津化學試劑批發公司;冰乙酸、乙酸鋅 色譜純,天津贏達稀貴化學試劑廠;1,2-二氯乙烷 色譜純,天津津科精細化工研究所;三氟乙酸 色譜純,天津南開允公合成技術有限公司;磷酸、硼酸、硼砂、酒石酸鉀鈉、亞鐵氰化鉀 分析純,天津贏達稀貴化學試劑廠;聚乙烯吡咯烷酮 優級純,美國Sigma公司;無水乙醇 分析純,天津風帆化學世紀科技有限公司。
LC-20A高效液相色譜儀 日本島津公司;TUBE-MILL control試管研磨機 德國IKA公司;FD8-4真空冷凍干燥機 美國西盟國際公司;Evolution 201紫外可見分光光度計 美國Thermo公司;BDS Thermo C18反相色譜柱 美國熱電公司;電熱恒溫水浴鍋HWS-24 上海一恒科學儀器有限公司;EL204電子天平 梅特勒-托利多儀器(上海)有限公司;UVX數字照度計 美國UVP公司;UV-C處理裝置 天津商業大學自制,由4根功率為40 W的紫外殺菌燈(G15T8)組成。
1.2 實驗方法
1.2.1 樣品處理 挑選大小均一、無病蟲害、無腐爛的馬鈴薯立即運到實驗室進行愈傷(16 ℃,避光條件下放置2周)。前期實驗發現10 kJ/m2的UV-C處理對馬鈴薯發芽的抑制作用最明顯,故采用10 kJ/m2劑量的UV-C(照射距離20 cm,照射強度1 mW/m2)在不同貯藏階段對馬鈴薯進行正反兩面分別照射,先將馬鈴薯平放,照射10 min后將塊莖翻轉180°繼續照射10 min,以保證照射均勻。
一次處理:馬鈴薯愈傷剛結束(貯藏前),用10 kJ/m2劑量的UV-C 對馬鈴薯正反面分別照射,處理后每6個馬鈴薯為一組裝入編織袋(高密度聚乙烯材料,30 mm×40 mm)中,共36組(216個),于10 ℃冷庫中貯藏。
二次處理:一次照射處理的馬鈴薯于冷庫中(10 ℃、RH=90%)貯藏45 d后到達休眠打破的關鍵時期,取出12組(72個)再次用10 kJ/m2劑量的UV-C對馬鈴薯正反面分別照射處理后裝回編織袋中繼續貯藏;CK:以不經UV-C處理的馬鈴薯為對照組。
貯藏期間每15 d測定一次發芽率、失重率、還原糖、苯丙氨酸解氨酶(PAL)及總酚含量。赤霉素和α-茄堿含量主要與發芽程度和休眠期有關,故實驗時主要測定關鍵時期的含量變化,分別每45 d和30 d一測,每次測定進行3次重復。
1.2.2 指標測定
1.2.2.1 發芽率的測定 按芽眼數進行計算。

式(1)
1.2.2.2 失重率的測定 采用差量法進行測定[18]。

式(2)
1.2.2.3 還原糖含量測定 采用3,5-二硝基水楊酸比色法[19]。稱取烘干(85 ℃,48 h)后的馬鈴薯肉質部分粉末1.00 g(相當于鮮樣3.70 g)置于三角瓶中,加入25 mL蒸餾水,混勻后于50 ℃恒溫水浴中保溫20 min,不斷攪拌使還原糖浸出,以10000 r/min離心10 min,取2 mL上清液進行還原糖含量的測定。
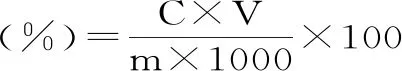
式(3)
式中:C為還原糖含量(mg/mL);V為還原糖提取液總體積(mL);m為樣品重量(g);1000為換算系數。
1.2.2.4 總酚含量的測定 采用Wu等[20]的方法。稱取馬鈴薯鮮樣20 g,加入40 mL 70%乙醇勻漿后在60 ℃下超聲20 min,并于12000 r/min離心15 min,取上清液0.5 mL與1 mL福林酚試劑混合,然后加入3 mL 20% Na2CO3溶液并在25 ℃靜置120 min。用紫外可見分光光度計在760 nm處測定吸光值,以焦性沒食子酸標準曲線y=0.0098x+0.0037計算相應的總酚含量,結果表示為“mg沒食子酸/g鮮重”。
1.2.2.5 苯丙氨酸解氨酶(PAL)的測定 參考Hussain[21]的方法。稱取馬鈴薯鮮樣20 g,加入80 mL含5 mmol/L的巰基乙醇-硼酸緩沖液,加入2 g聚乙烯吡咯烷酮(PVPK30),勻漿后冰浴研磨,于4 ℃、12000 r/min條件下離心15 min,上清液即為粗酶液。取0.5 mL粗酶液加入2 mL 0.1 mol/L苯丙氨酸(溶于0.1 mol/L,pH=8.8的硼酸緩沖液),混勻后開始計時,測定OD290作為初值,37 ℃恒溫水浴,每10 min測定一次OD290。以提取液(巰基乙醇-硼酸緩沖液)作為空白對照,每分鐘OD290值變化0.01為一個酶活單位(U)。
1.2.2.6 赤霉素(GA3)含量的測定 參照Pan X[22]的方法提取馬鈴薯中GA3并用外標法測定含量。稱取真空冷凍干燥(-80 ℃,48 h)后的馬鈴薯肉質部分粉末2.00 g(相當于鮮樣7.50 g),加入10 mL丙醇∶水∶濃鹽酸=2∶1∶0.002 (V/V/V)的混合溶液,于4 ℃下振蕩30 min,加入10 mL二氯乙烷,4 ℃下振蕩30 min后于4 ℃、12000 r/min條件下離心15 min,取下清液,并向殘渣中加入2 mL二氯乙烷,二次離心,合并下清液為粗提液。將粗提液真空冷凍干燥(-80 ℃,12 h)所得的殘留物加入5 mL磷酸鹽緩沖液(0.01 mol/L,pH=3.5)溶解,經預活化的C18柱(6 mL甲醇活化,6 mL 80%甲醇平衡)過濾,以1 mL的80%甲醇進行洗脫,并收集全部洗脫液,真空冷凍干燥后用流動相溶解殘渣并定容至1 mL,溶液經0.45 μm濾膜過濾,濾液用于HPLC測定。
HPLC條件:BDS Thermo C18反相色譜柱(250 mm×4.6 mm,5 μm),柱溫為30 ℃;流動相為甲醇∶水=3∶7 (V/V),流速為1.0 mL/min,進樣量為20 μL,檢測波長為235 nm。每45 d測定一次,每次做3個重復。
1.2.2.7α-茄堿含量的測定 按照Pias[23]的方法提取馬鈴薯中α-茄堿并用外標法測定其含量。稱取真空冷凍干燥(-80 ℃,48 h)后的馬鈴薯表皮(厚度為2 mm)或馬鈴薯肉質部分的粉末2.70 g(相當于鮮樣10.00 g),加入40 mL水∶乙酸∶亞硫酸氫鈉=100∶5∶0.5 (V/V/W)的混合溶液,于室溫下振蕩30 min后離心(12000 r/min,15 min),取上清液10 mL,經預活化的C18柱(6 mL乙腈活化,6 mL水∶乙酸∶亞硫酸氫鈉=100∶5∶0.5 (V/V/W)平衡)過濾,用5 mL15%乙腈淋洗,用乙腈:磷酸鹽緩沖液(0.01 moL/L,pH=7.6)=5∶5(V/V)的混合溶液洗脫,收集4 mL洗脫液。
HPLC條件:BDS Thermo C18反相色譜柱(250 mm×4.6 mm,5 μm);流動相為乙腈∶0.1%三氟乙酸=35∶65 (V/V);流速:0.3 mL/min;進樣量:20 μL;波長:202 nm。每隔30 d分別對馬鈴薯表皮及肉質部分中的α-茄堿進行測定,每次做3個重復。
1.3 數據處理
利用Excel 2010和SPSS 16.0等軟件對實驗數據進行分析,并對實驗數據進行方差分析,用Duncan多重比較分析差異的顯著性(p<0.05)。
2 結果與分析
2.1 UV-C處理對馬鈴薯貯藏過程中發芽率的影響
馬鈴薯發芽后,芽的生長會大量消耗塊莖中的營養物質,使其外觀萎蔫,嚴重影響商品價值[19]。UV-C處理對馬鈴薯貯藏過程中發芽率的影響如表1所示。

表1 UV-C處理對馬鈴薯貯藏過程中發芽率的影響Table 1 Effect of UV-C treatments on germination rate of potato during storage
由表1可知,貯藏75 d時,CK組發芽率為66.67%,而UV-C一次處理及二次處理的馬鈴薯尚未發芽;貯藏至90 d時三組馬鈴薯均已發芽,其中CK組的發芽率最高,UV-C二次處理的發芽率最低且與CK組差異顯著(p<0.05);貯藏至105 d時,CK組發芽率94.80%,一次處理組為83.66%,二次處理組為68.78%,各組之間差異顯著(p<0.05)。可知UV-C處理可有效推遲馬鈴薯發芽時間,且二次處理方法對馬鈴薯發芽的抑制效果最好,但UV-C處理不能完全抑制馬鈴薯發芽。
2.2 UV-C處理對馬鈴薯貯藏過程中失重率的影響
隨著貯藏時間的延長,馬鈴薯受到自身呼吸作用及環境濕度的影響,使其重量不斷損失,失重率逐漸升高[24]。UV-C處理對馬鈴薯貯藏過程中失重率的影響見圖1。
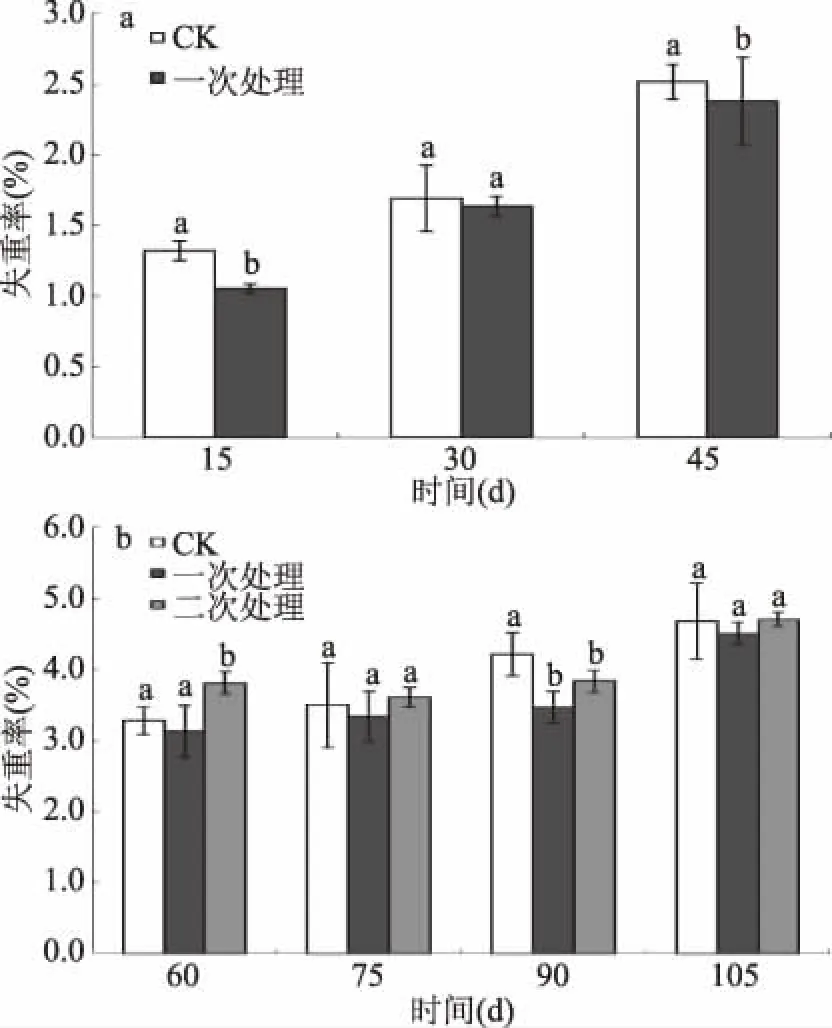
圖1 UV-C處理對馬鈴薯貯藏過程中失重率的影響Fig.1 Effect of UV-C treatments on weight loss of potato during storage注:小寫字母不同表示不同處理間差異顯著(p<0.05)。
由圖1可知,在貯藏15~45 d期間(圖1a),CK組馬鈴薯的失重率遠高于UV-C一次處理組,但存在差異并不顯著的情況(p>0.05)。貯藏至45 d時,CK組與一次處理組的失重率分別為2.52%及2.38%。貯藏60~105 d期間(圖1b),二次處理組的馬鈴薯失重率均高于一次處理組,可能是因為低劑量的UV-C處理可以在一定程度上降低馬鈴薯的呼吸速率,二次處理會使馬鈴薯表皮組織受到輕微損傷,加速水分蒸發[25]。失重率在整個貯藏期間呈上升趨勢,其原因是成熟馬鈴薯在15~35 d經歷初休眠期,此時呼吸旺盛,消耗過多營養物質,造成干物質含量急劇下降;貯藏60 d左右呼吸作用減弱,失重率上升速度略有緩和;休眠后期呼吸作用繼續加強,營養物質消耗加劇,失重率逐漸升高[26]。上述研究結果與Peng[27]類似。
2.3 UV-C處理對馬鈴薯貯藏過程中還原糖含量的影響
還原糖含量是衡量馬鈴薯可否作為加工原料的重要指標,也是影響馬鈴薯油炸食品顏色的主要因素[28]。UV-C處理對馬鈴薯貯藏過程中還原糖含量的影響如圖2所示。
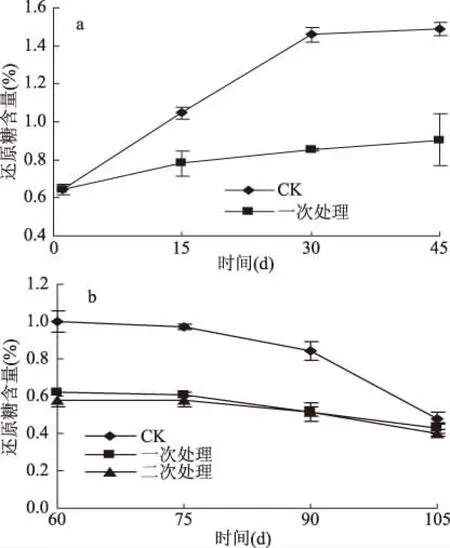
圖2 UV-C處理對馬鈴薯貯藏過程中還原糖含量的影響Fig.2 Effect of UV-C treatments on reducing sugar content of potato during storage
由圖2可知,各組馬鈴薯的還原糖含量均呈先升后降的趨勢,并在45 d達到最大值,且CK組與UV-C處理組的含量差異顯著(p<0.05)。相比于初始值,45 d時CK組與一次處理組的還原糖含量分別提高了1.3倍及0.4倍。還原糖含量在0~45 d增加的原因是馬鈴薯處于休眠階段,還原糖消耗較少,同時淀粉也不斷轉化為還原糖,使得還原糖不斷積累[29]。貯藏60 d時各組還原糖含量達到最大值,這與王希卓等人[26]的研究一致。貯藏60~105 d(圖2b)還原糖在含量下降是因為馬鈴薯發芽造成呼吸作用加強,還原糖大量消耗。故UV-C處理可抑制還原糖的產生速率,進而保證馬鈴薯貯藏品質。
2.4 UV-C處理對馬鈴薯貯藏過程中苯丙氨酸解氨酶(PAL)活性的影響
PAL是酚類物質生物合成途徑的關鍵酶,它與植物抗逆境脅迫和抗病性密切相關。PAL活性越高,植物抗逆境脅迫和抗病性作用越強。UV-C處理對馬鈴薯貯藏過程中PAL的影響見圖3。
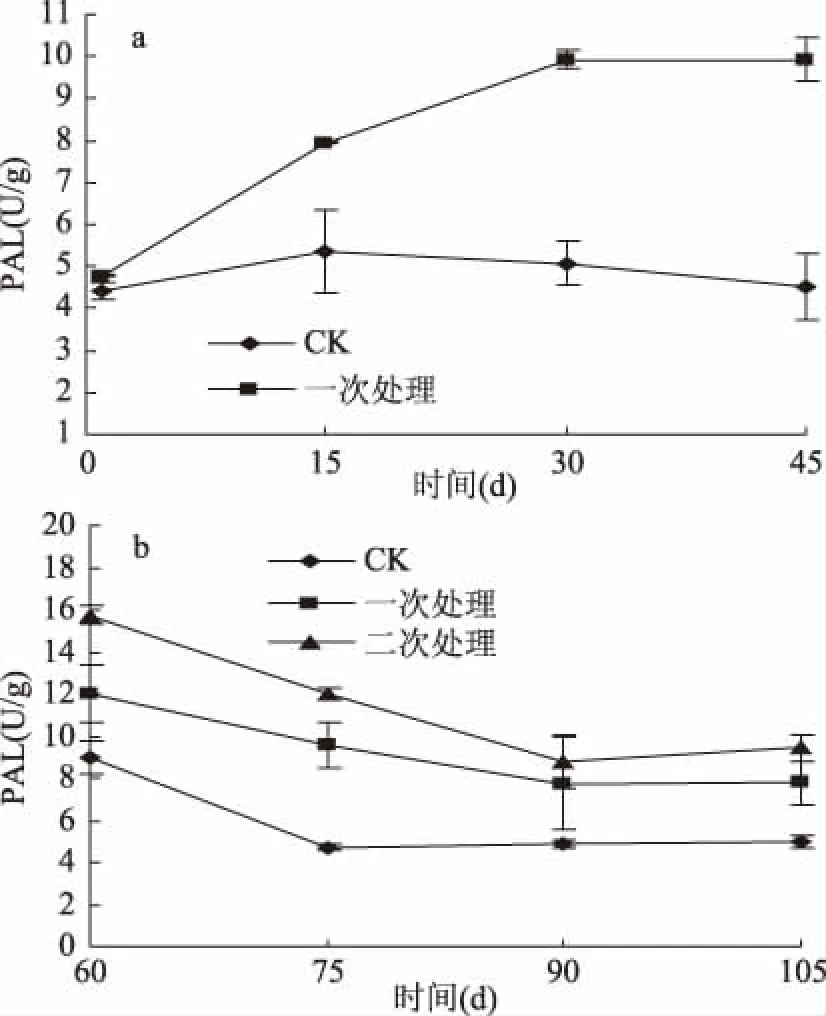
圖3 UV-C處理對馬鈴薯貯藏過程中PAL的影響Fig.3 Effect of UV-C treatments on PAL of potato during storage
由圖3可知,貯藏0~45 d期間(圖3a),UV-C一次處理組PAL活性逐漸上升,CK組逐漸下降且一次處理組的PAL活性顯著高于CK組(p<0.05);貯藏60 d(圖3b)時,三組馬鈴薯的PAL活性均達到最大值,隨后不斷降低。整個貯藏過程中,二次處理組馬鈴薯的PAL活性最高,CK組最低。UV-C處理可以誘導馬鈴薯中PAL的合成[30],因此一次處理組與二次處理組馬鈴薯中PAL活性較高,這與短波紫外線處理對蘋果PAL的影響結果一致[31]。
2.5 UV-C處理對馬鈴薯貯藏過程中總酚含量的影響
酚類物質為植物次生代謝產物,其含量及生物活性是評價果蔬營養品質的重要指標[32]。不同階段果蔬的總酚含量變化盡管存在差異,但其變化趨勢基本一致,成熟度越低,具有的酚類物質通常越高[33]。UV-C處理對馬鈴薯貯藏過程中總酚含量的影響見圖4。
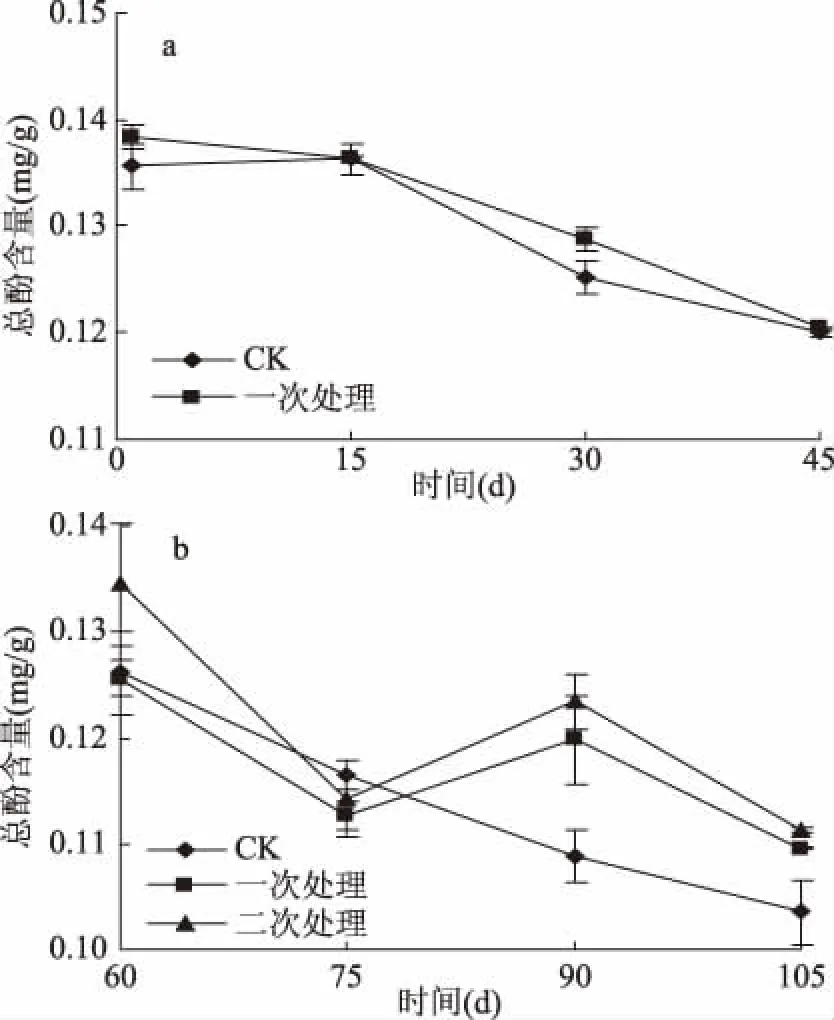
圖4 UV-C處理對馬鈴薯貯藏過程中總酚含量的影響Fig.4 Effect of UV-C treatments on total phenol content of potato during storage
由圖4可知,在貯藏1~45 d期間(圖4a),CK組與一次處理組的總酚含量逐漸下降,一次處理組的馬鈴薯總酚含量大多高于CK組但兩組差異不顯著(p>0.05)。貯藏60~90 d(圖4b),CK組的總酚含量下降,二次處理組的總酚含量相對較高。貯藏60 d時,CK組馬鈴薯呼吸作用加強,失水率增加使總酚含量較高;一次處理組的馬鈴薯雖未發芽,但仍有較高的失水率。UV-C二次處理可誘導馬鈴薯中酚類物質的合成,故總酚含量最高。貯藏后期(75~90 d),一次處理與二次處理的馬鈴薯總酚含量回升可能是因為UV-C脅迫刺激了馬鈴薯中次級代謝反應的持續發生,進而促使其在貯藏過程中不斷的合成與積累酚類物質[34-36]。多數報道認為總酚含量與PAL活性存在一定相關性,酚類物質是在PAL催化下產生,故90 d后總酚含量下降可能是PAL活性的下降導致[37]。
2.6 UV-C處理對馬鈴薯貯藏過程中赤霉素(GA3)含量的影響
GA3對于打破馬鈴薯休眠,促進馬鈴薯萌發具有重要作用[38]。UV-C處理對馬鈴薯貯藏過程中GA3含量的影響見表2。馬鈴薯在休眠期時,GA3含量隨貯藏時間的增加而升高,當含量增至一定閾值時會引起馬鈴薯塊莖休眠解除[39],周長艷[40]研究發現4種窖藏條件下馬鈴薯中的GA3含量先上升后下降。本研究結果表明,CK組與一次處理組的GA3含量呈現先升高后降低的趨勢,兩組均在45 d達到最大值,分別是貯藏初期的1.95、1.2倍。90 d時,二次處理的馬鈴薯GA3含量最高(見表2),其原因可能是馬鈴薯處于休眠期破除階段,GA3含量接近峰值[40]。

表2 UV-C處理對馬鈴薯貯藏 過程中GA3含量的影響(μg/g)Table 2 Effect of UV-C treatments on GA3 of potato during storage(μg/g)
2.7 UV-C處理對馬鈴薯貯藏過程中α-茄堿含量的影響
由表3可知,馬鈴薯肉質部分α-茄堿與表皮中含量差異較大,薯皮中α-茄堿含量遠遠高于肉質部分,這與伍慧敏[41]的研究結果一致。貯藏初期,表皮中α-茄堿處于較低水平,含量為14.15 mg/100 g FW,60 d時三組馬鈴薯表皮的α-茄堿含量迅速增加且均超過規定的安全范圍,但三組間差異并不顯著(p>0.05);90 d時三組馬鈴薯已全部發芽,CK組馬鈴薯表皮中α-茄堿含量最高,分別為一次處理組和二次處理組的1.18倍、1.40倍,但CK組與兩種處理組的差異不顯著(p>0.05)。可以看出,UV-C處理抑制表皮α-茄堿效果并不理想。馬鈴薯肉質部分α-茄堿含量隨著貯藏時間的延長而增加,但三組馬鈴薯的肉質部分α-茄堿含量均在規定的安全范圍內(≤20 mg/100 gFW)。在貯藏30 d時,CK組α-茄堿顯著高于一次處理組和二次處理組(p<0.05);貯藏至90 d,三組馬鈴薯均已發芽。其中CK組α-茄堿含量最大(1.46 mg/100 g FW),分別為一次處理組和二次處理組的1.39倍、1.52倍(見表3)。
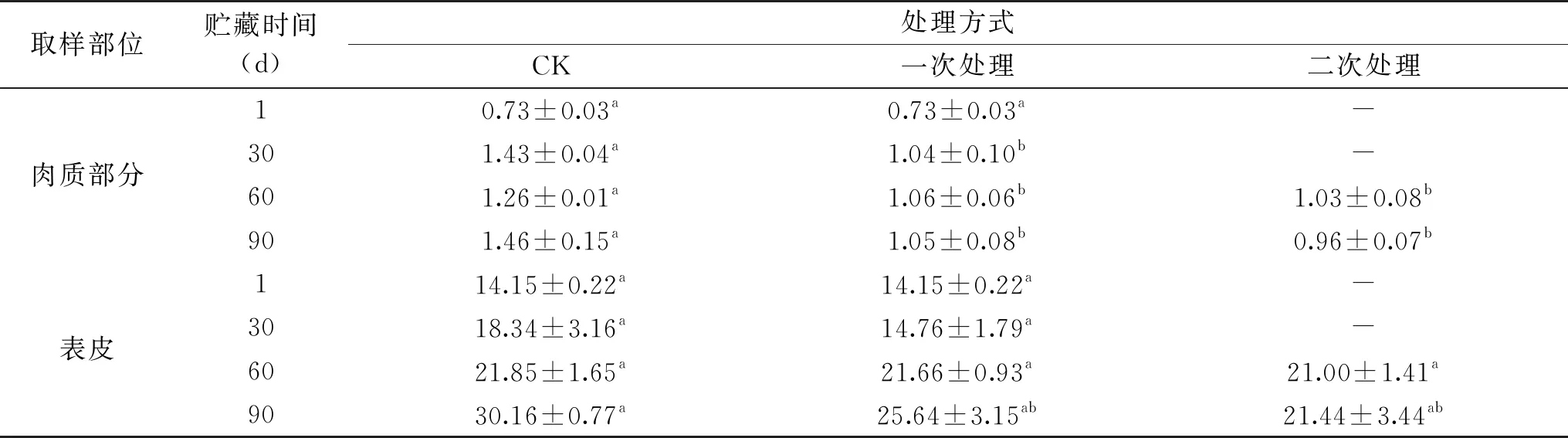
表3 UV-C處理對馬鈴薯貯藏過程中α-茄堿含量的影響(mg/100 g FW)Table 3 Effect of UV-C treatments on α-solanine of potato during storage(mg/100 g FW)
在整個貯藏期間,CK組馬鈴薯中α-茄堿的含量大多高于處理組,可見UV-C處理對降低馬鈴薯中α-茄堿含量具有一定的作用,分析原因為UV-C處理一方面通過抑制發芽減少了α-茄堿的合成,另一方面可能調控α-茄堿的合成與分解,但作用機理尚需進一步研究。
3 結論
采后UV-C照射處理能有效抑制馬鈴薯發芽,降低發芽率,延長休眠期,且UV-C二次照射處理效果最好,10 ℃貯藏105 d時UV-C一次處理和二次處理的馬鈴薯發芽率分別為83.66%、68.78%,比CK組分別低11.14%、26.02%。隨著貯藏時間的延長,馬鈴薯失重率、GA3以及α-茄堿含量總體呈上升趨勢,還原糖含量及PAL酶活性先升后降,總酚含量逐漸減少,UV-C處理組均可提高馬鈴薯總酚含量及PAL酶活性,延緩還原糖及α-茄堿含量的升高速度,有效調控GA3的含量并促進總酚的合成,且UV-C二次處理效果最好。UV-C二次處理馬鈴薯在貯藏90 d時薯皮和肉質部分的α-茄堿含量僅為CK組的71.09%、65.75%。綜合來看,UV-C二次照射是抑制馬鈴薯貯藏中發芽、調控品質的有效處理方式,在馬鈴薯貯藏中具有潛在的實踐應用價值和較好前景。

