紫外吸收劑在湖泊中的分布及其對底棲動物的毒性效應
仝天衡,楊慧婷,陳輝輝,梁雪芳,*,谷孝鴻
1. 內蒙古大學生態與環境學院,內蒙古自治區環境污染控制與廢物資源化重點實驗室,呼和浩特 010021 2. 中國科學院南京地理與湖泊研究所,湖泊與環境國家重點實驗室,南京 210008
紫外吸收劑是一類具有紫外光吸收功能的有機化合物,主要吸收UVA(320~400 nm)和UVB(280~320 nm)波長段,廣泛用于塑料等工業材料和化妝品等個人護理品,以防止光誘導的降解或保護人體皮膚免受輻射[1]。紫外吸收劑按照用途可分為紫外光穩定劑(UV stabilizer, UVS)和紫外光過濾劑(UV filter, UVF),分別作為工業材料和個人護理品中的添加劑。目前常用的紫外吸收劑可分為二苯甲酮類、苯并三唑類、樟腦衍生物類、對氨基苯甲酸類、肉桂酸酯類和水楊酸酯類等(圖1)[2]。本文主要介紹二苯甲酮類和苯并三唑類紫外吸收劑(文中關于化合物的相關信息見圖1和表1)。
紫外吸收劑屬大量生產及使用的一類化合物。2013年全球光穩定劑(主要是受阻胺類光穩定劑和紫外吸收劑)的總消費量和總產量約5.5萬t,其中美國消費量占全球總消費量的20%,歐洲占25%,我國占15%,日本占8%。二苯甲酮類和苯并三唑類分別占我國光穩定劑總消費量的23%和17%[3]。隨著大量使用,紫外吸收劑已經在地下水[4]、河流[5-6]、湖泊[7-8]、海洋[9]、沉積物[1,10-11]、污水[12]、污泥[5]和室內塵埃[13]等多種環境介質中檢出。大量研究表明,紫外吸收劑可在生物體內富集并沿食物鏈生物放大[14-15],且具有遺傳毒性[16]、生殖發育毒性[8,17]和內分泌干擾毒性[18-19]等效應,已成為一類新型污染物。由于高度親脂性[2],水環境中紫外吸收劑易聚集在沉積物中,因此,相對于其他上層水生生物,底棲動物更容易受到暴露。另外,湖泊作為紫外吸收劑重要的受納水體,由于流動性較差,且與外界交換較少,容易導致污染物聚集。因此,本文以湖泊為研究對象,重點介紹紫外吸收劑在湖泊環境中的分布及其對底棲動物的毒性效應。

表1 化合物縮寫釋義補充Table 1 Supplementary explanation of compound abbreviation

圖1 典型紫外吸收劑的結構和物理化學特性Fig. 1 Structure and physicochemical characteristics of most frequently detected UV absorbers
1 紫外吸收劑在湖泊中的分布(The distribution of UV absorbers in the lake environment)
由于環境介質中紫外吸收劑的濃度相對較低(ng·L-1~μg·L-1水平),且為避免環境樣品中復雜基質的影響,提高分析精度,通常需要在測定前對樣品進行適當的預處理,以便進行后續分析。目前針對水樣中紫外吸收劑的前處理方法主要有固相萃取(solid-phase extraction, SPE)[12,20]、固相微萃取(solid-phase microextraction, SPME)[21]和液-液萃取(liquid-liquid extraction, LLE)[6]等。常用的測定方法主要包括氣相色譜-串聯質譜法(GC-MS/MS)[22-23]、液相色譜/高效液相色譜-串聯質譜法(LC/HPLC-MS/MS)[20,24-25]等。隨著分析方法的優化,目前測定紫外吸收劑的檢測限可降低至0.1~0.5 ng·L-1(或ng·g-1)[11,26],使得這類化合物近年來在環境中不斷檢出。
1.1 湖泊環境中紫外吸收劑的濃度
由于紫外吸收劑結構等不同,所以親脂性有差異,故其在環境中的分布也有一定差異性。在討論有機污染物在不同環境介質(水、沉積物或脂肪)中的分布時,常用正辛醇-水分配系數(octanol-water partioning coefficient,Kow)作為其分配平衡時的參數。研究發現,當logKow>4時,可認為紫外吸收劑具有較高的親脂性[27]。二苯甲酮類紫外吸收劑(如:BP-1)的logKow值較小,在水中溶解度高,故在湖泊水體中檢出率較高。苯并三唑類紫外吸收劑(如:UV-329)有較高的logKow值,在水中的溶解度很低,故在水中不易被檢出,但在土壤/沉積物中檢測率較高。
國內關于湖泊中紫外吸收劑的研究非常有限,大部分研究集中于河流(如:珠江流域[2]、黃浦江[28])、海洋[9]及市政污水[5]。根據已有報道,紫外吸收劑在湖泊水體中的濃度大約在ng·L-1~μg·L-1,其中,BP-3、OC和4-MBC的檢出率較高,最高濃度均達到μg·L-1級別(表2)。如Haunschmidt等[29]通過實時質譜(direct analysis in real-time mass spectrometry, DART-MS)和熱解析-氣相-質譜法(thermal desorption-gas chromatography-mass spectrometry, TD-GC-MS)2種方法對某湖泊水體中8種紫外吸收劑進行研究,均可檢測到BP-3和OC,其中OC的濃度分別達到1 400 ng·L-1和1 710 ng·L-1。另外,德國Cospuden湖水樣中檢測到的紫外吸收劑中,IAMC、4-MBC、OC和OD-PABA的濃度均達到μg·L-1(1.14~3.05 μg·L-1)級[30-31]。研究表明,市政污水及生活污水的直接排放是湖泊水環境中紫外吸收劑的主要來源。Ma等[26]對南京玄武湖、秦淮河和長江等水體中8種紫外吸收劑的濃度進行分析,發現BM-DBM、OD-PABA、BP-3、BP-4和BP-1的檢出率為100%,EHMC、HMS和4-MBC的檢出率分別為94.7%、78.9%和21.3%;其中,BP-4濃度最高,為329 ng·L-1,其他化合物的平均濃度在0.764~11.6 ng·L-1之間,且通過不同采樣點水樣中化合物濃度比較發現,湖泊入河口及污水排放匯流處下游的紫外吸收劑濃度均高于其他采樣點。韓雪等[27]對巢湖入湖河流中12種紫外吸收劑含量進行調查,發現位于污水處理廠下游水體中有機紫外吸收劑總含量普遍高于污水處理廠上游,流經人口密集區的河段中污染物總含量明顯高于偏遠地區。Balmer等[12]通過對瑞士4個湖泊紫外吸收劑濃度的比較,同樣得出人類活動對紫外吸收劑濃度有直接影響。
而對于天然湖泊或受人類活動影響較小的湖泊水體,紫外吸收劑的濃度相對較低(
1.2 湖泊底棲動物體內紫外吸收劑的濃度
底棲動物具有分布廣、活動性低的特點,與其他湖泊水生生物相比,因其對污染物敏感度更高且活動區域固定,可直接反映水體受污染程度而備受關注[37]。湖泊環境中常見的底棲動物有搖蚊幼蟲(如:中國長足搖蚊(Tanypuschinensis)、花翅前突搖蚊(Procladiuschoreus),寡毛類(如:蘇氏尾鰓蚓(Branchiurasowerbyi)、霍夫水絲蚓(Limnodrilushoffmeisteri)),腹足類(如:銅銹環棱螺(Bellamyaaeruginosa)、紋沼螺(Parafossarulusstriatulus)),雙殼類(如:背角無齒蚌(Anodontawoodiana)、河蜆(Corbiculafluminea))等[38]。
大量研究表明,紫外線吸收劑的親脂性較強,如大部分苯并三唑類紫外光穩定劑(benzotriazole UV stabilizers, BUVSs)的logKow>6,因此這類物質極易在生物體內富集。目前,紫外吸收劑已在無脊椎動物、魚類、海洋哺乳類動物以及鳥類等多種生物體內檢出[39-40]。如Balmer等[12]對瑞士Zürichsee、Greifensee和Hüttnersee湖中湖擬鯉(Rutilusrutilus)體內的4-MBC進行測定,發現4-MBC在魚體內的濃度(44~166 ng·g-1脂重(lipid weight, lw))顯著高于其在水中的濃度(2~40 ng·L-1)。
相對于上層水生生物,底棲動物由于長期生活在紫外吸收劑濃度相對更高的底泥中,可能受到的暴露風險更高。然而目前,關于紫外吸收劑在底棲動物中富集的報道相對較少,其中主要集中于雙殼類(表3)。Fent等[15]分析了瑞士Glatt河及Greifen湖流域中9種紫外吸收劑的分布,發現BP-3、4-MBC和EHMC是檢出率最高的化合物,濃度為6~68 ng·L-1,其中EHMC在大型無脊椎動物和魚類體內的濃度達337 ng·g-1lw,在斑馬貽貝(Dreissenapolymorpha)和鉤蝦(Gammarussp.)體內的濃度在22~150 ng·g-1lw之間。另外,Bachelot等[41]在法國沿海地區的藍貽貝(Mytilusedulis)和紫貽貝(Mytilusgalloprovincialis)體內也檢測到EHMC,濃度范圍在3~256 ng·g-1dw之間。Picot Groz等[42]在葡萄牙海岸的紫貽貝組織中,檢測到OC、EHMC和OD-PABA的最高濃度分別為3 992、1 765和833 ng·g-1dw。Nakata等[9]在對亞太地區沿海水域中綠貽貝(Pernaviridis)和藍貽貝體內BUVSs的調查中發現,UV-326和UV-328是最主要的污染物,最高濃度分別達到1 500和830 ng·g-1lw。此外,研究表明這類物質容易在魚類的肝臟和肌肉組織中富集[43]。如Buser等[44]在瑞士7條河流的褐鱒魚(brown trout,Salmotruttafario)的肌肉組織中均檢測到4-MBC和OC,最高濃度分別高達1 800和2 400 ng·g-1lw。然而關于紫外吸收劑在底棲動物不同組織中的分布、富集尚不清晰,今后應開展相應研究,以進一步闡明該類化合物在底棲動物不同組織中的富集規律。
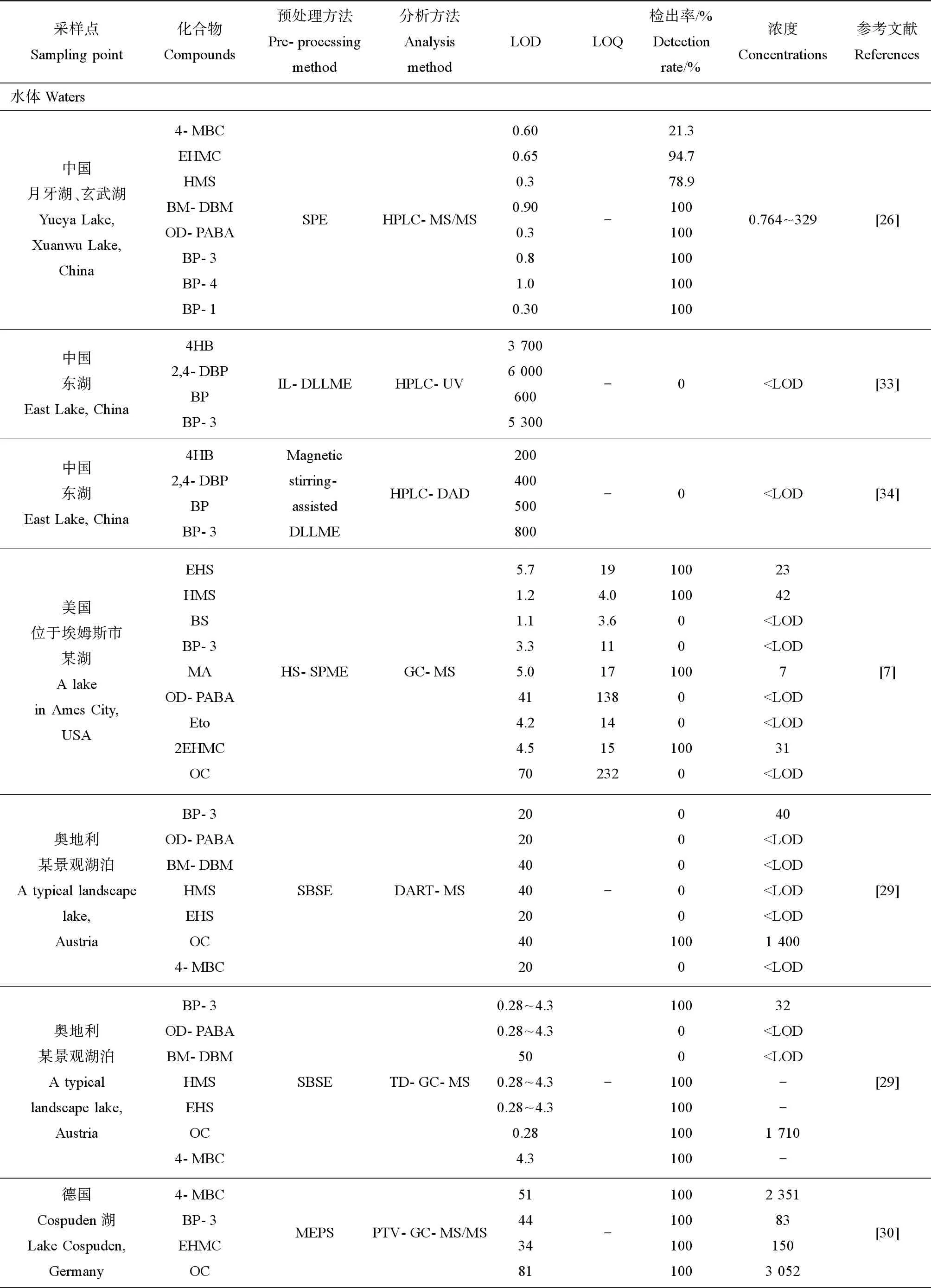
表2 湖泊水體和沉積物中紫外吸收劑的分析方法和濃度Table 2 Analytical methods and concentrations of UV absorbers in lake waters and sediments
注:LOD表示檢測限,LOQ表示定量限,“-”表示數據未提供,
Note: LOD stands for limits of detection; LOQ stands for limits of quantification; “-” stands for data not provided;
2 紫外吸收劑對底棲動物的毒性效應(The toxicological effects of UV absorbers on benthic animals)
隨著紫外吸收劑在水體和水生生物體內不斷檢出,該類化合物潛在的健康效應和生態毒理效應引起了廣泛的關注。相對于魚類等其他水生生物,紫外吸收劑對底棲動物的毒性研究十分有限,目前大部分工作以搖蚊幼蟲為研究對象,已有研究表明,該類物質可干擾底棲動物的抗氧化系統和內分泌系統,影響幼體的生長和發育。
2.1 急性毒性研究
根據已有報道,紫外吸收劑對水生生物的急性毒性在mg·L-1水平。Kim等[45]報道了9種BUVSs(UV-9、UV-234、UV-320、UV-326、UV-327、UV-328、UV-329、UV-571和UV-360)對大型溞(Daphniamagna)的急性毒性,其中UV-571的24 h-LC50和48 h-LC50分別為6.35和2.59 mg·L-1,其余BUVSs的LC50值均大于10 mg·L-1。Li[46]對14種二苯甲酮類紫外吸收劑對日本三角渦蟲(Dugesiajaponica)的急性毒性進行了測試,得出其48 h-LC50為0.9~145 mg·L-1,96 h-LC50為0.5~77 mg·L-1,其中BP-3毒性最高。Du等[47]分析了BP-3和BP-4對小球藻(Chlorellavulgaris)、大型溞(D.magna)和斑馬魚(Brachydaniorerio)的急性毒性,得到BP-3和BP-4對小球藻的96 h-EC50值分別為2.98和201 mg·L-1;BP-3和BP-4對大型溞的48 h-LC50分別為1.09和47.47 mg·L-1;BP-3和BP-4對斑馬魚的96 h-LC50分別為3.89和633.00 mg·L-1。
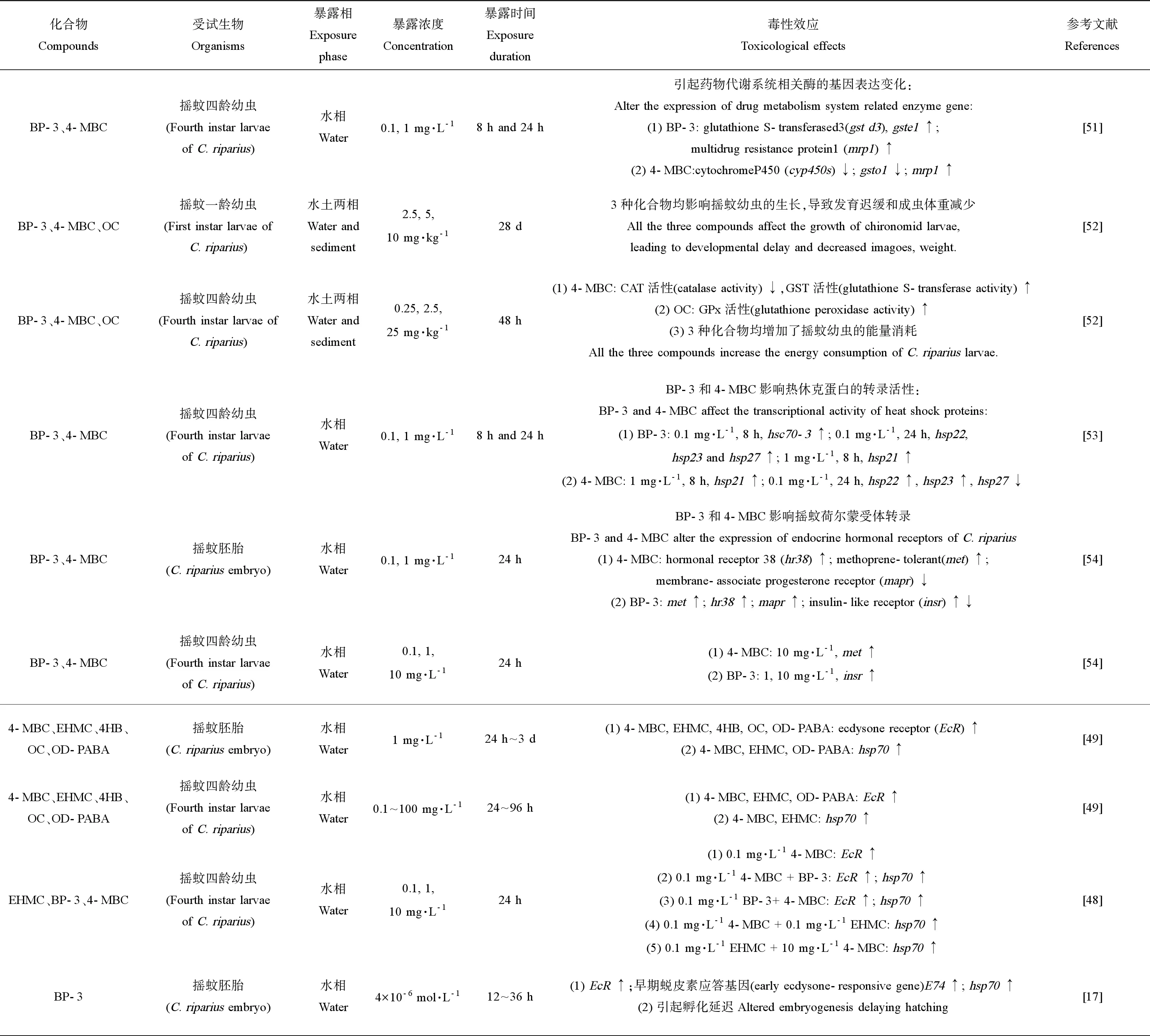
相對于魚類、大型溞等,目前關于紫外吸收劑對底棲動物的毒性研究十分有限,已有研究集中于搖蚊幼蟲(Chironomusriparius),此外霍夫水絲蚓(L.hoffmeisteri)和蘿卜螺(Radixauricularia)等底棲動物也開始受到關注(表4)。4-MBC、EHMC、OD-PABA、OC、4HB和BP-3對搖蚊四齡幼蟲的96 h急性暴露實驗中,BP-3的急性毒性最高,其LC50為1.709 mg·L-1;OC的急性毒性最低,LC50為95.9 mg·L-1[48-49]。而在聯合暴露時,紫外吸收劑的毒性與單一化合物暴露時有所差別,表現為協同或拮抗效應。如Ozáez等[48]研究二元混合物對搖蚊幼蟲的急性毒性時發現,4-MBC和BP-3/EHMC聯合暴露時的96 h-LC50值較各化合物單獨暴露時大,表明聯合暴露后,化合物對搖蚊幼蟲的毒性作用減小,化合物之間具有拮抗作用。

表3 紫外吸收劑在底棲動物體內的濃度Table 3 Concentrations of UV absorbers in benthic animals
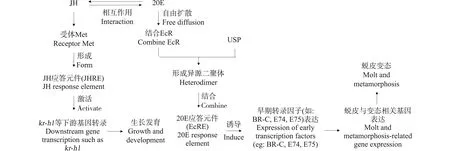
注:dw表示干重,lw表示脂重,ww表示濕重; Note: dw stands for dry weight; lw stands for lipid weight; ww stands for wet weight; 盡管紫外吸收劑對水生生物的急性毒性較低,但國內外學者在紫外吸收劑對水生生物的分子效應及酶活等生理生化的影響方面開展了大量研究,表明其具有亞急性及慢性毒性效應,且主要作用于抗氧化系統和內分泌系統。目前關于紫外吸收劑對底棲動物的報道較少,已有研究多集中于對搖蚊幼蟲的研究(表5)。此外,帶絲蚓(Lumbriculusvariegatus)、淡水螺(Potamopyrgusantipodarum)等底棲動物開始受到關注。 2.2.1 對藥物代謝系統的影響 根據已有報道,在無脊椎生物的代謝過程中,胰島素途徑調節脂質和碳水化合物的儲存,在類固醇合成和藥物代謝等方面起著重要作用[57-58]。Ozáez等[54]將搖蚊幼蟲和胚胎暴露于BP-3和4-MBC中,發現2種化合物均可干擾荷爾蒙受體相關基因的表達,而只有BP-3改變了胰島素樣受體基因(insulin-like receptor,insr)的mRNA水平,說明BP-3在代謝過程中很可能通過干擾胰島素代謝途徑影響搖蚊幼蟲的生長發育。另外,在藥物代謝系統中,細胞色素P450酶(cytochrome P450, Cyp450)發揮著重要的作用。Cyp450廣泛存在于各組織器官中,主要參與代謝外源性物質以及內源性生理化合物在體內的氧化、還原和水解等3種I相反應,從而參與內分泌代謝和其他代謝過程[51,59]。Martinez-Guitarte[51]分析了搖蚊幼蟲在4-MBC或BP-3暴露下4種不同的cyp450基因(cyp4d2、cyp6b7、cyp9f2和cyp12a2)的表達,結果顯示,低濃度4-MBC(0.1 mg·L-1)暴露24 h后cyp9f2顯著下調,而1 mg·L-14-MBC暴露24 h后,所有cyp450s的mRNA水平均被顯著抑制;BP-3對這些基因的轉錄活性并未產生顯著影響,這些結果說明,4-MBC很可能通過影響cyp450的表達,干擾細胞對化學應激的反應能力及其在細胞內的生物代謝過程,從而對生物體產生不利影響。 表4 紫外吸收劑對底棲動物的急性毒性Table 4 Acute toxicity of UV absorbers to benthic animals 注:“-”表示數據未提供。 Note: “-” stands for data not provided. 表5 紫外吸收劑對底棲動物的毒性效應研究Table 5 Toxicological effects of UV absorbers on benthic animals 此外,紫外吸收劑由于其結構差異,經生物體代謝其毒性可能被抑制或活化。Molina-Molina等[18]通過檢測4種二苯甲酮類紫外吸收劑對雌激素受體的轉錄激活作用,發現BP-3的半數有效濃度(EC50)高于其代謝產物BP-1和BP-2,說明BP-3經代謝后毒性降低。Zhuang等[19]報道了BUVSs經CYP3A4酶代謝后抗雄激素活性發生變化,其中UV-328經CYP3A4酶代謝后抗雄激素活性顯著提高,而UV-P經代謝后抗雄激素活性降低。因此,不同結構的紫外吸收劑的毒性效應和作用機制很可能與其代謝特征相關。 2.2.2 影響抗氧化系統 生物體在受到外界污染物刺激時會產生氧化應激,導致生物體內活性氧(reactive oxygen species, ROS)等自由基的增加或形成,當自由基過量時會導致氧化脅迫和氧化損傷[60]。而抗氧化酶系統在氧化應激時起著關鍵作用,生物體內主要的抗氧化酶包括超氧化物歧化酶(superoxide dismutase, SOD)、過氧化氫酶(catalase, CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase, GPx)、谷胱甘肽S-轉移酶(glutathione S-transferase, GST)和谷胱甘肽還原酶(glutathione reductase, GR)[37]。這些抗氧化酶相互協調,維持著機體氧化和抗氧化平衡。其中SOD可以通過催化ROS和H+的反應將活性氧轉化為H2O2和H2O,產生的H2O2在CAT的作用下經兩步氧化還原反應生成H2O和O2,而使生物體免受氧化損傷的危害。當污染物進入生物體中,會和機體解毒酶(如GST)結合進行生物轉化,而在解毒過程中會產生大量氧自由基,谷胱甘肽(glutathione, GSH)及其相關酶則通過與還原型輔酶Ⅱ(NADPH)共同作用,將有毒的過氧化物還原成羥基化合物或通過結合反應將活化的中間產物代謝解毒,防止細胞膜等生物組織受到氧化損傷[61]。Campos等[52]將搖蚊四齡幼蟲分別暴露于0.25~25 mg·L-1BP-3、4-MBC和OC 48 h后,對抗氧化系統相關酶的活性進行了測試,結果表明,在4-MBC暴露下,CAT活性降低,GST活性增加,而在OC暴露下搖蚊幼蟲體內的總谷胱甘肽水平增加。Martinez-Guitarte[51]將搖蚊四齡幼蟲在4-MBC和BP-3暴露8 h和24 h后,對GST相關基因(gstd3、gstd6、gste1、gsto1和gstt1)的mRNA水平進行了測定,結果顯示,gsto1在0.1 mg·L-14-MBC暴露24 h后顯著下調,而在0.1 mg·L-1BP-3暴露8 h后,gstd3和gste1顯著上調。這些結果表明紫外吸收劑可在基因和酶活水平上引起搖蚊幼蟲的氧化應激。 在氧化應激反應中,熱休克蛋白(heat shock proteins, Hsp)作為分子伴侶,有助于新生蛋白的正確折疊,防止蛋白質聚集和變性[62],從而保護細胞蛋白質,此外研究發現其在免疫防御中也起著重要作用[63]。Hsp70是氧化應激反應中研究最多的熱休克蛋白之一,已經證明多種紫外吸收劑(4-MBC、OD-PABA、OC、EHMC和BP-3)可以改變hsp70的mRNA水平[48,53]。例如:Ozáez等[49]將搖蚊受精卵暴露于0.1~100 mg·L-1的4-MBC、EHMC、4HB、OC和OD-PABA中24 h,發現4-MBC、OD-PABA和OC觸發hsp70應激基因的轉錄激活,出現顯著上調。另外,Ozáez等[48]用幾種紫外吸收劑對搖蚊幼蟲進行聯合暴露,發現4-MBC與BP-3或EHMC聯合暴露時,hsp70 mRNA水平較4-MBC單一暴露時高,表明4-MBC和BP-3/EHMC對搖蚊幼蟲hsp70基因轉錄活性的影響具有協同作用。 2.2.3 生長發育毒性 研究表明,紫外吸收劑會影響底棲動物的生長發育,已有的毒性研究多集中于搖蚊幼蟲。在搖蚊幼蟲的生長發育過程中,蛻皮激素(20-hydroxyecdysone, 20E)和保幼激素(juvenile hormone, JH)滴度隨著發育階段的不同發生變化,20E誘導搖蚊幼蟲的蛻皮變態,而JH控制蛻皮的性質與方向,2種激素相互作用,共同調節幼蟲的生長、發育、蛻皮及變態[64-65]。研究發現,保幼激素受體(Methoprene-tolerant, Met)是JH的細胞內受體[54],受體Met與JH結合后形成JH應答元件(JH response element, JHRE),進而激活下游kr-h1(Kruppel homolog)等基因的表達[64],調控搖蚊幼蟲的生長發育(圖2)。 圖2 蛻皮激素(20E)和保幼激素(JH)在搖蚊幼蟲發育調控中的分子機制注:EcR表示蛻皮激素受體,USP表示超氣門蛋白。Fig. 2 The molecular mechanisms underlying the action of 20-hydroxyecdysone (20E) and juvenile hormone (JH) in regulating C. riparius larva development Note: EcR stands for ecdysone receptor; USP stands for ultraspiracle. 蛻皮激素受體(ecdysone receptor, EcR)是在無脊椎動物中發現的配體依賴性核轉錄因子[66-67],屬核受體(nuclear receptor, NR)超家族的成員,并且是配體誘導型核轉錄因子[66]。在搖蚊幼蟲的蛻皮變態過程中,20E與EcR結合后,需要先與超氣門蛋白(ultraspiracle, USP)形成非共價異二聚體,然后選擇性結合20E應答元件(20E response element, EcRE),進而調節早期轉錄因子(如:BR-C、E74和E75等)及蛻皮與變態相關基因的表達,調控搖蚊幼蟲的蛻皮變態[64,68](圖2)。 已有研究表明,紫外吸收劑BP-3、4-MBC、EHMC和OD-PABA等均可干擾EcR基因的表達。Ozáez等[55]發現搖蚊幼蟲在0.1~10 mg·L-1的4-MBC、EHMC或OD-PABA中暴露24 h后,EcR基因顯著上調,呈顯著的劑量-效應關系。Ozáez等[54]將搖蚊胚胎分別暴露于0.1和1 mg·L-14-MBC和BP-3中,發現在所有暴露組中met基因表達均顯著增加,搖蚊幼蟲在相同條件下暴露,只有1 mg·L-1BP-3暴露下met基因表達受到影響,表現為增加;將搖蚊幼蟲暴露于10 mg·L-14-MBC和BP-3,發現met基因均顯著增加。Ozáez等[49]將搖蚊胚胎和幼蟲分別暴露于1 mg·L-1的4-MBC、EHMC、4HB、OC和OD-PABA中,發現所有化合物對胚胎EcR的轉錄均有影響,暴露24 h后,EcRmRNA水平比對照高2~6倍;而在幼蟲中,只有4-MBC、EHMC和OD-PABA上調了EcR基因,這些結果表明胚胎對紫外吸收劑的暴露較幼蟲更敏感。 紫外吸收劑可通過干擾搖蚊荷爾蒙受體通路中EcR及其相關基因的表達影響其生長發育。Ozáez等[17]將搖蚊胚胎暴露于BP-3(4×10-6mol·L-1),發現暴露12 h后,EcR的表達量增加了15倍,同時,BP-3暴露24 h后,E74蛻皮激素-早期響應基因的mRNA水平增加約4倍。而EcR和E74的上調導致了搖蚊胚胎孵化延遲。Campos等[52]將搖蚊一齡幼蟲分別暴露于0.25~25 mg·kg-1的BP-3、4-MBC和OC中,發現3種化合物均影響了搖蚊幼蟲的生長,引起發育遲緩和成蟲體重減少等發育毒性效應。另外,Schmitt等[56]將帶絲蚓和淡水螺分別暴露于0.08~50 mg·kg-1的3-BC或4-MBC中,發現帶絲蚓在高濃度3-BC和4-MBC暴露28 d后繁殖率均降低;淡水螺在3-BC和4-MBC暴露56 d后,所有暴露濃度組無殼胚胎數量均顯著增加,但是死亡率僅在最高暴露濃度組增加。 (1)目前,關于紫外吸收劑對底棲動物的毒性效應研究十分有限,尤其是苯并三唑類紫外吸收劑,且大部分研究以搖蚊作為模式生物,而針對河蜆等雙殼類底棲動物的毒性研究未見報道,亟待開展。 (2)關于紫外吸收劑在底棲動物中的吸收、富集和代謝模式尚不清晰,尤其是不同結構的化合物經生物轉化后,其毒性的變化及其對生物的表型效應之間的關系仍不明確,今后應開展相應研究,以進一步闡明該類化合物的毒性效應及其作用機制。 (3)紫外吸收劑的生態毒理效應及其生態風險評價剛剛起步,目前的研究仍集中于環境濃度分析及有限的毒性效應研究,而針對該類物質的生態風險評價仍十分匱乏,因此,在推進紫外吸收劑毒性研究的基礎上,應加強其生態風險評價研究。2.2 亞急性及慢性毒性研究

3 展望(Future prospects)

